Журнал «Здоровье ребенка» Том 13, №8, 2018
Вернуться к номеру
Результати мікробіологічного моніторингу бактеріальних збудників респіраторного тракту у дітей за 2017 рік
Авторы: Леженко Г.О., Пашкова О.Є.
Запорізький державний медичний університет, м. Запоріжжя, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У роботі наведено результати бактеріологічного моніторингу протягом 2017 року 483 дітей із м. Запоріжжя й Запорізької області віком від 3 до 14 років, хворих на гострі респіраторні захворювання. Встановлено, що за наявності бактеріальної етіології респіраторної інфекції провідними збудниками були Streptococcus pneumoniae (49,4 %) і бактерії роду Haemophilus (36,2 %). Проведений аналіз антибіотикограм показав, що найбільшу чутливість зазначені мікроорганізми проявляли щодо цефалоспоринів ІІІ–IV покоління, ванкоміцину, лінезоліду й левофлоксацину. Відмічалася висока антибіотикорезистентність Streptococcus pneumoniaе до пеніцилінів (56,0 % штамів), кліндаміцину (43,0 % штамів) і еритроміцину (45,0 % штамів). Ізоляти бактерій роду Haemophilus найчастіше проявляли резистентність до ампіциліну (58,1 % штамів) і захищених пеніцилінів (52 % штамів). На основі отриманих даних обґрунтована доцільність застосування антибіотика з групи цефалоспоринів ІІІ покоління цефподоксиму проксетилу як стартового антибактеріального препарату в терапії гострої бактеріальної респіраторної інфекції в дітей.
В работе приведены результаты бактериологического мониторинга в течение 2017 года 483 детей из г. Запорожья и Запорожской области в возрасте от 3 до 14 лет, больных острыми респираторными заболеваниями. Установлено, что при наличии бактериальной этиологии респираторной инфекции ведущими возбудителями были Streptococcus pneumoniae (49,4 %) и бактерии рода Haemophilus (36,2 %). Проведенный анализ антибиотикограммы показал, что наибольшую чувствительность указанные микроорганизмы проявляли к цефалоспоринам III–IV поколения, ванкомицину, линезолиду и левофлоксацину. Отмечалась высокая антибиотикорезистентность Streptococcus pneumoniaе к пенициллину (56,0 % штаммов), клиндамицину (43,0 % штаммов) и эритромицину (45,0 % штаммов). Изоляты бактерий рода Haemophilus наиболее часто проявляли резистентность к ампициллину (58,1 % штаммов) и защищенным пенициллинам (52 % штаммов). На основе полученных данных обоснована целесообразность применения антибиотика из группы цефалоспоринов III поколения цефподоксима проксетила в качестве стартового антибактериального препарата в терапии острой бактериальной респираторной инфекции у детей.
The article presents the results of bacteriological monitoring of 483 children aged 3 to 14 years with acute respiratory diseases in Zaporizhzhia and Zaporizhzhia region in 2017. It was found that leading pathogens were Streptococcus pneumoniae (49.4 %) and bacteria of the genus Haemophilus (36.2 %) in the presence of bacterial respiratory infection. The analysis of the antibiotic susceptibility patterns showed that the microorganisms demonstrated the highest sensitivity to the third-/fourth-generation cephalosporins, vancomycin, linezolid and levofloxacin. There was noted a high antibiotic resistance of Streptococcus pneumoniae to penicillins (56 % of strains), clindamycin (43 % of strains) and erythromycin (45 % of strains). The isolates of bacteria of the genus Haemophilus most often showed resistance to the ampicillin (58.1 % of strains) and protected penicillins (52 % of strains). On the basis of obtained data, there was substantiated the expediency of using cefpodoxime proxetil, the third-generation cephalosporin, as the starting antibacterial drug in the therapy of acute bacterial respiratory infection in children.
гострі бактеріальні респіраторні захворювання; діти; Streptococcus pneumoniaе; Haemophilus spp.; цефподоксиму проксетил
острые бактериальные респираторные заболевания; дети; Streptococcus pneumoniaе; Haemophilus spp.; цефподоксима проксетил
acute bacterial respiratory diseases; children; Streptococcus pneumoniae; Haemophilus spp.; cefpodoxime proxetil
Вступ
Проблема росту антибіотикорезистентності надзвичайно актуальна в усьому світі. Виникнення стійкості мікрофлори до антибіотиків і значне поширення стійких і панрезистентних штамів мікроорганізмів значно знижують ефективність антибактеріальної терапії. На Всесвітньому економічному форумі «Глобальні ризики» зазначено, що стійкість до антибіотиків є однією з найсерйозніших загроз здоров’ю людини [1–3]. За оцінками, у Європі на лікування антибіотикорезистентних бактеріальних інфекцій, від яких щорічно вмирають 25 000 осіб, витрачається до 1,5 млрд євро на рік [1]. У Сполучених Штатах щорічно понад 2 мільйони осіб інфікуються антибіотикорезистентними бактеріями, а 23 000 смертей є прямим результатом множинних лікарсько-стійких бактеріальних інфекцій [4, 5].
Появу й поширення резистентних штамів мікроорганізмів пов’язують із різними факторами, проте одним із найбільш важливих є нераціональне використання антибіотиків [6, 7]. В основі раціонального вибору антибактеріальних препаратів для емпіричної терапії бактеріальних інфекцій лежать знання про спектр ключових збудників і їх чутливість до засобів етіотропної терапії, що повинні спиратися на регіональні дані [8, 9].
Мета дослідження: аналіз етіологічної структури й профілю антибіотикорезистентності збудників гострих респіраторних інфекцій у дітей Запорізької області за 2017 рік.
Матеріали та методи
У дослідження були включені 483 дитини віком від 3 до 14 років, які були госпіталізовані у відділення КУ «Запорізька обласна дитяча лікарня» ЗОР протягом 2017 року у зв’язку з підозрою на наявність гострої бактеріальної респіраторної інфекції, серед яких у 96 хворих було діагностовано тонзилофарингіт, у 28 пацієнтів — риносинусит, 61 дитина хворіла на гострий бронхіт, у 169 дітей встановлено гостру пневмонію. До надходження в стаціонар пацієнти не отримували антибактеріальної терапії. Для встановлення етіологічного збудника гострих респіраторних захворювань і визначення його чутливості до антибіотиків у всіх дітей були взяті зразки біоматеріалу: за наявності захворювань верхніх дихальних шляхів проводився засів назофарингеального аспірату, при діагностиці інфекцій нижніх дихальних шляхів досліджувалося мокротиння. Збір біоматеріалу проводили вранці натще. Як транспортну систему використано пробірки з транспортним середовищем Amies. Клінічні зразки доставляли в лабораторію протягом 1 години після забору матеріалу й засівали на готові живильні середовища, виготовлені в заводських умовах: кров’яний агар колумбійський (ВioMérieux, Франція), селективний шоколадний агар (ВioMérieux, Франція). На користь етіологічної значущості виділеного мікроорганізму свідчила наявність ІІІ (понад 104 КУО/мл)
або IV ступеня росту (105 КУО/мл). Визначення видів і чутливості до антибіотиків грампозитивних і грамнегативних бактерій проводилося на бактеріологічному аналізаторі VITEK 2 Compact (ВioMérieux, Франція) з використанням програмного забезпечення AES: Global CLSI-based + Phenotypic. Чутливість до антибіотиків враховувалася відповідно до таблиць SLSI та EUCAST (2017) [10]. Активність напівсинтетичних пеніцилінів щодо мікроорганізмів досліджували, згідно з рекомендаціями EUCAST 2017 року, на підставі чутливості патогенів до оксациліну [10].
Результати та обговорення
За результатами бактеріологічного дослідження назофарингеального аспірату й мокротиння 483 госпіталізованих хворих на гострі респіраторніх захворювання було виділено 354 штамів етіологічно значущих мікроорганізмів (табл. 1).
Отже, наявність гострої бактеріальної інфекції респіраторного тракту було підтверджено в 73,3 % госпіталізованих дітей. Проведений аналіз показав, що найбільш частою причиною розвитку респіраторних інфекцій бактеріальної етіології в дітей були грампозитивні мікроорганізми, на частку яких припадало 53,1 % усіх виділених культур, серед яких найчастіше верифікувався Streptococcus pneumoniae — 175 штамів (49,4 %). На частку клінічно значущого збудника Streptococcus pyogenes припадає 2,2 %. У поодиноких випадках виявлялися Staphylococcus aureus (0,8 %) і b-гемолітичний Streptococcus групи G (0,6 %).
Серед грамнегативних бактерій, яких було виділено й ідентифіковано 166 (46,9 %) штамів, найчастіше зустрічалися бактерії роду Haemophilus (36,2 %). Друге й третє місце за частотою виявлення серед грамнегативної мікрофлори посідали Klebsiella pneumoniae (7,3 %) і Moraxella catarrhalis (2,8 %). По одному випадку (0,3 %) як етіологічний збудник було верифіковано Escherichia coli й Acinetobacter baumannii.
Отже, вивчення етіологічної структури гострих респіраторних інфекцій у дітей показало, що найбільш поширеними бактеріальними збудниками гострих респіраторних інфекцій у госпіталізованих хворих залишаються Streptococcus pneumoniae та бактерії роду Haemophilus.
На наступному етапі роботи ми дослідили частоту виявлення вищезазначених мікроорганізмів залежно від нозологічної форми респіраторної інфекції (рис. 1).
Як показано на рис. 1, у структурі виділених мікроорганізмів при засівах назофарингеального аспірату спостерігалося домінування бактерій роду Haemophilus, які виявлялися в більшості випадків гострих захворювань верхніх дихальних шляхів. При цьому частота їх виділення при тонзилофарингіті становила 53,2 %, а при риносинуситі — 55,5 %. У той же час за наявності в дитини захворювання нижніх дихальних шляхів за результатами культурального дослідження мокротиння було відмічено переважання Streptococcus pneumoniae, що закономірно посідав головну позицію при пневмонії, тобто частота його виділення становила 64,1 %. При гострому бронхіті Streptococcus pneumoniae й бактерії роду Haemophilus виступали збудниками захворювання майже з однаковою частотою — 31,8 і 21,9 % відповідно.
Наявність бактеріальної інфекції в дітей потребувала призначення антибактеріальної терапії, вибір якої проводився з урахуванням чутливості за даними антибіотикограм.
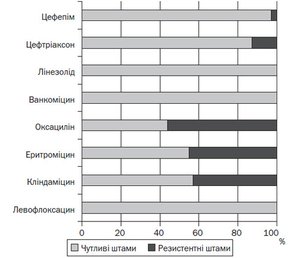
При аналізі антибіотикограм встановлено, що Streptococcus pneumoniae проявляв 100% чутливість до дії левофлоксацину, ванкоміцину й лінезоліду (рис. 2).
Зберігалася висока чутливість Streptococcus pneumoniae до дії цефалоспоринів III і IV покоління (цефтріаксону й цефепіму), однак слід зазначити, що за результатами дослідження 2017 року виявлено 12,6 і 2,9 % (відповідно) резистентних штамів, на той час як у 2013 році (за нашими даними) їх ще не було [11]. Чутливість Streptococcus pneumoniae до кліндаміцину й еритроміцину досягала лише 57,0 і 55,0 % відповідно. Найменшу ефективність мав оксацилін (метицилін), до якого чутливість мали менше від половини штамів мікроорганізму (44,0 %).
Аналіз чутливості штамів бактерій роду Haemophilus до дії антибактеріальних препаратів показав 100% чутливість до левофлоксацину й хлорамфеніколу (рис. 3). Другу позицію в спектрі антибактеріальної чутливості посідали цефалоспорини четвертого й третього покоління, тобто цефепім, резистентність до якого мали лише 4,8 % штамів, і цефтріаксон, що проявляв антибактеріальну активність до мікроорганізмів роду Haemophilus у 82,8 % випадків.
Відмічено високу частоту резистентності бактерій роду Haemophilus до ампіциліну (58,1 %). Викликає тривогу факт поширення штамів Haemophilus, резистентних до захищених пеніцилінів, чутливість до яких становила 48,0 %. У жодному випадку не було отримано чутливості Haemophilus до макролідів. Проведені нами дослідження показали, що основна частина бактерій роду Haemophilus (92 %) була здатна до синтезу цефінази, що обумовлювало резистентність мікроорганізмів до амінопеніцилінів і цефалоспоринів.
На сучасному етапі резистентні штами Streptococcus pneumoniae значно поширені. Частка пеніциліннечутливих штамів варіює від 1–5 % у Великобританії, Німеччині, Австрії, Норвегії та Швеції до 25–50 % в Іспанії, Франції, Греції й Ізраїлі [12, 13]. За даними досліджень TEST, у глобальному масштабі знижену чутливість до пеніциліну мають 33 % Streptococcus pneumoniae [12]. Резистентність Streptococcus pneumoniae до макролідів настільки ж різниться, як і його стійкість до пеніцилінів: 25–50 % у Франції, Італії й Греції; 10–25 % в Іспанії, Португалії, Великобританії, Німеччині, Польщі, Норвегії та Фінляндії; 1–5 % у Латвії й Швеції, що в середньому становить 23 % [13, 14]. Дані дослідження PROTEKT (1999–2002 рр.) свідчать, що близько 40 % Streptococcus pneumoniae мають мультирезистентні фенотипи, що проявляють стійкість до трьох або більше антибіотиків, з високою варіабельністю показників поширеності в різних країнах (від 97,3 і 92,7 % ізолятів у Китаї й Тайвані до 4,6 і 3,8 % у Великобританії й Росії відповідно) [13, 15]. Дані дослідження PROTEKT показали, що серед стійких до пеніциліну резистентних ізолятів у всьому світі корезистентність до макролідів спостерігається в 72–75 %, до тетрацикліну — в 65–72 %, а також корезистентність до ко-тримоксазолу — в 69–74 % ізолятів [15].
Важливу роль в еволюції Streptococcus pneumoniae відіграє генетична трансформація мікроорганізму, що призводить до збірки мозаїчних антибіотикорезистентних генів і розвитку декількох моделей стійкості до антибіотиків [13]. Антибактеріальна активність b-лактамів пов’язана з їх здатністю зв’язуватися з пеніцилінзв’язувальними протеїнами (penicillin binding proteins, PBPs) — ферментами, що беруть участь у заключних етапах синтезу клітинної стінки, і пригнічувати синтез і ремоделювання пептидогліканів. Це приводить до порушення цілісності клітинної стінки, затримки росту бактерій або їх лізису. Резистентність Streptococcus pneumoniae до пеніциліну й інших b-лактамних антибіотиків обумовлена зміною РВР [16].
Стійкість Streptococcus pneumoniae до макролідів опосередкована трьома основними механізмами, до яких належать: зміни ділянки рибосомальної мішені, ефлюкс антибіотика з бактеріальної клітини й модифікація антибіотика [17].
У багатьох регіонах світу відмічається також збільшення питомої ваги штамів бактерій роду Haemophilus, резистентних до ампіциліну, ко-тримоксазолу, хлорамфеніколу, поява штамів, резистентних до цефалоспоринів, що погіршує лікування хворих, формує ризик виникнення ускладнень і призводить до суттєвого збільшення вартості терапії [18].
Резистентність Haemophilus influenzae до ампіциліну й амоксициліну, а також до цефалоспоринів пов’язана з продукцією плазмідних ферментів ТЕМ-1 (пеніцилінази) b-лактамаз, що становлять понад 90 % від числа всіх b-лактамазопродукуючих штамів [19]. Крім плазмідної резистентності, у близько 8 % штамів резистентність до b-лактамів обумовлена синтезом хромосомної b-лактамази ROB-1 [20]. Було встановлено, що резистентність грамнегативних бактерій, у тому числі Haemophilus influenzae, пов’язана з біосинтезом мікроорганізмами ензимів, генетично пов’язаних з b-лактамазами широкого спектра. Нові ферменти отримали назву бета-лактамаз розширеного спектра (extended-spectrum beta-lactamases — ESBL), важливими властивостями яких із практичного погляду є здатність гідролізувати цефалоспорини I–III покоління й меншою мірою — IV покоління та стійкість до гідролізу карбапенемів і цефаміцинів (цефокситин, цефотетан і цефметазол). Походження ESBL низка дослідників пов’язують із точковими мутаціями в активному центрі ферментів бета-лактамаз широкого спектра дії [21].
Слід відмітити, що частота розвитку антибіотикорезистентності Haemophilus influenzae варіює в різних регіонах. Так, за даними проведеного мультицентрового дослідження SAUCE-4, в Іспанії протягом 11-річного періоду спостерігається тенденція до зниження темпу поширеності резистентності Haemophilus influenzae до ампіциліну (від 37,6 до 16,1 %) та амоксициліну/клавуланату (від 25,7 до 15,7 %) [22]. На той час як у Франції за період 1996–2001 рр. кількість штамів Haemophilus influenzae, стійких до b-лактамних антибіотиків, збільшилася з 20 до 40 % [23]. У Кореї протягом 2005 і 2006 років нечутливість Haemophilus influenzae, виділеної від хворих на гострі респіраторні інфекції, до ампіциліну становила 58,5 %, до цефуроксиму — 23,3 %, цефаклору — 17,0 %, амоксициліну/клавуланату — 10,4 % і хлорамфеніколу — 8,1 % [24]. Високу несприйнятливість ізолятів Haemophilus influenzae щодо ампіциліну й цефаклору (55 і 45 % відповідно) встановлено в Тайвані [25]. За даними досліджень, проведених у Китаї (1997–2002 рр.), було встановлено, що ізоляти Haemophilus influenzae, які були виділені від пацієнтів з інфекціями верхніх дихальних шляхів, у середньому проявляли резистентність до ампіциліну в 37,4 % випадків. Понад 59,4 і 16,9 % штамів проявляли стійкість до триметоприму/сульфаметоксазолу й хлорамфеніколу відповідно. Не більше від 10 % штамів Haemophilus influenzae були нечутливими до ампіциліну/сульбактаму, ципрофлоксацину, цефтазидиму, амоксициліну/клавуланату або цефуроксиму. Поширеність мультирезистентних штамів становила 25,3 % [26].
Антибіотики з групи макролідів у цілому відзначаються невисоким рівнем активності щодо Haemophilus spp., що пов’язано з наявністю в даного мікроорганізму фонової активності механізмів активного виведення. Переважна більшість штамів бактерій роду Haemophilus з мікробіологічного погляду належать до дикої популяції, позбавленої додаткових детермінант резистентності до цих антибактеріальних препаратів [27].
Отже, наведений вище матеріал вказує на високий рівень резистентності Streptococcus pneumoniae та бактерій роду Haemophilus до амінопеніцилінів і макролідів і є патогенетичним обґрунтуванням того факту, що препаратами вибору для лікування гострої бактеріальної респіраторної інфекції в дітей виступають цефалоспорини ІІІ–ІV покоління. Вибір шляху введення й тактики застосування повинен ґрунтуватися передусім на ступені тяжкості захворювання. В амбулаторних умовах перевагу надають пероральним засобам. В умовах стаціонару при тяжкому перебігу захворювання терапію починають з парентеральних форм із подальшим переходом при стабілізації процесу на пероральні форми.
При виборі препарату для емпіричної терапії гострих бактеріальних респіраторних інфекцій слід враховувати його ефективність щодо найбільш частих збудників, переносимість у терапевтичних дозах; біодоступність і ступінь проникнення в тканини дихальної системи. Вищезазначеним критеріям добору відповідає антибіотик із групи цефалоспоринів III покоління для перорального застосування цефподоксиму проксетил (Цефодокс компанії «Мегаком»), що проявляє високу активність проти грампозитивних і грамнегативних збудників [28]. Цефподоксиму проксетил є проліками, які в стінці травного тракту під впливом гідролаз перетворюються на активну форму — цефподоксим. Цефподоксиму проксетил добре розподіляється в органах і тканинах. Його концентрація швидко досягає максимальних рівнів, що значно перевищують мінімальну пригнічувальну концентрацію для більшості мікроорганізмів — збудників інфекцій дихальних шляхів. Даний препарат має високу біодоступність, добре переноситься й зручний у застосуванні (добова доза Цефодоксу становить 10 мг/кг, ділиться на 2 прийоми через кожні 12 годин). Власний досвід застосування цефподоксиму проксетилу в терапії дітей, хворих на гострі бактеріальні респіраторні інфекції, викликані Streptococcus pneumoniae та Haemophilius influenzae, показав високу ефективність препарату та його безпечність [29–31].
Висновки
1. Етіологічна структура гострих бактеріальних респіраторних інфекцій у дітей протягом останніх років залишається незмінною, домінують Streptococcus pneumoniae та бактерії роду Haemophilus, однак відмічається зростання резистентності вказаних патогенів до основних груп антибактеріальних препаратів.
2. Результати проведених досліджень патогенетично обґрунтовують доцільність застосування цефалоспоринів ІІІ покоління як препарату вибору в лікуванні гострої бактеріальної респіраторної інфекції в дітей.
3. Цефподоксиму проксетил (Цефодокс) може бути застосований як препарат першої ланки в амбулаторній практиці в лікуванні гострих бактеріальних респіраторних інфекцій і як одна з ланок терапії step by step тяжкої бактеріальної інфекції.
Конфлікт інтересів. Не заявлений.
1. Walker D., Fowler T. Infections and the Rise of Antimicrobial Resistance // Annual Report of the Chief Medical Officer. — 2011. — Vol. 2.
2. World Economic Forum. Global Risks 2013. — 8th еd. — http://www.weforum.org/reports/global-risks2013-eighth-edition.
3. World Economic Forum. Global Risks 2014 Report. — 2014. — http://www.weforum.org/reports/global-risks-2014- report.
4. World Health Organization. Antimicrobial Resistance: Global Report on Surveillance 2014. — 2014. — http://www.who.int/drugresistance/documents/surveillancereport/en/.
5. Hampton T. Report reveals scope of US antibiotic resistance threat // JAMA — 2013. — 310. — 1661-1663. doi:10.1001/jama.2013.280695.
6. Cornick J.E., Bentley S.D. Streptococcus pneumoniae: the evolution of antimicrobial resistance to beta-lactams, fluoroquinolones and macrolides // Microb. Infect. — 2012. — 14. — 573-583. — https://doi.org/10.1016/j.micinf.2012.01.012.
7. Goossens H., Ferech M., Vander Stichele R., Elseviers M. ESAC Project Group. Outpatient antibiotic use in Europe and association with resistance: a cross-national database study // Lancet. — 2005. — 365. — 579-587. — https://doi.org/10.1016/S0140-6736(05)17907-0.
8. Молчанова О.В. Антибиотикотерапия тяжелой внебольничной пневмонии / О.В. Молчанова [и др.] //. Антибиотики и химиотер. — 2009. — № 54 (3–4). — C. 29-31.
9. Жанбаева А.К., Тилекеева У.М. Сравнительный анализ спектра возбудителей внебольничной пневмонии и их чувствительности и резистентности к антибактериальным препаратам в 2 соседних регионах в Кыргызской Республике // Наука, образование, общество: тенденции и перспективы развития. — 2016. — С. 30-33.
10. The European Committee on Antimicrobial Susceptibility Testing. Disk Diffusion Method for Antimicrobial Susceptibility Testing — Version 6.0. — January 2017. — http://www.eucast.org.
11. Леженко Г.О., Пашкова О.Є., Пантюшенко Л.І. Раціональна антибактеріальна терапія захворювань органів дихання в дітей // Здоровье ребенка. — 2013. — 8. — С. 33-36.
12. Hackel M., Lascols C., Bouchillon S., Hilton B., Morgenstern D., Purdy J. Serotype prevalence and antibiotic resistance in Streptococcus pneumoniae clinical isolates among global populations // Vaccine. — 2013. — 31. — 4881-4887. — https://doi.org/10.1016/j.vaccine.2013.07.054
13. Reinert R.R. The antimicrobial resistance profile of Streptococcus pneumoniae // Clin. Microbiol. Infect. — 2009. — 15 (Suppl. 3). — 7-11. — https://doi.org/10.1111/j.1469-0691.2009.02724.x.
14. Маянский Н.А., Алябьева Н.М., Лазарева А.В., Катосова Л.К. Серотиповое разнообразие и резистентность пневмококков // Вестник Российской академии медицинских наук. — 2014. — 69 (7–8). — С. 38-45.
15. Reinert RR. Resistance phenotypes and multi-drug resistance in Streptococcus pneumoniae (PROTEKT years 1–3 [1999–2001] // J. Chemother. — 2004. — 16 (Suppl. 6). — 35-48. — https://doi.org/10.1080/1120009X.2004.11782401.
16. Zapun C., Contreras-Martel T.V. Пеніцилін-зв’язуючі білки та стійкість бета-лактаму // FEMS Microbiol. Rev. — 2008. — 32. — 361-385.
17. Cherazard R., Epstein M., Doan, T.L., Salim T., Bharti S., & Smith M. A. Antimicrobial resistant Streptococcus pneumoniae: prevalence, mechanisms, and clinical implications // American journal of therapeutics. — 2017. — 24(3). — e361-e369. doi: 10.1097/MJT.0000000000000551
18. Страчунский Л.С. Современная антибактериальная химиотерапия: руководство для врачей / Л.С. Страчунский, С.Н. Козлов. — М.: Боргес, 2002. — 432 с.
19. Tristram S., Jacobs M.R., Appelbaum P.C. Antimicrobial resistance in Haemophilus influenzae // Clinical microbiology reviews. — 2007. — 20(2). — 368-389. doi: 10.1128/CMR.00040-06
20. Groot R., DzoliiccDanilovic G., Kligeren B., Goessens W., Neyens H. Antibiotic resistance in Haemophilus influenzae: mechanisms, clinical importance and consequencesfor therapy // Eur. J. Pediatr. — 1991. — 150. — 534-46.
21. Жукова Э.В. Современное состояние проблемы антибиотикорезистентности и эпидемиологический надзор за устойчивостью микроорганизмов к антибактериальным препаратам. Часть 1 // Инфекционные болезни. — 2015. — № 1. — С. 44-47.
22. Pérez-Trallero E., Martín-Herrero J.E., Mazón A., García-Delafuente C., Robles P., Iriarte V. Spanish Surveillance Group for Respiratory Pathogens. Antimicrobial resistance among respiratory pathogens in Spain: latest data and changes over 11 years (1996–1997 to 2006–2007) // Antimicrobial agents and chemotherapy. — 2010. — 54(7). — 2953-2959. doi:10.1128/AAC.01548-09
23. Частная эпидемиология: руководство для врачей / Под ред. Б.Л. Черкасского. — Т. 1. — М., 2002. — С. 16-24.
24. Bae S., Lee J., Kim E., Lee S., Yu J., Kang Y. Antimicrobial resistance in Haemophilus influenzae respiratory tract isolates in Korea: results of a nationwide acute respiratory infections surveillance // Antimicrobial agents and chemotherapy. — 2010. — 54(1). — 65-71. — doi:10.1128/AAC.00966-09.
25. Jean S.S., Hsueh P.R., Lee W.S., Chang H.T., Chou M.Y., Chen I.S. Wu J. J. Nationwide surveillance of antimicrobial resistance among Haemophilus influenzae and Streptococcus pneumoniae in intensive care units in Taiwan // European journal of clinical microbiology & infectious diseases. — 2009. — 28(8). — 1013. — http://dx.doi.org/10.1007/s10096-009-0727-3.
26. Zhang H., Li W.H., Wang C.Q., Xue J.C., Sun Z.Y., Jian C., Wei L.H. CHINET 2007 surveillance of antimicrobial resistance in Haemophilus influenzae in China // Chinese Journal of Infection and Chemotherapy. — 2009. — 3. — 016.
27. Выделение, идентификация и определение чувствительности к антибиотикам Haemophilus influenzae: Метод. рекомендации для микробиологов // Клин. микробиол. антимикроб. химиотерапия. — 2000. — Т. 2, № 2. — С. 93-109.
28. Цефодокс (цефподоксима проксетил): трехлетний анализ клинического использования в педиатрии / Волосовец А.П., Кривопустов С.П., Дзюба О.Л. [и др.] // Совр. педиатрия. — 2009. — № 4. — С. 34-38.
29. Леженко Г.О. Обґрунтування вибору тактики фармакотерапії гострих синуситів у дітей / Г.О. Леженко, О.Є. Пашкова, Л.І. Пантюшенко // Совр. педиатрия. — 2012. — № 3. — С. 95-98.
30. Леженко Г.О. Вибір раціональної антибактеріальної терапії у дітей з бактеріальними захворюваннями органів дихання в умовах зростання рівня антибіотикорезистентності / Г.О. Леженко, О.Є. Пашкова, Л.І. Пантюшенко // Здоровье ребенка. — 2014. — № 6. — С. 25-30.
31. Леженко Г.О., Пашкова О.Є. Обґрунтування раціональної антибіотикотерапії бактериальних захворювань респіраторного тракту в дітей // Здоровье ребенка. — 2016. — № 2(70). — С. 33-38.

/58-1.jpg)
/59-1.jpg)
/59-2.jpg)
/60-1.jpg)