Журнал «Здоровье ребенка» Том 13, №8, 2018
Вернуться к номеру
Особенности микробного пейзажа верхних дыхательных путей у детей с микроаспирационным синдромом на фоне поражения центральной нервной системы
Авторы: Ильченко С.И., Мишина Н.В., Фиалковская А.А., Жукова Л.А.
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Бронхолегенева патологія посідає провідне місце в структурі захворюваності дітей усіх вікових груп. Одним із факторів, що сприяють розвитку затяжного перебігу бронхітів або рецидивуючого бронхообструктивного синдрому, є мікроаспірація. Високий ризик розвитку як гострої, так і хронічної мікроаспірації мають діти з неврологічними розладами. Мета дослідження: вивчення особливостей перебігу респіраторної патології та мікробного пейзажу верхніх дихальних шляхів у дітей з мікроаспіраційним синдромом на тлі ураження центральної нервової системи (ЦНС). Матеріали та методи. Проведено комплексне обстеження 30 дітей віком від 1 міс. до 12 років (середній вік пацієнтів — 4,60 ± 0,03 року) з патологією ЦНС. Основну групу становили 18 дітей з перинатальним ураженням ЦНС, які мають в анамнезі затяжні та рецидивуючі бронхіти, групу порівняння — 12 респіраторно-асимптомних дітей з перинатальним ураженням ЦНС. Дослідження включало детальний збір анамнезу, об’єктивне обстеження дітей і лабораторно-інструментальні методи. У всіх хворих досліджували мікробний спектр верхніх дихальних шляхів, отриманий шляхом глибокого мазка з ротоглотки. Для статистичної обробки отриманих результатів використовувалася програма Statistica 13.0. Результати. Встановлено, що мікроаспіраційний синдром зустрічається переважно у дітей з тяжкою поєднаною патологією ЦНС. Респіраторна патологія у даної категорії пацієнтів характеризується рецидивуючими бронхітами (середня частота за рік — 5,9 ± 0,4), їх ранньою маніфестацією (середній вік початку бронхітів — 4,4 ± 0,5 міс.) і затяжним перебігом (середня тривалість бронхітів — 1,5 ± 0,1 міс.). Особливістю мікробного пейзажу верхніх дихальних шляхів у дітей з мікроаспіраційним синдромом на тлі ураження ЦНС є домінування кишкової умовно-патогенної мікрофлори (Klebsiella pneumoniae, Proteus vulgaris і Proteus mirabilis), а також Pseudomonas aeroginosa і дріжджоподібних грибів роду Сandida. Висновки. Отримані результати мають важливе практичне значення при виборі стартового антибактеріального препарату для лікування затяжних бактеріальних бронхітів у дітей з мікроаспіраційним синдромом на тлі ураження ЦНС.
Актуальность. Бронхолегочная патология занимает ведущее место в структуре заболеваемости детей всех возрастных групп. Одним из факторов, способствующих затяжному течению бронхитов или рецидивирующему бронхообструктивному синдрому, является микроаспирация. Высокий риск развития как острой, так и хронической микроаспирации имеют дети с неврологическими расстройствами. Цель исследования: изучение особенностей течения респираторной патологии и микробного пейзажа верхних дыхательных путей у детей с микроаспирационным синдромом на фоне поражения центральной нервной системы (ЦНС). Материалы и методы. Проведено комплексное обследование 30 детей в возрасте от 1 мес. до 12 лет (средний возраст пациентов — 4,60 ± 0,03 года) с патологией ЦНС. Основную группу составили 18 детей с перинатальным поражением ЦНС, имеющие в анамнезе затяжные и рецидивирующие бронхиты, группу сравнения — 12 респираторно-асимптомных детей с перинатальным поражением ЦНС. Исследование включало детальный сбор анамнеза, объективное обследование детей и лабораторно-инструментальные методы. У всех больных изучали микробный спектр верхних дыхательных путей, полученный путем глубокого мазка из ротоглотки. Для статистической обработки полученных результатов использовалась программа Statistica 13.0. Результаты. Установлено, что микроаспирационный синдром встречается преимущественно у детей с тяжелой сочетанной патологией ЦНС. Респираторная патология у данной категории пациентов характеризуется рецидивирующими бронхитами (средняя частота за год — 5,9 ± 0,4), их ранней манифестацией (средний возраст начала бронхитов — 4,4 ± 0,5 мес.) и затяжным течением (средняя продолжительность бронхитов — 1,5 ± 0,1 мес.). Особенностью микробного пейзажа верхних дыхательных путей у детей с микроаспирационным синдромом на фоне поражения ЦНС является доминирование кишечной условно-патогенной микрофлоры (Klebsiella pneumoniae, Proteus vulgaris и Proteus mirabilis), а также Pseudomonas aeroginosa и дрожжеподобных грибов рода Сandida. Выводы. Полученные результаты имеют важное практическое значение при выборе стартового антибактериального препарата для лечения затяжных бактериальных бронхитов у детей с микроаспирационным синдромом на фоне поражения ЦНС.
Background. Pathology of the respiratory system ranks first in the structure of the morbidity in children of all age groups. One of the factors leading to the protracted course of bronchitis or recurrent broncho-obstructive syndrome is microaspiration. Children with neurological disorders have a high risk of both acute and chronic microaspiration. The purpose is to study the characteristics of respiratory pathology and the microbial landscape of the upper respiratory tract in children with microaspiration syndrome on the background of damage to the central nervous system (CNS). Materials and methods. A comprehensive survey was conducted in 30 children aged 1 month to 12 years (the average age of patients was 4.60 ± 0.03 years) with CNS pathology. The main group consisted of 18 children with perinatal CNS damage who had prolonged and recurrent bronchitis in the past medical history, the comparison group — 12 respiratory asymptomatic children with perinatal CNS damage. The study included a detailed medical history, an objective examination of children and laboratory and instrumental methods. The microbial spectrum of the upper respiratory tract was investigated in all patients by deep smear from the oropharynx. For statistical processing of the results obtained, the program Statistica 13.0 was used. Results. It was found that microaspiration syndrome occurs mainly in children with severe combined pathology of CNS. Respiratory pathology in these patients is characterized by recurrent bronchitis (the average frequency per year is 5.9 ± 0.4), its early manifestation (the average age of bronchitis onset is 4.4 ± 0.5 months) and a protracted course (average duration of bronchitis is 1.5 ± 0.1 months). The peculiarity of the microbial landscape of the upper respiratory tract in children with microaspiration syndrome against the background of central nervous system damage is the dominance of intestinal opportunistic microflora (Klebsiella pneumoniae, Proteus vulgaris, Proteus mirabilis) and also Pseudomonas aeruginosa and Candida. Conclusions. The obtained results are of practical importance for the selection of the starting antibacterial drug for the treatment of prolonged bacterial bronchitis in children with microaspiration syndrome on the background of CNS damage.
мікроаспіраційний синдром; мікробний пейзаж верхніх дихальних шляхів; ураження центральної нервової системи; бронхіти; діти
микроаспирационный синдром; микробный пейзаж верхних дыхательных путей; поражение центральной нервной системы; бронхиты; дети
microaspiration syndrome; microbial landscape of the upper respiratory tract; damage to the central nervous system; bronchitis; children
Введение
Бронхолегочная патология занимает ведущее место в структуре заболеваемости детей всех возрастных групп. Одним из факторов, способствующих затяжному течению бронхитов, а также рецидивирующему бронхообструктивному синдрому, является микроаспирация [1, 2]. Высокий риск развития как острой, так и хронической микроаспирации имеют дети с неврологическими расстройствами. У детей с перинатальной патологией центральной нервной системы (ЦНС) микроаспирационный синдром обусловлен функциональным или органическим поражением рефлекторной дуги, ответственной за защитные реакции верхних и нижних дыхательных путей, угнетением глоточного и кашлевого рефлексов, а также дисфагией [2, 3].
Аспирация может происходить слюной, слизью и едой, а также желудочным содержимым, что ведет к химическому повреждению слизистой оболочки бронхов, развитию бронхита, который нередко сопровождается бронхообструктивным синдромом [4]. Кроме того, аспирация является одним из факторов, способствующих проникновению бактериальной флоры (нередко кишечной) в нижние дыхательные пути, характер которой влияет на особенности течения бронхолегочной патологии, приводя к развитию затяжного бактериального или рецидивирующего бронхита, пневмонии [5, 6]. При отсутствии явной клинической картины, например дисфагии или проявления респираторных симптомов во время кормления, диагностика микроаспирации является достаточно сложной и требует тщательного сбора анамнеза, клинического анализа. В некоторых случаях для ее подтверждения могут потребоваться дополнительные, в том числе инструментальные, методы визуализации, что даже в условиях стационара может ограничиваться тяжестью состояния пациента и недоступностью медицинского оборудования.
Длительное время патофизиологи доказывали в своих научных исследованиях, что слизистая оболочка гортани, трахеи, бронхов и всех нижележащих отделов у здоровых детей сохраняется стерильной благодаря активности их эпителия, макрофагов, а также продукции секреторного иммуноглобулина А. Несовершенство этих защитных механизмов, нарушение их функционирования в результате иммунодефицитных состояний или при ингаляционном наркозе приводит к проникновению микроорганизмов вглубь бронхиального дерева и, соответственно, может быть одной из причин тяжелых респираторных заболеваний. Однако в течение последнего десятилетия благодаря применению современных лабораторных методов было установлено, что нижние дыхательные пути содержат разнообразные сообщества микробов, которые и представляют микробиом легких [7–9]. E.S. Charlson и соавторы (2016) в своем исследовании установили, что бактериальная микробиота легких здоровых людей идентична микробиоте верхних дыхательных путей, но ее биомасса прямо пропорционально уменьшается от верхнего отдела респираторного тракта к нижнему [10].
Согласно литературным данным, микроорганизмы дыхательных путей условно можно разделить на несколько групп. К первой относятся представители нормальной флоры дыхательных путей (Streptococcus viridans, Corynebaccterium spp., Neisseria spp. (кроме возбудителей дифтерии и менингита), Staphylococcus spp.). Вторая группа — это патогенные микроорганизмы, которые обычно вызывают инфекционный процесс в дыхательных путях (Streptococcus pneumoniae, Hemophilus influenzae, Staphуlococcus aureus, Klebsiella pneumonia, Candida albicans, Branhamella catarrhalis, Chlamydia spp., Pseudonomas aeruginosa, Legionella pneumophila, Mycoplasma pneumoniae) [11]. Было установлено, что у детей с рецидивирующим бронхитом без неврологических нарушений микробный пейзаж дыхательных путей характеризуется доминированием грамотрицательной микрофлоры, прежде всего бактерий рода Haemophillus [11]. У детей же, например, с детским церебральным параличом была выявлена взаимосвязь аспирационной пневмонии с колонизацией дыхательных путей Pseudomonas aeruginosa [12].
В связи с тем, что микроаспирация способствует проникновению бактериальной флоры из верхних отделов респираторного тракта в нижние, актуальным является изучение ее особенностей и влияние на течение бронхолегочной патологии у детей с неврологическими нарушениями. Лечение затяжных бронхолегочных заболеваний у неврологических пациентов была и остается сложной клинической задачей в педиатрии. Эти дети относятся к группе риска по развитию хронических бронхитов, бронхоэктазий, деструктивных пневмоний, пневмофиброза. Практически важным является правильный выбор антибактериальной терапии с целью профилактики у них тяжелых бактериальных осложнений.
Цель исследования: изучение особенностей течения респираторной патологии и микробного пейзажа верхних дыхательных путей у детей с микроаспирационным синдромом на фоне поражения ЦНС.
Материалы и методы
Для достижения поставленной цели было проведено комплексное обследование 30 детей в возрасте от 1 мес. до 12 лет (средний возраст пациентов — 4,60 ± 0,03 года) с патологией ЦНС. Основную группу составили 18 детей с перинатальным поражением ЦНС, имеющие в анамнезе затяжные и рецидивирующие бронхиты, группу сравнения — 12 респираторно-асимптомных детей с перинатальным поражением ЦНС.
Исследование включало детальный сбор анамнеза и объективное обследование детей. Для диагностики микроаспирации использовали клинико-анамнестические критерии (в том числе модифицированный опросник по Царегородцеву С.В., 1992) и лабораторно-инструментальные методы (в том числе фиброэзофагогастроскопию). У всех больных исследовали микробный спектр верхних дыхательных путей, полученный путем глубокого мазка из ротоглотки. Сбор биоматериала осуществляли утром натощак, после туалета ротовой полости, в одноразовый стерильный герметичный контейнер. Клинические образцы доставляли в лабораторию в течение часа после забора материала и засевали на готовые питательные среды, изготовленные в заводских условиях.
Для статистической обработки полученных результатов использовалась программа Statistica 13.0 (серийный номер — AGAR909E415822FA). Оценивались количественные и качественные показатели. При нормальном распределении значений параметров определяли среднеарифметическое значение (М) и его стандартную ошибку (m). Результаты считали статистически значимыми при значениях р < 0,05.
Результаты и обсуждение
Установлено, что у детей основной группы превалировала тяжелая сочетанная патология центральной нервной системы (94,4 %). В группе сравнения у 41,7 % детей встречались легкие формы детского церебрального паралича, у 33,3 % — перинатальное поражение ЦНС, у 16,7 % — перинатальное гипоксическое поражение ЦНС, у 8,3 % — перинатальное гипоксически-травматическое поражение ЦНС.
При сравнении анамнестических данных было установлено, что у детей основной группы достоверно чаще встречались угроза прерывания беременности (100 против 50 %; c2 = 11,3, р < 0,001) и родовые травмы (72,7 против 25,0 %; c2 = 5,6, р < 0,05). В состоянии легкой асфиксии родилось 11,1 % детей основной группы и 83,3 % детей группы сравнения (р < 0,05), в состоянии асфиксии средней степени тяжести — 77,8 и 8,3 % соответственно, в состоянии тяжелой асфиксии — 6,7 % детей основной группы. Оценка по шкале Апгар на первой минуте составила 3,9 ± 0,3 у детей основной группы и 6,5 ± 0,2 в группе сравнения, на пятой минуте — 5,8 ± 0,3 и 8,3 ± 0,2 соответственно (р < 0,05). Достоверно отличалась у детей основной группы и средняя масса при рождении, которая составила 2913,9 ± 58,8 против 3289,2 ± 73,5 г (р < 0,001).
При объективном осмотре дисфагия наблюдалась у всех детей основной группы. У 44,4 % детей основной группы и 16,7 % детей группы сравнения отмечались срыгивания во время кормления (c2 = 2,5, р > 0,05), у 83,3 % детей обеих групп имел место заброс пищи в носовую полость во время кормления (рис. 1). Изменения аускультативных данных над легкими при кормлении в зависимости от приема густой и жидкой пищи чаще наблюдались в основной группе (83,3 против 26,7 %, р < 0,001). Приступы кашля во время кормления и затяжной его характер отмечались у всех без исключения детей основной группы и отсутствовали в группе сравнения. Одышка во время или после кормления достоверно чаще отмечалась у детей основной группы (94,4 против 8,3 %, р < 0,001).
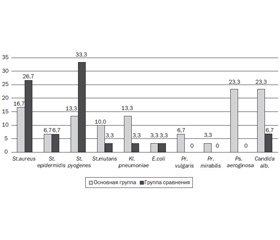
Результаты бактериологического исследования материала со слизистой верхних дыхательных путей показали, что выделенные как в основной группе, так и в группе сравнения микроорганизмы характеризовались достаточным разнообразием (рис. 2).
У пациентов основной группы преобладала колонизация верхних дыхательных путей преимущественно грамотрицательными микроорганизмами (49,9 %), среди которых наиболее часто встречалась Pseudomonas aeroginosa (в 23,3 % случаев). Кроме того, у больных основной группы в 4 раза чаще встречались представители кишечной условно-патогенной микрофлоры: Klebsiella pneumoniae (13,3 % случаев), Proteus vulgaris и Proteus spp. (10 % случаев). В редких случаях высевалась Escherichia coli (3,3 % случаев). У 23,3 % пациентов были выделены дрожжеподобные грибы рода Candida, что может быть связано с более часто назначаемой и продолжительной антибактериальной терапией (средняя продолжительность за год — 4,6 ± 0,5 месяца) у данной категории пациентов. У детей без микроаспирации в микробном пейзаже дыхательных путей преобладала в основном грамположительная флора: в 33,4 % случаев высевались штаммы стафилококков (Staphylococcus aureus и Staphylococcus epidermidis) и в 36,6 % — стрептококков (Streptococcus pyogenes и Streptococcus mutans).
Монокультура была выделена у 33,3 % обследованных детей основной группы и 16,7 % детей группы сравнения (c2 = 1,02, р > 0,05). Ассоциация двух микроорганизмов встречалась у 38,9 % больных основной группы и 58,3 % детей группы сравнения. При этом в группе сравнения достоверно преобладала ассоциация Staphylococcus aureus и Streptococcus pyogenes (41,7 против 5,6 %, р < 0,05). Три возбудителя и более было выделено у 27,8 % детей основной группы и 25 % детей из группы сравнения (р > 0,05).
Респираторная патология у детей с микроаспирационным синдромом характеризовалась рецидивирующими бронхитами, средняя частота которых за год составила 5,9 ± 0,4, их ранней манифестацией (средний возраст начала бронхитов — 4,4 ± 0,5 мес.) и затяжным течением (средняя продолжительность бронхитов — 1,5 ± 0,1 мес.). По данным анамнеза, у 5 пациентов из первой группы рентгенологически диагностированы бронхоэктазии, у 4 — бронхиты осложнялись тяжелыми полисегментарными пневмониями. При статистическом анализе клинико-анамнестических и лабораторных данных наиболее сильная взаимосвязь выявлена между частотой рецидивирования бронхитов, длительностью бронхиального воспаления при обострении в группе пациентов с идентифицированной ассоциацией грамположительных микроорганизмов с Proteus vulgaris и Klebsiella pneumoniae (r = +0,61, p < 0,05). Колонизация Pseudomonas aeroginosa у детей была связана с частотой заболеваемости бронхитами (r = +0,59, p < 0,05) и длительностью госпитализаций (r = +0,51, p < 0,05).
Выводы
Микроаспирационный синдром встречается достаточно часто у детей с тяжелой сочетанной патологией центральной нервной системы и сопровождается развитием рецидивирующих бактериальных бронхитов в раннем возрасте. По результатам нашего исследования, особенностью микробного пейзажа дыхательных путей у детей с микроаспирационным синдромом на фоне поражения центральной нервной системы является доминирование кишечной условно-патогенной микрофлоры (Klebsiella pneumoniae, Proteus vulgaris и Proteus mirabilis), а также Pseudomonas aeroginosa и дрожжеподобных грибов рода Сandida. Определены взаимосвязи между клиническими особенностями течения бронхиального воспаления и идентификацией различных микробных ассоциаций. Эти данные требуют дальнейшего изучения и могут иметь практическое значение при эмпирическом выборе антибактериальной терапии для лечения затяжных бактериальных бронхитов у данной категории пациентов.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Ильченко С.И. Микроаспирационный синдром в практике педиатра: современные особенности и роль в формировании бронхообструктивного синдрома / С.И. Ильченко, Е.Д. Дука, Л.А. Жукова // Здоровье ребенка. — 2016. — № 7(75). — С. 90-94. doi: 10.22141/2224-0551.7.75.2016.86731.
2. Satter E.M. The feeding relationship: problems and interventions / E.M. Satter // J. of Pediatric. — 2009. — V. 117. — Р. 181-189.
3. Proesmans M. Respiratory illness in children with disability: a serious problem? / M. Proesmans // Breathe (Sheff.). — 2016. — V. 12(4). — P. 97-103. doi: [10.1183/20734735.017416].
4. Arvedson J.C. Pediatric Swallowing and Feeding / J.C. Arvedson, L. Brodsky. — Delmar Cengage Learning, 2015. — 528 р.
5. Коренюк Е.С. Нарушения микробиоты дыхательных путей у детей с респираторными заболеваниями (обзор литературы) / Е.С. Коренюк // Здоровье ребенка. — 2018. — Т. 13, № 5. — С. 506-515. doi: http://dx.doi.org/10.22141/2224-0551.13.5.2018.141569.
6. ERS statement on protracted bacterial bronchitis in children / A. Kantar, A.B. Chang, M.D. Shields, J.M. Marchant, K. Grimwood [et al.] // European Respiratory Journal. — 2017. — V. 50. doi: 10.1183/13993003.02139-2016.
7. Медицинская микробиология, вирусология и иммунология. Том 1: учебник / Под ред. В.В. Зверева, М.Н. Бойченко. — М.: ГЭОТАР-Медиа, 2010. — Т. 1. — 443 с.
8. Колонизационная резистентность и иммунологическая реактивность слизистых ротоглотки у детей в норме и при бронхолегочных заболеваниях / В.А. Метельская, В.А. Алешкин, Е.А. Воропаева [и др.] // Вестник РАМН. — 2010. — № 7. — С. 10-15.
9. Disordered microbial communities in asthmatic airways / М. Hilty, С. Burke, Н. Pedro [et al.] // PloS one. — 2010. — 5. — Р. e8578 [PubMed].
10. Topographical continuity of bacterial populations in the healthy human respiratory tract / E.S. Charlson, К. Bittinger, A.R. Haas [et al.] // Am. J. Respir. Crit. Care Med. — 2011. — 184. — Р. 957-963.
11. Леженко Г.О. Мікробіологічна характеристика дихальних шляхів у дітей, хворих на рецидивуючий бронхіт / Г.О. Леженко, О.Є. Пашкова, Л.І. Пантюшенко // Современная педиатрия. — 2013. — № 3(51). — С. 61-65.
12. Association Between Chronic Aspiration and Chronic Airway Infection with Pseudomonas aeruginosa and Other Gram-Negative Bacteria in Children with Cerebral Palsy / C.A. Gerdung, A. Tsang, A.S. Yasseen, K. Armstrong, H.J. McMillan [et al.] // Lung. — 2016. — V. 194, I. 2. — P. 307-314. doi: 10.1007/s00408-016-9856-5.

/65-1.jpg)
/66-1.jpg)