Международный эндокринологический журнал Том 14, №8, 2018
Вернуться к номеру
Вміст греліну та лептину в плазмі крові в дітей та підлітків із дисфункцією гіпоталамуса
Авторы: Большова О.В., Маліновська Т.М.
ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
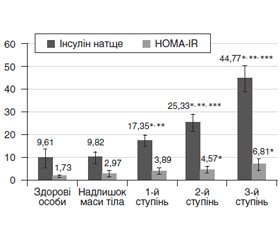
Мета дослідження — проведення порівняльного аналізу рівнів лептину та греліну в плазмі крові дітей і підлітків залежно від форми та ступеня ожиріння на тлі дисфункції гіпоталамуса. Матеріали та методи. Обстежено 39 дітей віком від 10 до 18 років із дисфункцією гіпоталамуса. Серед них 16 пацієнтів (41,03 %) — із вісцероабдомінальним ожирінням, 23 пацієнти (58,97 %) — із глютеофеморальним ожирінням та 14 здорових дітей відповідного віку та статі. У всіх пацієнтів проводили вивчення анамнезу життя, оцінку антропометричних параметрів (маса тіла, індекс маси тіла, окружність талії та стегон, їх співвідношення). Рівень лептину у крові визначали імуноферментним методом із використанням наборів фірми Roche Diagnostics GmbH Mannheim (Німеччина). Рівень греліну визначали радіоімунологічним методом із використанням наборів фірми DLAsource ImmunoAssays S.A. (Бельгія). Результати. Надлишкова маса тіла встановлена у 15 із 39 пацієнтів (38,5 %), ожиріння I ступеня — у 8 дітей (20,5 %), II ступеня — у 10 дітей (25,6 %), III ступеня — у 6 дітей (15,4 %). Середній рівень лептину в дітей із вісцероабдомінальним ожирінням становив 47,20 ± 5,54 нг/мл (індекс маси тіла — 35,20 ± 5,07 кг/м2) і виявився вірогідно вищим, ніж у дітей у групі з глютеофеморальним ожирінням (26,50 ± 7,13 нг/мл, p < 0,05) у поєднанні з аналогічними метаболічними порушеннями. Рівень греліну в дітей з ожирінням був вірогідно нижчим, ніж у контрольній групі, і залежав від ступеня ожиріння. При ожирінні III ступеня рівень греліну був найнижчим — 582,58 ± 59,37 нг/мл. Висновки. Ожиріння на тлі дисфункції гіпоталамуса в дітей та підлітків супроводжується низьким рівнем греліну та високим рівнем лептину в плазмі крові. Незалежно від статі в дітей і підлітків гіперлептинемія та гіпогрелінемія значною мірою пов’язані зі ступенем та формою ожиріння. При вісцероабдомінальній формі ожиріння (порівняно з глютеофеморальною формою) зафіксовано істотно нижчий рівень греліну та вищий рівень лептину.
Цель исследования — проведение сравнительного анализа уровней лептина и грелина в плазме крови детей и подростков с различными формами ожирения на фоне дисфункции гипоталамуса. Материалы и методы. Обследованы 39 детей в возрасте от 10 до 18 лет с дисфункцией гипоталамуса. Среди них 16 пациентов (41,03 %) — с висцероабдоминальной формой ожирения, 23 пациента (58,97 %) — с глютеофеморальным ожирением и 14 здоровых детей соответствующего возраста и пола. У всех пациентов проводили изучение анамнеза жизни, оценку антропометрических параметров (масса тела, индекс массы тела, окружность талии и бедер, их соотношение). Уровень лептина в крови определяли иммуноферментным методом с использованием наборов фирмы Roche Diagnostics GmbH Mannheim (Германия). Уровень грелина определяли радиоиммунологическим методом с использованием наборов фирмы DLAsource ImmunoAssays S.A. (Бельгия). Результаты. Избыточная масса тела выявлена у 15 из 39 пациентов (38,5 %), ожирение I степени — у 8 детей (20,5 %), II степени — у 10 детей (25,6 %), III степени — у 6 детей (15,4 %). Средний уровень лептина у детей с висцероабдоминальным ожирением составлял 47,20 ± 5,54 нг/мл (индекс массы тела — 35,20 ± 5,07 кг/м2) и оказался достоверно выше, чем у детей в группе с глютеофеморальным ожирением (26,50 ± 7,13 нг/мл, p < 0,05) в сочетании с аналогичными метаболическими нарушениями. Уровень грелина у детей с ожирением был достоверно ниже, чем в контрольной группе, и зависел от степени ожирения. При ожирении III степени уровень грелина был самым низким — 582,58 ± 59,37 нг/мл. Выводы. Ожирение на фоне дисфункции гипоталамуса у детей и подростков сопровождается низким уровнем грелина и высоким уровнем лептина в плазме крови. Независимо от пола у детей и подростков гиперлептинемия и гипогрелинемия в значительной мере связаны со степенью и формой ожирения. При висцероабдоминальной форме ожирения (по сравнению с глютеофеморальной формой) зафиксирован статистически низкий уровень грелина и высокий уровень лептина.
Background. The purpose of the study was to carry out a comparative analysis the levels of leptin and ghrelin in the blood plasma of children and adolescents with hypothalamic dysfunction and various forms of obesity. Materials and methods. Thirty nine children aged 10 to 18 years with hypothalamic dysfunction were examined: 16 patients (41.03 %) with visceroabdominal obesity, 23 patients (58.97 %) with gluteofemoral obesity, and 14 healthy children of the same age and gender. History of life, anthropometric parameters (body mass index, waist and hip circumference were evaluated in all patients. The level of leptin in the blood was determined by the enzyme immunoassay using the kit of Roche Diagnostics GmbH (Mannheim, Germany). The ghrelin level was determined by the radioimmunological method using the DIAsource ImmunoAssays SA kit (Belgium). Results. Overweight was found in 15 of 39 patients (38.5 %), obesity degree I — in 8 (20.5 %), degree II — in 10 (25.6 %), degree III — in 6 (15.4 %) children. The average leptin level in children with visceroabdominal obesity was 47.20 ± 5.54 ng/ml (body mass index 35.20 ± 5.07 kg/m2) and was significantly higher than in children with gluteofemoral obesity (26.50 ± 7.13 ng/ml, p < 0.05) associated with similar metabolic disorders. The level of ghrelin in obese children was significantly lower than in the control group, and depended on the degree of obesity. With obesity degreee III, the level of ghrelin was lowest — 582.58 ± 59.37 ng/ml. Conclusions. Obesity associated with hypothalamic dysfunction in children and adolescents is accompanied by a low level of ghrelin and a high level of leptin in the blood plasma. Regardless of sex, hyperleptinemia and hypoghrelinemia in children and adolescents are largely associated with the degree and form of obesity. In visceroabdominal obesity (as compared to the gluteofemoral form), a statistically low level of ghrelin and a high level of leptin were recorded.
діти; підлітки; дисфункція гіпоталамуса; ожиріння; лептин; грелін
дети; подростки; дисфункция гипоталамуса; ожирение; лептин; грелин
children; adolescents; hypothalamic dysfunction; obesity; leptin; ghrelin
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Bol’shova OV. Obesity in childhood and adolescence. Zdorov’ja Ukrai’ny. Pediatrija. 2008;(18-1):50-53. (in Ukrainian).
- Zelins’ka NB, Rudenko NG, Rudenko OV, authors; Zabolot’ko VM, editor. Statystychno-analitychnyj dovidnyk dytjachogo endokrynologa za 2016 rik [Statistical and analytical reference book of the children’s endocrinologist for 2016]. Kyiv; 2017. 102 p. (in Ukrainian).
- Malinovs’ka TM. Clinical and hormonal changes in children and adolescents with hypothalamic syndrome of puberty period (review of literature and own data). Pediatrija, akusherstvo ta ginekologija. 2008;(429):25-30. (in Ukrainian).
- Druce M, Bloom SR. The regulation of appetite. Arch Dis Child. 2006 Feb;91(2):183-7. doi: 10.1136/adc.2005.073759.
- Klok MD, Jakobsdottir S, Drent ML. The role of leptin and ghrelin in the regulation of food intake and body weight in humans: a review. Obes Rev. 2007 Jan;8(1):21-34. doi: 10.1111/j.1467-789X.2006.00270.x.
- Galic S, Oakhill JS, Steinberg GR. Adipose tissue as an endocrine organ. Mol Cell Endocrinol. 2010 Mar 25;316(2):129-39. doi: 10.1016/j.mce.2009.08.018.
- Huang L, Li C. Leptin: a multifunctional hormone. Cell Res. 2000 Jun;10(2):81-92. doi: 10.1038/sj.cr.7290038.
- Dietz WH, Robinson TN. Use of the body mass index as a measure of overweight in children and adolescents. J Pediatr. 1998 Feb;132(2):191-3.
- Considine RV, Sinha MK, Heiman ML, et al. Serum immunoreactive-leptin concentrations in normal-weight and obese humans. N Engl J Med. 1996 Feb 1;334(5):292-5. doi: 10.1056/NEJM199602013340503.
- Huang KC, Lin RC, Kormas N, et al. Plasma leptin is associated with insulin resistance independent of age, body mass index, fat mass, lipids, and pubertal development in nondiabetic adolescents. Int J Obes Relat Metab Disord. 2004 Apr;28(4):470-5. doi: 10.1038/sj.ijo.0802531.
- Ahima RS, Saper CB, Flier JS, Elmquist JK. Leptin regulation of neuroendocrine systems. Front Neuroendocrinol. 2000 Jul;21(3):263-307. doi: 10.1006/frne.2000.0197.
- Tershakovec AM, Kuppler KM, Zemel BS, et al. Body composition and metabolic factors in obese children and adolescents. Int J Obes Relat Metab Disord. 2003 Jan;27(1):19-24. doi: 10.1038/sj.ijo.0802185.
- Myers MG Jr, Leibel RL, Seeley RJ, Schwartz MW. Obesity and leptin resistance: distinguishing cause from effect. Trends Endocrinol Metab. 2010;21(11):643-51. doi: 10.1016/j.tem.2010.08.002.
- Kempf AM, Strother ML, Li C, Kaur H, Huang TT. Leptin as a marker of body fat and hyperinsulinemia in college students. J Am Coll Health. 2006 Nov-Dec;55(3):175-80. doi: 10.3200/JACH.55.3.175-180.
- Dimaraki EV, Jaffe CA. Role of endogenous ghrelin in growth hormone secretion, appetite regulation and metabolism. Rev Endocr Metab Disord. 2006 Dec;7(4):237-49. doi: 10.1007/s11154-006-9022-0.
- Malinovs’ka TM. Grelin: structure, functions and its role in an organism (review of literature). Endokrynologia. 2009;14(1):146-151. (in Ukrainian).
- Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999 Dec 9;402(6762):656-60. doi: 10.1038/45230.
- Sato T, Nakamura Y, Shiimura Y, Ohgusu H, Kangawa K, Kojima M. Structure, regulation and function of ghrelin. J Biochem. 2012 Feb;151(2):119-28. doi: 10.1093/jb/mvr134.
- Kirchner H, Heppner KM, Tschöp MH. The role of ghrelin in the control of energy balance. Handb Exp Pharmacol. 2012;(209):161-84. doi: 10.1007/978-3-642-24716-3_7.
- Varela L, Vázquez MJ, Cordido F, et al. Ghrelin and lipid metabolism: key partners in energy balance. J Mol Endocrinol. 2011;46(2):R43-63. doi: 10.1677/JME-10-0068.
- Barazzoni R, Zanetti M, Ferreira C, et al. Relationships between desacylated and acylated ghrelin and insulin sensitivity in the metabolic syndrome. J Clin Endocrinol Metab. 2007 Oct;92(10):3935-40. doi: 10.1210/jc.2006-2527.
- Purnell JQ, Weigle DS, Breen P, Cummings DE. Ghrelin levels correlate with insulin levels, insulin resistance, and high-density lipoprotein cholesterol, but not with gender, menopausal status, or cortisol levels in humans. J Clin Endocrinol Metab. 2003 Dec;88(12):5747-52. doi: 10.1210/jc.2003-030513.
- Bol’shova OV, Malinovs’ka TM. Serum Ghrelin level in adolescents with hypothalamic dysfunction associated with obesity. In: International Conference on Childhood Obesity. 2017 July 5-8; Lisbon, Portugal. Lisbon; 2017. 89 p.

/720-1.jpg)
/721-1.jpg)
/722-1.jpg)
/722-2.jpg)