Международный эндокринологический журнал Том 15, №1, 2019
Вернуться к номеру
Рівень прозапальних лімфокінів і гормонів у чоловіків, хворих на цукровий діабет 2-го типу
Авторы: Лучицький В.Є.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Відомо, що розвиток інсулінорезистентності (ІР), основного чинника метаболічного синдрому (МС), супроводжується дисбалансом у системі цитокінів: підвищенням рівня інтерлейкіну-6 (ІЛ-6), фактора некрозу пухлини α (ФНП-α) та зниженням ІЛ-10, ІЛ-4. Однією з причин інсулінорезистентності у чоловіків може бути зменшення продукції тестостерону, оскільки його достатня кількість посилює чутливість до інсуліну. Мета дослідження: визначити рівні прозапальних лімфокінів і гормонів у хворих на цукровий діабет (ЦД) 2-го типу з МС та андрогенним дефіцитом. Матеріали та методи. Обстежені 76 чоловіків віком від 35 до 68 років (29 — з МС та 47 — хворих на ЦД 2-го типу). Рівні прозапальних лімфокінів, естрадіолу, тестостерону вільного та загального визначали у сироватці крові радіоімунним методом, рівні ФНП-α, ІЛ-6, лептину — імуноферментними методами. ІР визначали за індексом НОМА. Діагноз МС встановлювали на підставі критеріїв АТР III — NCEP. У контрольну групу (n = 21) ввійшли умовно здорові люди. Результати. У хворих на ЦД 2-го типу з МС та у групі з МС без ЦД були підвищені рівні ФНП-α й ІЛ-6, кортизолу, альдостерону, адренокортикотропного гормону (АКТГ) та інсуліну. Проведені дослідження показали наявність андрогенного дефіциту в усіх групах пацієнтів. Більш виражені ознаки андрогенного дефіциту спостерігали в обстежених чоловіків із МС та ЦД 2-го типу. Рівень інсуліну й АКТГ прямо пропорційно залежить від індексу маси тіла. У пацієнтів із МС без ЦД спостерігалася лише тенденція до підвищення рівня лептину. Встановлена тенденція підвищення рівня естрадіолу у чоловіків з ЦД 2-го типу та МС. Висновки. Отримані результати відповідають гіпотезі щодо визначальної ролі прозапальних цитокінів імунної системи у генезі ЦД 2-го типу. У даному випадку причиною розвитку ЦД є дисфункція не жирової тканини, а неспецифічної ланки імунітету.
Актуальность. Известно, что развитие инсулинорезистентности (ИР), основного фактора метаболического синдрома (МС), сопровождается дисбалансом в системе цитокинов: повышением уровня интерлейкина-6 (ИЛ-6), фактора некроза опухоли α (ФНО-α) и снижением ИЛ-10, -4. Одной из причин инсулинорезистентности у мужчин может быть снижение продукции тестостерона, поскольку его достаточное количество усиливает чувствительность к инсулину. Цель исследования: определить уровни провоспалительных лимфокинов и гормонов у больных сахарным диабетом (СД) 2-го типа с МС и андрогенным дефицитом. Материалы и методы. Обследовано 76 мужчин в возрасте от 35 до 68 лет (29 — с МС и 47 — больных СД 2-го типа). Уровни провоспалительных лимфокинов, эстрадиола, тестостерона свободного и общего определяли в сыворотке крови радиоиммунным методом, уровни ФНО-α, ИЛ-6, лептина — иммуноферментными методами. ИР определяли по индексу НОМА. Диагноз МС устанавливали на основании критериев АТР III — NCEP. Контрольную группу (n = 21) составили условно здоровые люди. Результаты. У больных СД 2-го типа с МС и в группе с МС без СД были повышены уровни ФНО-α и ИЛ-6, кортизола, альдостерона, адренокортикотропного гормона (АКТГ) и инсулина. Проведенные исследования показали наличие андрогенного дефицита во всех группах пациентов. Более выраженные признаки андрогенного дефицита наблюдали у обследованных мужчин с МС и СД 2-го типа. Уровень инсулина и АКТГ прямо пропорционально зависит от индекса массы тела. У пациентов с МС без СД наблюдалась тенденция к повышению уровня лептина. Установлена тенденция повышения уровня эстрадиола у мужчин с СД 2-го типа и МС. Выводы. Полученные результаты соответствуют гипотезе про определяющую роль провоспалительных цитокинов иммунной системы в генезе СД 2-го типа. В данном случае причиной развития СД является дисфункция не жировой ткани, а неспецифического звена иммунитета.
Background. It is well known that the development of insulin resistance as the main factor of metabolic syndrome (MS) is accompanied by an imbalance in the cytokine system: an increase in the level of interleukin-6 (ІЛ-6), tumor necrosis factor-α (TNF-α) and a decrease in ІЛ-10, ІЛ-4. One of the causes of insulin resistance in men may be a decrease in testosterone production, since its sufficient amount increases the sensitivity to insulin. The purpose of the study: to evaluate the level of proinflammatory lymphokines and hormones in patients with type 2 diabetes mellitus (DM), MS and androgen deficiency. Materials and methods. We examined 76 men aged 35 to 68 years (29 — with MS and 47 — with type 2 DM). The level of proinflammatory lymphokines, estradiol, free and total testosterone was determined in the blood serum using radioimmune method, the content of TNF-α, ІЛ-6, leptin — by immune-enzyme methods. Insulin resistance was determined by the HOMA index. Diagnosis of MS was established based on the АТР III — NCEP criteria. The control group included 21 apparently healthy men. Results. Patients with type 2 DM and metabolic syndrome and those without MS had elevated levels of TNF-α and ІЛ-6, cortisol, aldosterone, adrenocorticotropic hormone (ACTH) and insulin. The conducted studies showed the presence of androgen deficiency in all groups of patients. More significant signs of androgen deficiency were observed in the examined men with MS and type 2 DM. The level of insulin and adrenocorticotropic hormone are directly proportional to the body mass index. In patients with MS and without MS, we observed only a tendency to increase in leptin level. There is a tendency to increase in the level of estradiol in men with type 2 DM and MS. Conclusions. Results of the study correspond to the hypothesis about the leading role of proinflammatory lymphokines of the immune system in the origin of type 2 DM. In this case, the cause of DM is dysfunction of not fatty tissue, bur heterospecific link of immunity.
цукровий діабет; метаболічний синдром; лімфокіни; гормони; андрогенний дефіцит
сахарный диабет; метаболический синдром; лимфокины; гормоны; андрогенный дефицит
diabetes mellitus; metabolic syndrome; lymphokines; hormones; androgen deficiency
Вступ
Останніми роками значна увага приділяється ролі цитокінів у патогенезі цукрового діабету (ЦД) 2-го типу та метаболічного синдрому (МС). Відомо, що розвиток інсулінорезистентності (ІР), основного чинника МС, супроводжується дисбалансом у системі цитокінів: підвищенням рівня інтерлейкіну-6 (ІЛ-6), фактора некрозу пухлини α (ФНП-α) та зниженням ІЛ-10, ІЛ-4.
ФНП-α може опосередковано пригнічувати стимульоване інсуліном тирозинове фосфорилювання інсулінового рецептора, тим самим інгібувати процес сигнальної трансдукції. Епідеміологічні дослідження свідчать про поширення цукрового ЦД 2-го типу у людей з метаболічним синдромом [1–3].
Серед літературних джерел є праці, у яких науковці поєднують можливі зв’язки між інсуліном і різними гормонами (глюкокортикоїдами, гормоном росту, катехоламінами, статевими гормонами), частково опосередковані через вісцеральне ожиріння й адипоцитокіни.
Однією з причин інсулінорезистентності у чоловіків може бути зменшення продукції тестостерону, оскільки його достатня кількість посилює чутливість до інсуліну. Підвищена реакція ароматизації тестостерону призводить до зростання рівнів естрадіолу, що є причиною редукції пульсів лютеїнізуючого гормону (ЛГ), та збільшення відкладення жирової тканини. МС був діагностований у 44,2 % чоловіків з низьким рівнем тестостерону в крові і лише у 8–9 % — з його високим рівнем.
Ризик розвитку МС та ЦД у чоловіків з гіпогонадизмом (ГГ) підвищується у 2,3 раза. Вважають, що ГГ може бути предиктором розвитку МС і ЦД 2-го типу [4–7].
Метою цього дослідження було визначити рівень прозапальних лімфокінів і гормонів у хворих на ЦД 2-го типу з МС та андрогенним дефіцитом.
Матеріали та методи
Рівні прозапальних лімфокінів, естрадіолу, тестостерону вільного та загального визначали у сироватці крові радіоімунним методом, використовуючи набори фірми Immunotech у хворих на МС, ЦД 2-го типу без МС та хворих на ЦД 2-го типу з МС.
Крім вказаних вище гормонів, також визначали рівні кортизолу, альдостерону, інсуліну, адренокортикотропного гормону (АКТГ). Обстежені не мали тяжких ангіопатій, перенесених раніше вірусних гепатитів та алкоголізму.
У контрольну групу ввійшли умовно здорові люди (n= 21).
Рівень ФНП-α визначали за допомогою набору DIA Source (Бельгія), рівень ІЛ-6 — набору «ИФА-БЕСТ» (Росія), лептину — ELISA KIT, DIAMED, DRG (Німеччина).
ІР визначали за індексом НОМА (добуток з глюкози в плазмі крові та інсуліну натще, поділений на 22,5).
Діагноз МС встановлювали на підставі критеріїв АТР III — NCEP: загальноклінічні дослідження з вимірюванням окружності талії, артеріального тиску, обчислення показника індексу маси тіла (ІМТ) та визначення в сироватці крові показників ліпідного обміну (холестерину, тригліцеридів, ліпопротеїдів високої та низької щільності).
Результати
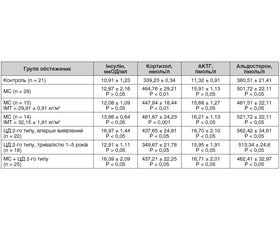
Результати проведеного дослідження засвідчили, що в усіх групах обстежених були підвищені рівні ФНП-α та ІЛ-6 (табл. 1).
За літературними даними, підвищений вміст у крові ІЛ-6 є прогностичним маркером розвитку ЦД 2-го типу, а в подальшому і виникнення інфаркту міокарда [1, 2].
Цитокіни займають особливе місце у формуванні різних проявів ЦД 2-го типу. Так, наприклад, ІЛ-6 секретується багатьма типами клітин, зокрема макрофагами, ендотеліальними клітинами, міоцитами, фібробластами, ліпоцитами. Активну участь у диференціюванні моноцитів у макрофаги бере ІЛ-6, що стимулює експресію генів гепатоцитів і макрофагів, відповідальних за синтез білків гострої фази, сприяє синтезу ФНП-α макрофагами при дії ліпополісахаридів, індукує проліферацію гладком’язових волокон судин, експресію на них адгезивних молекул ІSАМ, регулює функцію гіпофіза, секрецію гормонів і механізми контролю функціонування гіпоталамо-гіпофізарно-надниркової осі.
Як показали результати нашого дослідження, у всіх групах обстежених були підвищені рівні ФНП-α та ІЛ-6. На відміну від ФНП-α ІЛ-6 проявляє активність не лише локальну, а й, що більш важливо, системну.
Підвищені рівні ФНП-α та ІЛ-6 мають прямий кореляційний зв’язок з ІМТ та рівнем ІР. ФНП-α прямо впливає на втрату жировими клітинами чутливості до інсуліну, що супроводжується пригніченням інсулінозалежної утилізації глюкози, розвитком гіперглікемії, підвищенням в крові вмісту інсуліну натще. До розвитку системної ІР шляхом індукції виходу вільних жирних кислот із ліпоцитів, пригнічення синтезу адипонектину та стимуляції гіпоталамо-гіпофізарно-надниркової системи причетний ФНП-α.
Отримані нами дані збігаються з гіпотезою, що ФНП-α є медіатором артеріальної гіпертензії (АГ), зумовленої ожирінням.
До цитокінів також належить і лептин, рівень секреції якого не залежить від характеру поширення підшкірної жирової тканини людини, а зумовлений розмірами адипоцитів: чим більші останні, тим активніше вони синтезують лептин. Дефіцит лептину не є етіологічним чинником розвитку ожиріння, а навпаки, у хворих з ожирінням визначається гіперлептинемія.
Однак, за нашими даними, його вірогідно підвищений рівень був лише у групі хворих на ЦД 2-го типу з МС. У пацієнтів з МС без ЦД ми спостерігали лише тенденцію до підвищення рівня лептину (табл. 1).
За даними літератури, у разі збільшення концентрації прозапальних цитокінів активується біосинтез кортиколіберину та кортикотропіну [8, 9]. Збільшення синтезу АКТГ зумовлює активацію надниркових залоз, стимулює продукцію глюкокортикоїдів і пригнічує секрецію гонадотропінів і тестостерону (табл. 2), тоді як ІЛ-6 спроможний і безпосередньо індукувати синтез кортикостероїдів наднирковими залозами. Отже, ІЛ-6 є стимулятором функціонування гіпоталамо-гіпофізарно-надниркової осі і може розглядатися як необхідний елемент регуляції її активності, особливо в разі дії стресу на організм [10–12].
Результати вивчення рівнів гормонів показали, що у чоловіків, хворих на МС, були вірогідно підвищеними рівні кортизолу й альдостерону, вміст інсуліну мав тенденцію до підвищення, що не зовсім відповідає даним літератури.
Тому було вирішено розподілити хворих з МС на дві групи залежно від ІМТ, що дозволило зробити висновок: чим більше ІМТ, тим вищий рівень інсуліну. Для підтримки нормоглікемії у хворих на МС β-клітини підшлункової залози надмірно продукують інсулін. Мета гіперінсулінемії — подолати ІР. Тому гіперінсулінемію, яку ми спостерігаємо у хворих на МС, можна прирівняти до маркерів ІР і вважати провісником початку ЦД.
Аналогічні результати спостерігали у хворих на МС з ЦД 2-го типу. Найбільш виражені зміни в рівнях гормонів спостерігали із вперше виявленим ЦД 2-го типу, що можна пояснити декомпенсацією основного захворювання. Кортизол стимулює кортизолзалежну ліпопротеїдліпазу на капілярах жирових клітин верхньої половини тулуба, черевної стінки та вісцерального жиру, що призводить до збільшення його відкладень, розвитку гіпертрофії жирових клітин та адипозного ожиріння.
Підвищений рівень альдостерону є однією з причин АГ (табл. 2).
Дослідження рівнів загального та вільного тестостерону в сироватці крові виявили зниження цих показників у чоловіків усіх груп порівняно з конт–рольними показниками (табл. 3). Більш виражені ознаки андрогенного дефіциту спостерігали в обстежених чоловіків з МС та ЦД 2-го типу, що, за даними літератури, є свідченням патогенетичної ролі дефіциту тестостерону в прогресуванні ІР у хворих на МС [13, 14].
Обговорення
Концентрація естрадіолу в обстежених чоловіків, хворих тільки на МС та тільки на ЦД 2-го типу, вірогідно не відрізнялась від показників контрольної групи. У чоловіків з поєднанням МС і ЦД 2-го типу спостерігалася тенденція до збільшення показників естрадіолу, що може вказувати на підвищення реакції ароматизації тестостерону в надлишковій жировій тканині у цієї групи пацієнтів.
Таким чином, підвищені рівні ФНП-α та ІЛ-6 виявлені в усіх групах обстежених чоловіків. Показники ФНП-α та ІЛ-6 мали прямий кореляційний зв’язок з ІМТ та величиною ІР.
У чоловіків, хворих на МС, МС та ЦД 2-го типу, були вірогідно підвищені рівні кортизолу, альдостерону, АКТГ та інсуліну. Рівні інсуліну та АКТГ прямо пропорційно залежали від ІМТ.
Результати обстеження свідчили про наявність андрогенного дефіциту в усіх групах пацієнтів. Виявлено тенденцію до підвищення рівня естрадіолу у чоловіків з МС та ЦД 2-го типу.
Відомо, що близько 20 % хворих на ЦД 2-го типу не страждають від ожиріння, і, найімовірніше, у них не розвивається дисфункція жирової тканини [15–18]. Проте формування даного варіанта ЦД також може бути пов’язане з прозапальними цитокінами, здебільшого макрофагального походження. Це припущення відповідає гіпотезі про вирішальну роль прозапальних цитокінів імунної системи у генезі ЦД 2-го типу окремих осіб з підвищеною чутливістю до різноманітних чинників стресу та некерованим синтезом макрофагальних цитокінів. Зрозуміло, що у даному випадку причиною розвитку ЦД є дисфункція не жирової тканини, а неспецифічної ланки імунітету.
Висновки
У хворих на ЦД 2-го типу з МС та у групі з МС без ЦД відзначаються підвищені рівні ФНП-α та ІЛ-6, кортизолу, альдостерону, адренокортикотропного гормону та інсуліну.
Проведені дослідження показали наявність андрогенного дефіциту в усіх групах пацієнтів. Більш виражені ознаки андрогенного дефіциту спостерігали у обстежених чоловіків з МС та ЦД 2-го типу.
Рівні інсуліну й АКТГ прямо пропорційно залежать від індексу маси тіла. У пацієнтів з МС без ЦД спостерігалася лише тенденція до підвищення рівня лептину. Встановлена тенденція підвищення рівня естрадіолу у чоловіків з ЦД 2-го типу та МС.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/28-1.jpg)
/29-1.jpg)