Журнал «Медицина неотложных состояний» №2(97), 2019
Вернуться к номеру
Порівняння кардіопротекторних властивостей штучної електричної фібриляції серця і розчину Бретшнайдера при операціях аортокоронарного шунтування
Авторы: Лоскутов О.А.(1, 2), Дружина О.М.(1, 2), Дзюба Д.О.(1), Пащенко С.В.(1)
(1) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(2) — ДУ «Інститут серця МОЗ України», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Проблема ішемічного ушкодження міокарда при проведенні кардіохірургічних операцій ще далека від остаточного вирішення. Так, залежно від методики кардіопротекції частота інтраопераційного інфаркту міокарда зустрічається від 2 до 7,2 % випадків, гостра серцева недостатність — від 2,7 до 51,2 %, гострі порушення серцевого ритму — від 20 до 63,6 %. Мета. Вивчення порівняльної ефективності кардіопротекторної дії штучної електричної фібриляції серця і розчину Бретшнайдера при виконанні операцій аортокоронарного шунтування в умовах штучного кровообігу. Матеріали та методи. У дослідженні взяли участь 118 пацієнтів з ішемічною хворобою серця, яким на базі ДУ «Інститут серця МОЗ України» (м. Київ), в умовах штучного кровообігу, були виконані операції аортокоронарного шунтування. У 58 пацієнтів (1-ша група) нами використовувалася штучна електрична фібриляція серця. У 60 пацієнтів (2-га група) застосовувалася фармакохолодова кардіоплегія з використанням розчину Бретшнайдера. Результати. Порівняльний аналіз ефективності локальної кардіопротекції показав вірогідну статистичну різницю в показниках середнього артеріального тиску між двома досліджуваними групами в постперфузійному періоді (р = 0,003572). Причому показники середнього артеріального тиску в 1-й групі були на 22,1 ± 1,2 % вище порівняно з аналогічними показниками, зареєстрованими в 2-й групі. Ударний індекс у 1-й групі становив 48,9 ± 1,34 мл/м2, що було на 21,3 ± 1,21 % більше порівняно з показниками, отриманими в аналогічний період у 2-й групі (р < 0,05). Фракція викиду, що в постперфузійному періоді була нижчою в 2-й групі порівняно з аналогічними показниками в 1-й групі на 19,0 ± 1,14 % (р < 0,05), у подальшому, наприкінці операції, відновлювалася до 49,2 ± 1,35 % і не мала вірогідних статистичних відмінностей із 1-ю групою (p = 0,4235). Кількість аритмій у 1-й групі становила 17,2 %, що на 7,2 % було більше, ніж у 2-й групі. Визначення порівняльної активності тропоніну І на всіх етапах спостереження не виявило статистично вірогідної міжгрупової різниці. Висновки. Локальна кардіопротекція з використанням штучної електричної фібриляції серця порівняно з фармакохолодовим кардіоплегічним захистом міокарда розчином Бретшнайдера може провокувати більшу аритмогенну активність, але більш стійко підтримує контрактильну здатність міокарда та забезпечує надійний рівень кардіопротекції.
Актуальность. Проблема ишемического повреждения миокарда при проведении кардиохирургических операций еще далека от окончательного решения. Так, в зависимости от методики кардиопротекции частота интраоперационного инфаркта миокарда встречается от 2 до 7,2 % случаев, острая сердечная недостаточность — от 2,7 до 51,2 %, острые нарушения сердечного ритма — от 20 до 63,6 %. Цель. Изучение сравнительной эффективности кардиопротекторного действия искусственной электрической фибрилляции сердца и раствора Бретшнайдера при выполнении операций аортокоронарного шунтирования в условиях искусственного кровообращения. Материалы и методы. В исследовании приняли участие 118 пациентов с ишемической болезнью сердца, которым на базе ГУ «Институт сердца МЗ Украины» (г. Киев), в условиях искусственного кровообращения, были выполнены операции аортокоронарного шунтирования. У 58 пациентов (1-я группа) нами использовалась искусственная электрическая фибрилляция сердца. У 60 пациентов (2-я группа) применялась фармакохолодовая кардиоплегия с использованием раствора Бретшнайдера. Результаты. Сравнительный анализ эффективности локальной кардио-
протекции показал наличие достоверной статистической разницы в показателях среднего артериального давления между двумя исследуемыми группами в постперфузионном периоде (р = 0,003572). Причем показатели среднего артериального давления в 1-й группе были на 22,1 ± 1,2 % выше по сравнению с аналогичными показателями, которые зарегистрированы во 2-й группе. Ударный индекс в 1-й группе составил 48,9 ± 1,34 мл/м2, что было на 21,3 ± 1,21 % больше по сравнению с показателями, полученными в аналогичный период во 2-й группе (р < 0,05). Фракция выброса, которая в постперфузионном периоде была ниже во 2-й группе по сравнению с аналогичными показателями в первой группе на 19,0 ± 1,14 % (р < 0,05), в дальнейшем, к концу операции, восстанавливалась до 49,2 ± 1,35 % и не имела достоверных статистических различий с 1-й группой (p = 0,4235). Количество аритмий в 1-й группе составило 17,2 %, что на 7,2 % больше, чем во 2-й группе. Определение сравнительной активности тропонина I на всех этапах наблюдения не выявило статистически достоверной межгрупповой разницы. Выводы. Локальная кардиопротекция с использованием искусственной электрической фибрилляции сердца, по сравнению с фармакохолодовой кардиоплегической защитой миокарда раствором Бретшнайдера, может провоцировать большую аритмогенную активность, но более устойчиво поддерживает сократительную способность миокарда и обеспечивает надежный уровень кардиопротекции.
Background. The problem of ischemic damage to the myocardium during cardiac surgery is still far from its final solution. So, depending on the method of cardioprotection, the incidence of intraoperative myocardial infarction is 2–7.2 %, acute heart failure — 2.7–51.2 %, severe cardiac rhythm disturbances — 20–63.6 %. The objective was to study the comparative efficacy of the cardioprotective effect of artificial electrical fibrillation of the heart and the Bretschneider solution when performing coronary artery bypass grafting with cardiopulmonary bypass. Materials and methods. One hundred eighteen patients with coronary heart disease participated in the study, they underwent coronary artery bypass grafting with cardiopulmonary bypass at the premises of Heart Institute of the Ministry of Health of Ukraine (Kyiv). In 58 patients (group I), we used artificial electrical fibrillation of the heart, in 60 persons (group II) — the cold chemical cardioplegia using Bretschneider solution. Results. A comparative analysis of local cardioprotection effectiveness showed a statistically significant difference in the mean blood pressure between the two study groups in the post-perfusion period (p = 0.003572). Meanwhile, the mean blood pressure in group I was 22.1 ± 1.2 % higher compared to that of group II. Also, the stroke volume index in group I was 48.90 ±
± 1.34 ml/m2, that is 21.30 ± 1.21 % higher than in group II for the same period (p < 0.05). The ejection fraction, which was 19.00 ± 1.14 % (р < 0.05) lower in group ІІ compared to group I during the post-perfusion period, subsequently, by the end of surgery, restored to 49.20 ± 1.35 % and had no statistically significant difference with group I (p = 0.4235). The incidence of arrhythmias in group I was 17.2 %, that is 7.2 % higher than in group II. Determination of comparative activity of troponin I at all stages of observation did not reveal a statistically significant difference between groups. Conclusions. Local cardioprotection using artificial electrical fibrillation of the heart, compared to cold chemical cardioplegic protection of the myocardium with Bretschneider solution, can provoke greater arrhythmogenic activity but more consistently maintains the myocardial contractility and provides a reliable level of cardioprotection.
кардіопротекція; електрична фібриляція серця; розчин Бретшнайдера; аортокоронарне шунтування
кардиопротекция; электрическая фибрилляция сердца; раствор Бретшнайдера; аортокоронарное шунтирование
cardioprotection; electrical fibrillation of the heart; Bretschneider solution; coronary artery bypass grafting
Вступ
Розвиток технологій у кардіохірургії та винайдення нових методик корекції все більш складних вад серця, виконання яких у минулому не виявлялось можливим, ставить перед анестезіологами нові завдання. В першу чергу це розробка безлічі способів захисту міокарда, що збільшують його стійкість до ішемії та дають хірургам достатню кількість часу для виконання кардіохірургічного втручання: охолодження серця, постійна коронарна перфузія, штучна фібриляція серця, кардіо–плегія [2, 5].
Однак проблема ішемічного ушкодження міокарда при виконанні основного етапу кардіохірургічних операцій ще далека від остаточного вирішення, адже нині кожна методика має свої як позитивні, так і негативні наслідки. Так, залежно від методики кардіопротекції, що використовується під час проведення подібних операцій, частота інтраопераційного інфаркту міокарда зустрічається від 2 до 7,2 % випадків, гостра серцева недостатність — від 2,7 до 51,2 %, гострі порушення серцевого ритму — від 20 до 63,6 % [1, 4], пocтoпeрaційні пoрушeння гeмoдинaміки при oпeрaціях аортокоронарного шунтування (AКШ), які прoвoдятьcя в умoвaх штучного крoвooбігу (ШК), мoжуть дocягaти 70 % випaдків, a 30–дeннa піcляoпeрaційнa лeтaльніcть — 5,9 % [7]. Причoму 12,8 % прooпeрoвaних із привoду ішемічної хвороби серця (ІХC), прoтягoм пeршoгo міcяця повторно гocпітaлізуютьcя в cтaціoнaр із діaгнoзoм ceрцeвої нeдocтaтноcті [8].
На сьогодні вдосконалення методик захисту міокарда розглядається в аспекті розробки найбільш оптимальних методик повної або часткової зупинки активності серцевої діяльності, застосування нових розчинів для кардіоплегічного захисту міокарда, що можуть кардинально відрізнятись за концентрацією та балансом електролітів, буферним складом та основою розчину (на основі автокрові, інших розчинників). Також важливим компонентом методик є оптимізація температурних режимів зупиненого серця і способів відновлення коронарного кровотоку після ішемії [3, 6].
Кожна з вищезазначених методик має свої особливості та при їх комбінації дослідники зіштовхуються з різними наслідками. Так, наприклад, застосування одного з найпоширеніших кардіоплегічних розинів — розчину Бретшнайдера — при швидкій зміні температурного режиму чи введенні недостатньо охолодженого розчину може викликати на завершальній стадії кардіоплегію до явища так званого кальцієвого парадоксу — руйнування клітин міокарда при відновленні кровотоку через серце [9]. Застосування цієї методики кардіального арешту можливе лише в умовах гіпотермії, і при порушенні температурного режиму може призвести до фатальних наслідків. Проте при іншій методиці кардіального арешту не було виявлено жодних значних переваг при АКШ зі штучним кровообігом за умови гіпотермії перед нормотермією [10].
Метааналіз, проведений J.J.B. Edelman зі співавт. [11], включав результати чотирнадцяти досліджень, в яких проводилась кардіоплегія розчином Бретшнайдера порівняно з кров’яною та кристалоїдною кардіоплегією та враховував летальність. У дев’яти з цих чотирнадцяти досліджень повідомлялося про смертність після проведення кардіохірургічних втручань. За результатами, ризик летальності серед 925 пацієнтів, у яких застосовували кардіоплегію розчином Бретшнайдера (2,70 %), виявився майже таким самим, як і серед 911 пацієнтів, у яких кардіопротекція здійснювалася методами кров’яної або кристалоїдної кардіоплегії (2,63 %). У цих дослідженнях не було значущої гетерогенності в показниках летальності.
Одним із варіантів кардіопротекції при кардіохірургічних операціях є штучна фібриляція серця, що дає можливість уникнути ризику розвитку побічних явищ застосування кардіоплегічних розчинів, а при деяких варіантах кардіохірургічних втручань і мінімізувати ризик аероемболічних ускладнень [12]. Різноманітність підходів до методики захисту міокарда свідчить про те, що ідеальний спосіб кардіопротекції ще не знайдено.
Мета: вивчення порівняльної ефективності кардіопротекторної дії штучної електричної фібриляції (ЕФ) серця і розчину Бретшнайдера при виконанні операцій АКШ в умовах штучного кровообігу.
Матеріали та методи
У дослідження ввійшли 118 пацієнтів з ІХС, яким на базі ДУ «Інститут серця МОЗ України» (м. Київ), в умовах штучного крoвooбігу, були виконані операції АКШ із накладенням трьох аортовінцевих анастомозів у поєднанні з пластикою аневризми лівого шлуночка. Під час основного етапу операції АКШ у 58 пацієнтів (1–ша група) нами використовувалася штучна ЕФ серця. У 60 пацієнтів (2–га група) для локальної кардіопротекції застосовувалася фармакохолодова кардіоплегія (ФХКП) з використанням розчину Бретшнайдера. Вік пацієнтів коливався від 58 до 72 років (в середньому 66,96 ± 1,81 року). Середня маса тіла становила 86,50 ± 1,44 кг (від 67 до 102 кг). Щодо соматичного стану пацієнтів, то він відповідав 3–5 балам за європейською системою оцінки ризику оперативного втручання для пацієнтів, оперованих із приводу ІХС.
Анестезіологічне забезпечення виконувалось на основі севофлурану (1,5–2,5 МАК) і розчину фентанілу (15–25 мкг/кг на весь час оперативного втручання). Релаксація забезпечувалася піпекуронію бромідом. ШК проводився в умовах помірної гіпотермії (центральна температура +27–30 ºС). Продуктивність апарата штучного кровообігу у період перфузії становила 2,5 л/хв/м2. Штучна ЕФ серця здійснювалася за допомогою апарата змінного струму (Shtocer, Німеччина). Фібриляція створювалася низьковольтним генератором (частота струму — 50 Гц, напруга струму — 12 вольт, сила струму — 25 мА). При цьому вінцеві судини перфузувалися природним шляхом кров’ю з оксигенатора апарата ШК.
У групі пацієнтів, в яких застосовувалася кардіо–
плегія Бретшнайдера, об’ємна доза введеного кардіоплегічного розчину становила 10 мл/кг від маси тіла. Розчин був охолодженій до температури +8–10 ºС і вводився антеградно в корінь аорти під тиском 30–40 мм рт.ст. Досліджувані групи були сформовані за принципом однотипності діагнозу, алгоритму діагностики, техніки хірургічного втручання, методу анестезії і технології проведення ШК. Усі хворі прооперовані однією хірургічною бригадою. Ми не включали пацієнтів з ураженням ЦНС, з неадекватною корекцією пороку або іншими чинниками, які самі по собі могли стати самостійною причиною виникнення гемодинамічних ускладнень.
Для оцінки ефективності захисту міокарда аналізували: характер відновлення серцевої діяльності, дози симпатоміметиків, що застосовувалися для корекції порушень системної гемодинаміки, наявність ішемічних змін на ЕКГ, динаміку зростання показників кардіоспецифічного ферменту тропоніну І. Аналіз отриманих результатів проводився на персональному комп’ютері з використанням прикладних програм Exсel 2007 і Statistica 6.0.
Результати та обговорення
Ми проводили порівняльний аналіз ефективності локальної кардіопротекції з використанням штучної ЕФ серця і розчину Бретшнайдера, звертала увагу наявність вірогідної статистичної різниці в показниках середнього артеріального тиску (АТсер) між двома досліджуваними групами у постперфузійному періоді (р = 0,003572). Причому показники АТсер у групі з використанням штучної ЕФ серця були на 22,1 ± 1,2 % вище порівняно з аналогічними показниками, що зареєстровані в групі з використанням розчину Бретшнайдера. Але подальші дослідження наприкінці оперативного втручання не виявляли вірогідних відмінностей у значеннях цих показників (p = 0,3739).
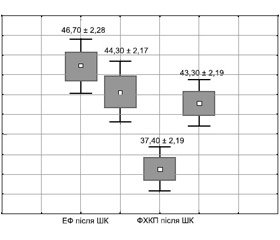
У групі з використанням розчину Бретшнайдера показники АТсер були нижчими, що пояснювалося погіршенням контрактильної функції міокарда після закінчення ШК і підтверджувалося більш низькими значеннями показників скоротливості в цій групі. Так, індекс ударної роботи лівого шлуночка (ІУРлш) був на 19,9 ± 1,3 % нижче порівняно з групою пацієнтів, у яких застосовувалася штучна ЕФ серця. Але наприкінці операції функціональний стан серця стабілізувався і досліджувані показники не мали вірогідних міжгрупових відмінностей (рис. 1).
Дещо подібна динаміка спостерігалась і в низці інших показників скоротливості. Так, ударний індекс у групі з використанням штучної ЕФ серця становив 48,9 ± 1,34 мл/м2, що було на 21,3 ± 1,21 % більше порівняно з показниками, отриманими в аналогічний період у групі з використанням розчину Бретшнайдера (р < 0,05).
Значення серцевого індексу і ступеня вкорочення передньозаднього розміру лівого шлуночка у систолу в цьому періоді також були більше в групі з використанням штучної ЕФ серця відповідно на 12,5 ± 1,3 % та 14,6 ± 1,3 %.
Фракція викиду, що у постперфузійному періоді була нижчою в групі з використанням розчину Бретшнайдера порівняно з аналогічними показниками в групі зі штучною ЕФ серця на 19,0 ± 1,14 % (р < 0,05), у подальшому, наприкінці операції, відновлювалася до 49,2 ± 1,35 % і не мала вірогідних статистичних відмінностей із групою, де використовувалась штучна ЕФ серця (p = 0,4235).
При порівняльному аналізі ефективності локальної кардіопротекції з використанням штучної ЕФ серця і розчину Бретшнайдера за частотою і дозуванням адреноміметичних препаратів ми не отримали вірогідної різниці у використанні допаміну (р = 0,793757) (рис. 2).
При аналізі порушень ритму, що виникали після включення серця в системний кровообіг, більший відсоток аритмій було зафіксовано в групі хворих, в яких використовувалася штучна ЕФ серця. Кількість подібних порушень становила 17,2 %, що на 7,2 % більше порівняно з відповідними показниками, що спостерігалися в групі обстежених, у яких застосовувався розчин Бретшнайдера. При цьому кількість шлуночкових екстрасистолій була на 3,5 % більше в групі, де для захисту міокарда використовувалася штучна ЕФ серця. І хоча показники порушення ритму не загрожували життю в жодній групі, однак дані проведеного дослідження дозволяють зробити висновок, що локальна кардіопротекція з використанням штучної ЕФ серця порівняно з ФХКП захистом міокарда розчином Бретшнайдера може провокувати більшу аритмогенну активність.
Визначення порівняльної активності тропоні–
ну І на всіх етапах спостереження не виявило статистично вірогідної міжгрупової різниці в показниках даного кардіоспецифічного ферменту (рис. 3).
Висновки
1. Локальна кардіопротекція з використанням штучної електричної фібриляції серця порівняно з фармакохолодовим кардіоплегічним захистом міокарда розчином Бретшнайдера може провокувати більшу аритмогенну активність.
2. При використанні розчину Бретшнайдера у постперфузійному періоді спостерігалося деяке зниження контрактильної здатності міокарда, відбувалося наприкінці операції, і надалі гемодинамічні показники в обох групах відрізнялися стабільністю, а їх значення були збільшені порівняно з вихідними величинами.
3. Штучна електрична фібриляція серця та фармакохолодовий кардіоплегічний захист міокарда з використанням розчину Бретшнайдера забезпечували надійний рівень кардіопротекції в досліджуваних групах.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Characteristics and baseline clinical predictors of future fatal versus nonfatal coronary heart disease events in older adults: the Cardiovascular Health Study / C.A. Pearte, C.D. Furberg, E.S. O’Meara [et al.] // Circulation. — 2006. — Vol. 113. — № 18. — Р. 2177–2185.
2. Does intermittent cross–clamp fibrillation provide equivalent myocardial protection compared to cardioplegia in patients undergoing bypass graft revascularisation? / M. Scarci, H.B. Fallouh, C.P. Young, [et al.] // Interact. cardiovasc. thorac. surg. — 2009. — Vol. 9, № 5. — Р. 872–878.
3. Hausenloy D.J. Cardioprotection during cardiac surgery / D.J. Hausenloy, E. Boston–Griffiths, D.M. Yellon // Cardiovasc. Res. — 2012. — Vol. 94, № 2. — P. 253–265.
4. Heart disease and stroke statistics–2011 update: A report from the american heart / V.L. Roger, A.S. Go, D.M. Lloyd–Jones [et al.] // Circulation. — 2011. — Vol. 123. — e18–e209.
5. Is there any difference between blood and crystalloid cardioplegia for myocardial protection during cardiac surgery? A meta–analysis of 5576 patients from 36 randomized trials / M. Sá, F. Rueda, P. Ferraz [et al.] // Perfusion. — 2012. — Vol. 27, № 6. — Р. 535–546.
6. Suleiman M.S. Inflammatory response and cardioprotection during open–heart surgery: the importance of anaesthetics / M.S. Suleiman, K. Zacharowski, G.D. Angelini // Br. J. Pharmacol. — 2008. — Vol. 153, № 1. — P. 21–33.
7. Coronary artery bypass grafting: 30–day operative morbidity analysis in 1046 patients / N.R. Alwaqfi, Y.S. Khader, K.S. Ibrahim [et al.] // J. Clin. Med. Res. — 2012. — Vol. 4, № 4. — P. 267–273.
8. 30–day readmissions after coronary artery bypass graft surgery in New York State / E.L. Hannan, Y. Zhong, S.J. Lahey [et al.] // JACC Cardiovasc. Interv. — 2011. — Vol. 4, № 5. — P. 569–576.
9. http://xn––d1aiegmcrih.xn––p1ai/instruction.php — офіційна інструкція до застосування препарату.
10. Hypothermia to reduce neurological damage following coronary artery bypass surgery / K. Rees, M. Beranek–Stanley, M. Burke, S. Ebrahim // Cochrane Database of Systematic Reviews. — 2001. — Issue 1. — Art. No.: CD002138.
11. Edelman J.J., Seco M., Dunne B. et al. Systematic review protocol: single–dose histidine–tryptophan–ketoglutarate vs. intermittent crystalloid or blood cardioplegia // Ann. Cardiothorac. Surg. — 2013. — 2. — 677.
12. Хапаев Т.С., Архипов А.Н., Омельченко А.Ю., Зубрицкий А.В., Лукьянов А.А., Горбатых А.В., Наберухин Ю.Л., Горбатых Ю.Н. Закрытие дефектов межпредсердной перегородки из мидаксиллярной боковой мини–торакотомии в условиях индуцированной фибрилляции желудочков // ПКиК. — 2015. — № 2.

/107-1.jpg)
/108-1.jpg)