Журнал "Гастроэнтерология" Том 53, №1, 2019
Вернуться к номеру
Хронічний атрофічний гастрит: фактори ризику та їх взаємозв’язок із вираженістю морфологічних змін слизової оболонки шлунка
Авторы: Мосійчук Л.М., Демешкіна Л.В., Кушніренко І.В., Сімонова О.В., Петішко О.П., Зигало Е.В.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Актуальність. Хронічний атрофічний гастрит (ХАГ) належить до передракових захворювань шлунка, на тлі якого часто спостерігаються кишкова метаплазія і дисплазія, а також частіше, ніж у здорових осіб, може виникати рак шлунка. Мета дослідження: вивчити фактори ризику ХАГ та їх взаємозв’язок із вираженістю морфологічних змін слизової оболонки шлунка. Матеріали та методи. Під спостереженням перебували 120 пацієнтів із ХАГ. Усі хворі проходили ендоскопічне (із функцією NBI), морфологічне обстеження й анкетування за допомогою анкети, що була розроблена для хворих із ХАГ, із метою вивчення факторів ризику. Результати. Були визначені значущі чинники розвитку передракових змін слизової оболонки шлунка, серед яких на перший план виступили показники, які характеризують гострий (r = 0,593) та хронічний стрес (r = 0,544), вживання надмірної кількості жарених (r = 0,636), копчених (r = 0,512) та маринованих (r = 0,591) продуктів, вік (r = 0,639), ІІ групу крові (r = 0,651), онкоспадковість (r = 0,533), наявність дуоденогастрального рефлюксу (r = 0,524) та патології щитоподібної залози (r = 0,522). За результатами ендоскопічного (езофагогастродуоденоскопія) та морфологічного досліджень виявлено зменшення частоти Helicobacter pylori-інфікування із зростанням перебудовних змін слизової оболонки шлунка (атрофія — метаплазія — дисплазія). Висновки. Установлено можливий вплив таких факторів ризику, як стрес, вік, група крові, спадковість, вживання надмірної кількості жарених, копчених та маринованих продуктів, захворювання щитоподібної залози та наявність дуоденогастрального рефлюксу, на розвиток ХАГ.
Актуальность. Хронический атрофический гастрит (ХАГ) относится к предраковым заболеваниям желудка, на фоне которого часто наблюдаются кишечная метаплазия и дисплазия, а также чаще, чем у здоровых лиц, может возникать рак желудка. Цель исследования: изучить факторы риска ХАГ и их взаимосвязь с выраженностью морфологических изменений слизистой оболочки желудка. Материалы и методы. Под наблюдением находились 120 пациентов с ХАГ. Все больные проходили эндоскопическое (с функцией NBI), морфологическое обследование и анкетирование с помощью анкеты, которая была разработана для больных с ХАГ с целью изучения факторов риска. Результаты. Были определены значимые факторы развития предраковых изменений слизистой оболочки желудка, среди которых на первый план выступили показатели, которые характеризуют острый (r = 0,593) и хронический стресс (r = 0,544), употребление чрезмерного количества жареных (r = 0,636), копченых (r = 0,512) и маринованных (r = 0,591) продуктов, возраст (r = 0,639), ІІ группа крови (r = 0,651), онконаследственность (r = 0,533), наличие дуоденогастрального рефлюкса (r = 0,524) и патологии щитовидной железы (r = 0,522). По результатам эндоскопического и морфологического исследований выявлено уменьшение частоты Helicobacter pylori-инфицирования по мере роста перестроечных изменений слизистой оболочки желудка (атрофия — метаплазия — дисплазия). Выводы. Установлено возможное влияние таких факторов риска, как стресс, возраст, группа крови, наследственность, употребление чрезмерного количества жареных, копченых и маринованных продуктов, заболевания щитовидной железы и наличие дуоденогастрального рефлюкса на развитие ХАГ.
Background. Chronic atrophic gastritis (CAG) is the pre-cancer diseases of stomach. There are often intestinal metaplasia and dysplasia, which could lead to gastric cancer development. The purpose was to study the different risk factors in patients with CAG, and their possible correlations with morphological gastric mucosal changes. Materials and methods. One hundred twenty patients with CAG were included in this study. They underwent an examination with magnifying narrow-band imaging endoscopy. Images resolution was evaluated, as well stomach endoscopic biopsies were analyzed to confirm diagnosis. The questionnaire was worked out and used in patients with CAG to evaluate risk factors. Results. It was found that acute stress (r = 0.593) and chronic stress (r = 0.544), large amounts of fried (r = 0.636), smoked (r = 0.512) and pickled foods (r = 0.591), age (r = 0.639), the A blood type (ABO blood group system) (r = 0.651), heredity (r = 0.533), duodenogastric reflux (r = 0.524), and thyroid disease (r = 0.522) were possible risk factors for CAG. According to examination with magnifying narrow-band imaging endoscopy and morphological results, the Helicobacter pylori incidence became rarer with the increase in gastric morphological changes (atrophy-metaplasia-dysplasia). Conclusions. The results show possible influence of risk factors, such as stress, age, the A blood type (ABO blood group system), heredity, large amounts of fried, smoked and pickled foods, as well as duodenogastric reflux and thyroid disease, in patients with CAG.
хронічний атрофічний гастрит; кишкова метаплазія; дисплазія; анкетування; фактори ризику
хронический атрофический гастрит; кишечная метаплазия; дисплазия; анкетирование; факторы риска
chronic atrophic gastritis; intestinal metaplasia; dysplasia; questionnaire; risk factors
Вступ
На сьогодні безперечним є факт того, що наявність атрофії слизової оболонки шлунка (СОШ) та кишкової метаплазії (КМ) пов’язана з високим ризиком розвитку раку шлунка, оскільки вони становлять фон, на якому розвиваються дисплазія й аденокарцинома шлунка кишкового типу [1–3].
Поширеність хронічного атрофічного гастриту (ХАГ) і КM варіює між країнами. Наприклад, поширеність атрофічного гастриту в тілі шлунка становить: у Китаї — 63,8 %, Японії — 40,8 %, Кореї — 40,7 %, Латвії — 13,3 %, Російській Федерації — 10,9 %, Італії — 10,7 %, Фінляндії — 3,5 %, Німеччині — 3,1 % [4]. Рівень прогресування в рак у пацієнтів з АГ та КМ відповідно становить від 0 до 1,8 % і від 0 до 10 % на рік [5].
За даними Міжнародного агенства з вивчення раку, серед усіх злоякісних новоутворень у людини рак шлунка є четвертою найбільш поширеною формою і другою причиною смерті від раку у світі [6]. Згідно з офіційною статистикою, в Україні у 2017 році 58,7 % хворих із вперше виявленим раком шлунка мали III–IV стадії процесу, а питома вага виявлених при профоглядах становила лише 8,4 % [7], що підкреслює медико-соціальну значущість заходів, спрямованих на визначення основних чинників розвитку саме передракових змін СОШ.
Щодо впливу Нelicobacter pylori (Нр) на стан слизової оболонки, то доведено, що на формування передракових змін впливає саме канцерогенний потенціал різних штамів Нp [8, 9]. Однак, незважаючи на високий рівень інфікування Hp, у деяких регіонах спостерігається низька поширеність передракових уражень і раку шлунка [10]. Отже, інші фактори, такі як спосіб життя, особливості харчування, якість споживаних продуктів, психоемоційне перенапруження, зміни навколишнього середовища, можуть відігравати важливу роль у розвитку ХАГ, КМ та дисплазії СОШ [11].
Ураховуючи, що післяопераційна 5-річна виживаність для раннього раку шлунка становить від 90 до 95 %, а для пацієнтів із поширеним раком шлунка — тільки від 20 до 40 %, питання формування груп високого ризику, ймовірно, є ефективною стратегією поліпшення виживаності та якості життя даної категорії хворих [12]. Це обумовлює актуальність вивчення факторів ризику, що можуть призводити до виникнення передракових змін СОШ.
Мета дослідження: вивчити фактори ризику розвитку ХАГ та їх взаємозв’язок із вираженістю морфологічних змін СОШ.
Матеріали та методи
Під спостереженням перебували 120 пацієнтів із ХАГ. Відповідно до морфологічних змін у СОШ згідно з Європейськими рекомендаціями Guidelines for the Management of Precancerous Conditions and Lesions in the Stomach (MAPS) [13] всі обстежені були розподілені на 4 групи: I група (n = 16) — хворі з атрофічними змінами різного ступеня вираженості без КМ, II група (n = 29) — хворі з КМ в антральному відділі шлунка, III група (n = 56) — із КМ у тілі й антральному відділі шлунка, IV група (n = 19) — із дисплазією шлунка.
Усі хворі проходили анкетування за допомогою анкети, що включала питання щодо способу життя, особливостей харчування, прийому ліків, наявності супутньої патології, причин психоемоційного стресу, онкоспадковості тощо.
Езофагогастродуоденоскопію в режимах збільшення і NBI виконували за допомогою відеоендоскопічної системи EVIS EXERA III із гастроскопом Olympus 190 [14]. Діагностику Нр-інфекції здійснювали за допомогою швидкого уреазного тесту та цитологічного дослідження мазків-відбитків.
Статистичну обробку результатів здійснювали методами варіаційної статистики, реалізованими пакетом прикладних програм Excel Microsoft Office 2010 та SPSS 16.0 for Windows [15]. Порівняння середніх значень проводили за допомогою U-критерію Манна — Уїтні. Для порівняння розподілу часток змінних використовували χ2-тест. Статистична значимість різниці оцінювалась на рівні, не нижчому від 95,0 % (ризик помилки р < 0,05). З метою визначення значущих факторів, що можуть сприяти розвитку передракових змін СОШ, проводили багатофакторний аналіз.
Результати та обговорення
За нашими даними, наявність родичів з онкологічними захворюваннями відзначила третина пацієнтів із КМ, найбільший відсоток відзначався у хворих із тотальною КМ (рис. 1). За даними кореляційного аналізу, виявлені прямі взаємозв’язки між наявністю в пацієнтів КМ та наявністю онкоспадковості (r = 0,357; р = 0,044).
За даними опитувальника, κ-інфекція в анамнезі була встановлена у 62 (51,7 %) зі 120 обстежених (50,0 % випадків у І та ІІ групах, 56,1 % — у ІІІ та 42,1 % — у ІV групах). За результатами ендоскопічного та морфологічного досліджень також спостерігали зменшення частоти κ-інфікування із зростанням перебудовних змін СОШ.
При аналізі ефективності раніше проведеного ерадикаційного лікування в досліджених пацієнтів нами було встановлено, що, незважаючи на наявність стандартизованих протоколів лікування κ-інфекції та достатньо широкий вибір препаратів і схем лікування, саме у хворих III та IV груп попередня ерадикація була неуспішною: 10,0 і 9,1 % відповідно, тоді як у хворих I та II груп вдалося досягти бажаного ефекту ерадикаційної терапії. Можливо, саме неуспішна ерадикація і посприяла розвитку більш значних морфологічних змін у хворих III та IV груп (рис. 2).
Зменшення маси тіла за останні 6 місяців відзначили 36 (30,0 %) із 120 опитаних із переважанням частоти спостереження в І та ІІ групах. Найбільш значна втрата ваги — у середньому (6,9 ± 1,8) кг — була зафіксована у IV групі, тоді як у I–III групах вона становила (5,3 ± 1,3) кг, (5,1 ± 1,2) кг та (4,0 ± 2,1) кг відповідно.
Лише 8 (6,7 %) із 120 респондентів відмітили паління як фактор ризику. Водночас хворі IV групи мали стаж паління в середньому (42,5 ± 2,2) року, що в 1,8 раза більше, ніж у ІІІ групі, — (23,3 ± 1,8) року. Навпаки, пацієнти ІІІ групи у 2 рази більше вживали сигарет на день — (15,6 ± 1,5) проти (7,8 ± 1,9) сигарети серед опитаних групи з дисплазією. У I та II групах жоден опитаний не палить.
Результати проведеного аналізу супутніх захворювань або станів, що можуть негативно впливати на прогресування передракових змін у СОШ, наведені в табл. 1.
Як видно з табл. 1, перніціозна анемія спостерігалася в 7 (5,8 %) обстежених хворих, переважно за рахунок пацієнтів із тотальною КМ та дисплазією, тоді як у пацієнтів із лише атрофічними змінами СОШ її не було виявлено. Серед ендокринної супутньої патології в обстежених пацієнтів превалювали захворювання щитоподібної залози, що, за даними опитувальника, відзначили 38 (31,7 %) хворих проти 10 (8,3 %) випадків цукрового діабету (χ2 = 18,9, р < 0,001). При цьому патологія щитоподібної залози найбільше відзначалася пацієнтами IV групи, що в 1,4 раза частіше порівняно з І, у 2,5 раза — з ІІ та в 1,9 раза — з IІІ групою (р > 0,05). Супутня гіпертонічна хвороба спостерігалася в 46 (38,3 %) випадках серед усіх обстежених хворих, її поширеність серед пацієнтів І групи у 2 рази перевищувала частоту виявлення гіпертонічної хвороби серед досліджених із КМ та в 3 рази — серед хворих із дисплазією.
За даними анкетування, хронічний гастрит в анамнезі відзначили 12 (75,0 %) хворих І групи, 24 (85,7 %) — ІІ, 51 (89,5 %) — ІІІ та 19 (100,0 %) — IV групи. При цьому пацієнти з тотальною КМ та диспластичними змінами СО мали найбільш тривалий його перебіг, а саме тоді як у половині випадків І та ІІ груп тривалість хронічного гастриту не перевищувала 5 років, у ІІІ та IV групах цей показник більше ніж у 80,0 % респондентів становив більше 6 років (р < 0,05). Хронічний гастрит понад 10 років відмітили 23 зі 106 (21,7 %) обстежених із найбільшою частотою в групах із тотальною КМ та диспластичними змінами СОШ (рис. 3).
За даними опитувальника, вплив шкідливого виробництва як фактора ризику відзначили 2 (10,5 %) пацієнти з атрофічними змінами СОШ, 7 (25,0 %) — з КМ, обмеженою антральним відділом шлунка, 16 (28,1 %) — із тотальною КМ та 6 (31,6 %) — із дисплазією СОШ.
При аналізі даних опитувальника було встановлено, що всі хворі були схильні до тривалого психоемоційного стресу — від 6 місяців до 5 років (середня тривалість — (2,85 ± 0,61) року). Основні причини, що сприяли формуванню психоемоційного стресу, наведені в табл. 3.
Як видно з табл. 3, гостру стресову ситуацію переважна більшість хворих пов’язує зі смертю близьких (78 з 120 — 65,0 %), причому в групах із більш тяжкими та поширеними перебудовними змінами СОШ частота цієї причини в 1,4 раза більша (72,4 % випадків у ІІІ та IV групах проти 52,2 % — у І та ІІ групах, χ2 = 4,1; р < 0,05). У той же час хронічний психоемоційний стрес, пов’язаний із хворобою близьких, частіше відзначають хворі з атрофією СОШ (11 із 16 (68,8 %) проти 38 зі 104 (36,5 %) у пацієнтів із передраковими змінами, χ2 = 4,7; р < 0,05). Частота таких факторів, як стрес у зв’язку зі станом свого здоров’я, проблемами на роботі та в сімейному колі, за даними респондентів, суттєво по групах не відрізнялася (р > 0,05).
Згідно з даними анкети ніхто з досліджених спиртними напоями не зловживає. 40,0 % хворих алкогольні напої вживали переважно 1 раз на місяць, причому в І групі частота їх прийому в 2 рази менша, ніж у групах із КМ та дисплазією.
При дослідженні особливостей харчування встановлено, що переважна більшість пацієнтів (56,3 % — у І групі, 71,4 % — у ІІ, 80,7 % — у ІІІ та 63,2 % — у IV) вживають мариновані продукти в невеликій кількості, проте лише 10,7 % хворих II групи та 8,8 % III групи вживають їх щоденно (рис. 4).
Жарені продукти не вживають лише 12,5 % пацієнтів І групи, 21,4 % — ІІ, 24,6 % — ІІІ та 26,3 % — IV групи. З решти анкетованих 20 (21,5 %) із 93 хворих вживають їх у великій кількості. Щоденний їх прийом відмітили 35,7 % пацієнтів із дисплазією, що в 2,6 раза частіше порівняно з ІІ та в 1,4 раза — із ІІІ групою (рис. 5). Серед хворих із лише атрофічними змінами СОШ значно рідше вживають ці продукти і не частіше ніж 1 раз у 2–3 дні.
Щодо копченостей, то 56,3 % анкетованих І групи вживають їх у невеликій кількості і 83,3 % із них рідше ніж 1 раз у 2–3 дні. Багато копчених продуктів вживають 10,0 % пацієнтів I та ІІ груп, 15,4 % — III і 9,1 % — IV групи. Частоту вживання 1 раз у 2–3 дні частіше, ніж в інших групах, відмітили пацієнти з КМ незалежно від поширення перебудовних змін у СОШ. Третина хворих із дисплазією СОШ (33,3 %) вживає копченості щодня, що перевищує частоту прийому цих продуктів у 3,7 раза порівняно з ІІ та в 1,8 раза — порівняно з ІІІ групою (рис. 6).
Виявлені прямі кореляційні взаємозв’язки між наявністю в пацієнтів КМ та частотою прийому маринованих (r = 0,350; р = 0,043) і копчених (r = 0,426; р = 0,034) продуктів.
Переважна більшість опитаних вживають фрукти та овочі в невеликій кількості: 62,5 % — у I групі, 71,4 % — у II, 75,4 % — у III та 78,9 % — у IV групі. Половина анкетованих відмічає щоденний їх прийом. Друга половина пацієнтів І групи вживає фрукти й овочі з частотою 1 раз на 2–3 дні, що в 1,5 раза частіше, ніж у групі хворих із КМ та в 1,8 раза — із дисплазією СОШ (рис. 7).
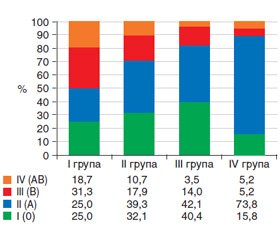
За даними анкетування було відзначено, що в І групі майже з рівною частотою спостерігали хворих всіх груп крові (рис. 8).
Натомість серед пацієнтів із КМ та дисплазією переважали особи з ІІ групою крові, причому в IV групі таких осіб було майже в 2 рази більше, ніж у ІІ та ІІІ групах, та в 3 рази порівняно з І групою (р < 0,05).
При аналізі прийому лікарських засобів серед опитаних установлено, що замісну терапію гормонами отримували 6,3 % хворих I групи, 7,1 % — II, 12,3 % — III та 15,8 % опитаних IV групи. Щодо інгібіторів протонової помпи, то більша частина опитаних (65,0 %) до надходження в клініку інституту ці препарати не приймала. Серед тих, хто використовували інгібітори протонової помпи, частота прийому переважно становила 2–3 тижні — 30,0 % у І групі, 16,7 % — у ІІ, 28,2 % — у ІІІ та 40,0 % — у IV групі. Водночас 13 (15,3 %) із 85 пацієнтів із КМ застосовували інгібітори протонової помпи більше 4 місяців. Нітропрепарати застосовували 4 (25,0 %) із 16 хворих І групи, 24 (28,2 %) із 85 пацієнтів із КМ та 6 (31,6 %) із 19 — із диспластичними змінами СОШ. Майже в половині випадків — 39 із 85 (45,9 %) у групі хворих із КМ та в 9 з 19 (47,4 %) випадків IV групи приймали ацетилсаліцилову кислоту. Також третина хворих І групи (31,3 %) та 46 (44,2 %) із 104 пацієнтів із передраковими змінами СОШ приймали інші нестероїдні протизапальні препарати. Виявлена позитивна кореляція (r = 0,397, p = 0,014) між прийомом інгібіторів протонової помпи та вираженістю передракових змін у шлунку.
Виявлені статистично значущі кореляційні взаємозв’язки (p < 0,05) між вираженістю морфологічних змін та факторами ризику наведені на рис. 9.
Як видно з рис. 9, найбільш значущими чинниками розвитку передракових змін СОШ виявилися гострий (r = 0,593) та хронічний стрес (r = 0,544), вживання надмірної кількості жарених (r = 0,636), копчених (r = 0,512) та маринованих (r = 0,591) продуктів, вік (r = 0,639), ІІ група крові (r = 0,651), онкоспадковість (r = 0,533), наявність дуоденогастрального рефлюксу (r = 0,524) та патології щитоподібної залози (r = 0,522).
Висновки
1. За даними багатофакторного аналізу були визначені значущі чинники розвитку передракових змін СОШ: гострий (r = 0,593) та хронічний стрес (r = 0,544), вживання надмірної кількості жарених (r = 0,636), копчених (r = 0,512) та маринованих (r = 0,591) продуктів, вік (r = 0,639), ІІ група крові (r = 0,651), онкоспадковість (r = 0,533), наявність дуоденогастрального рефлюксу (r = 0,524) та патології щитоподібної залози (r = 0,522).
2. За результатами ендоскопічного та морфологічного досліджень виявлено зменшення частоти Нр-інфікування із зростанням перебудовних змін СОШ.
3. Патологія щитоподібної залози спостерігалася в третини хворих на ХАГ, найчастіше в пацієнтів із дисплазією СОШ (52,8 %), що значно вище, ніж у популяції в середньому.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Rugge M., Genta R.M., Fassan M. et al. OLGA gastritis staging for the prediction of gastric cancer risk: a long-term follow-up study of 7436 patients // Am. J. Gastroenterol. — 2018 Nov. — 113(11). — Р. 1621-1628. doi: 10.1038/s41395-018-0353-8.
2. Park Y.H., Kim N. Review of atrophic gastritis and intestinal metaplasia as a premalignant lesion of gastric cancer // J. Cancer. Prev. — 2015. — 20(1). — Р. 25-40. doi: 10.15430/JCP.2015.20.1.25.
3. Lin J.T. Screening of gastric cancer: who, when, and how // Clin. Gastroenterol. Hepatol. — 2014 Jan. — 12(1). — Р. 135-8. doi: 10.1016/j.cgh.2013.09.064.
4. Буторин Н.Н., Васютин А.В., Амельчугова О.С., Новицкая М.И. Pаспространенность и факторы риска атрофического гастрита // Забайкальский медицинский вестник. — 2014. — № 2. — С. 149-152.
5. Song H., Ekheden I.G., Zheng Z. Incidence of gastric cancer among patients with gastric precancerous lesions: observational cohort study in a low risk Western population // BMJ. — 2015, Jul 27. — 351. — h3867. doi: 10.1136/bmj.h3867.
6. Ferlay J., Soerjomataram I., Ervik M. et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. — Lyon, France: International Agency for Research on Cancer. — Available from: http://globocan.iarc.fr.
7. Заклади охорони здоров’я та захворюваність населення України у 2017 році: статистичний збірник / Відп. за вип. О.О. Кармазіна. — К., 2018. — 109 с. — Режим доступу: http://www.ukrstat.gov.ua/druk/publicat/kat_u/2018/zb/06/zb_zoz_17.pdf
8. Lee Y.C., Chiang T.-H., Chou C.K. et al. Association between Helicobacter pylori eradication and gastric cancer incidence: a systematic review and meta-analysis // Gastroenterology. — 2016 May. — 150(5). — Р. 1113-1124.e5. doi: 10.1053/j.gastro.2016.01.028.
9. Ford A.C., Forman D., Hunt R., Yuan Y., Moayyedi P. Helicobacter pylori eradication for the prevention of gastric neoplasia // Cochrane Database Syst. Rev. — 2015, Jul 22. — 7. — CD005583. doi: 10.1002/14651858.CD005583.pub2.
10. Graham D.Y. Helicobacter pylori update: gastric cancer, reliable therapy, and possible benefits // Gastroenterology. — 2015 Apr. — 148(4). — Р. 719-31.e3. doi: 10.1053/j.gastro.2015.01.040.
11. Ohba R., Iijima K. Pathogenesis and risk factors for gastric cancer after Helicobacter pylori eradication // World J. Gastrointest. Oncol. — 2016. — № 8(9). — P. 663-672. doi: 10.4251/wjgo.v8.i9.663.
12. Yoon H., Kim N. Diagnosis and management of high risk group for gastric cancer // Gut. Liver. — 2015. — 9. — Р. 5-17. doi: 10.5009/gnl14118.
13. Dinis-Ribeiro M., Areia M., de Vries A.C. Management of precancerous conditions and lesions in the stomach (MAPS). Guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED) // Endoscopy. — 2012. — Vol. 44(01). — P. 74-94.
14. Коэн Д. Атлас эндоскопии пищеварительного тракта: возможности высокого разрешения и изображения в узком световом спектре / Под ред. Дж. Коэна; пер. с англ. под ред. А.А. Будзинского. М.: Логосфера, 2012. — 344 с.
15. Халафян А.А. Современные статистические методы медицинских исследований. — М.: Ленанд, 2014. — 320 с.

/24-1.jpg)
/25-1.jpg)
/25-2.jpg)
/25-3.jpg)
/26-1.jpg)
/27-1.jpg)
/27-2.jpg)
/27-3.jpg)