Журнал "Гастроэнтерология" Том 53, №1, 2019
Вернуться к номеру
Коротколанцюгові жирні кислоти: роль у розвитку синдрому подразненого кишечника
Авторы: Степанов Ю.М.(1), Будзак І.Я.(2), Кленіна І.А.(1)
(1) — ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
(2) — ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
У статті розглядаються питання патогенезу синдрому подразненого кишечника. Проведено короткий аналіз імовірних чинників розвитку синдрому подразненого кишечника. Окремо розглянута роль кишкової мікрофлори та внесок коротколанцюгових жирних кислот у процеси, що відбуваються при синдромі подразненого кишечника. Проаналізовані дослідження різних авторів стосовно коротколанцюгових жирних кислот. Показані результати власних досліджень, у яких визначався вміст коротколанцюгових жирних кислот у хворих на синдром подразненого кишечника. Було виявлено суттєве підвищення вмісту в калі коротколанцюгових жирних кислот, особливо при діарейній формі синдрому подразненого кишечника.
В статье рассматриваются вопросы патогенеза синдрома раздраженного кишечника. Проведен короткий анализ вероятных факторов развития синдрома раздраженного кишечника. Отдельно рассмотрена роль кишечной микрофлоры и вклад короткоцепочечных жирных кислот в процессы, происходящие при синдроме раздраженного кишечника. Проанализованы исследования различных авторов относительно короткоцепочечных жирных кислот. Показаны результаты собственных исследований, в которых опеределялось содержание в кале короткоцепочечных жирных кислот у больных с синдромом раздраженного кишечника. Было выявлено существенное повышение содержания короткоцепочечных жирных кислот, особенно при диарейной форме синдрома раздраженного кишечника.
The article deals with the concepts of irritable bowel syndrome. A brief analysis of probable factors of irritable bowel syndrome development was performed. The role of intestinal microflora and the contribution of short-chain fatty acids to the processes occurring in the irritable bowel syndrosme are considered in detail. There were analyzed the studies of different authors concerning short-chain fatty acids. The results of own studies evaluating fecal content of short-chain fatty acids in patients with irritable bowel syndrome are shown. There was revealed a significant increase in the level of short-chain fatty acids, especially in diarrheal form of irritable bowel syndrome.
синдром подразненого кишечника; патогенез; мікрофлора кишечника; коротколанцюгові жирні кислоти
синдром раздраженного кишечника; патогенез; микрофлора кишечника; короткоцепочечные жирные кислоты
irritable bowel syndrome; pathogenesis; intestinal microflora; short-chain fatty acids
Вступ
Як відомо, синдром подразненого кишечника (СПК) є одним з найпоширеніших захворювань органів травлення. На сьогодні діагностика СПК базується передусім на клініко-анамнестичному підході (відповідно до Римських критеріїв ІV) з обов’язковим виключенням органічних хвороб. Постійно триває пошук нових, більш простих і більш зручних методик індикації СПК (в ідеалі — лабораторних), які б дозволили легше й точніше встановлювати діагноз СПК. Проте на сьогодні якогось одного чи декількох простих лабораторних тестів індикації СПК поки що не існує. У нещодавньому метааналізі R. Sood і співавт. була перевірена діагностична точність різноманітних засобів діагностики синдрому подразненого кишечника. Було оцінено 21 дослідження із залученням понад 7 тисяч пацієнтів із СПК. Проведена оцінка 11 різноманітних біомаркерів, проте жоден не був визнаний кращим, ніж критерії діагностики синдрому подразненого кишечника, засновані на клінічній оцінці [1].
Безумовно, для удосконалення діагностики СПК дуже важливим є врахування патогенетичних факторів розвитку даного захворювання. За останні десятиліття суттєво змінилися уявлення про патогенез СПК. Якщо раніше СПК розглядався виключно як психосоматичне захворювання й практично в усіх хворих його пов’язували з впливом психоемоційних чинників, то на сьогодні очевидною є багатофакторність розвитку СПК.
У частини хворих СПК є наслідком перенесеної раніше кишкової інфекції. Сучасні дослідження показують важливий вірогідний зв’язок так званого мінімального запалення слизової оболонки кишечника та СПК. Імовірним є порушення проникності епітелію кишечника у хворих на СПК. Постійно розглядаються й вивчаються інші можливі патогенетичні чинники СПК.
Проте найбільш вивченим є взаємозв’язок між розвитком СПК і порушенням кишкової мікрофлори.
Як відомо, загальна кількість мікрофлори людини становить близько 1014 мікроорганізмів. Переважна більшість цієї мікрофлори зосереджується в травному каналі, причому відзначається поступове збільшення концентрації мікроорганізмів у дистальному напрямку (у шлунку й дванадцятипалій кишці вона становить 10–103 бактерій в 1 г вмісту, у товстій кишці — 1011–1012 відповідно) [14]. З огляду на таку значну кількість мікроорганізмів у кишечнику й важливість виконуваних ними функції (участь в травленні їжі, перешкоджання впливу патогенних бактерій на слизову кишечника (так звана колонізаційна резистентність), підтримання гомеостазу в травній системі, продукція вітамінів та інших важливих сполук тощо) логічно припустити, що внесок порушень кишкової мікрофлори в генез СПК є значним [15].
Недавні дослідження показали, що у хворих із СПК у слизовій оболонці кишечника підвищується експресія рецепторів, які розпізнають специфічні субстанції, пов’язані з мікрофлорою [16]. У хворих із СПК виникає слабко виражена активація місцевої імунної системи в слизовій кишечника, у результаті чого підвищується концентрація тучних клітин у слизовій оболонці. Доведено, що безпосередній контакт тучних клітин із нервовими контактами слизової, а також опосередковане цими клітинами підвищене виділення гістаміну й триптази корелює із симптоматикою СПК.
Спостерігається взаємодія між компонентами в просвіті кишечника (їжа, мікрофлора), епітеліальним бар’єром та імунною системою слизової оболонки кишечника. Зменшення експресії й структурна перебудова білків міжклітинних епітеліальних з’єднань кишечника викликають підвищення проникності кишкового епітелію. При підвищеній проникності кишкового епітелію виникають умови для проходження антигенів через епітеліальний бар’єр, що викликає надмірну стимуляцію імунної системи слизової кишечника. Особливо це характерно для діарейної форми СПК [17].
Очевидно, порушена мікрофлора кишечника активує імунну відповідь у слизовій оболонці, що підвищує проникність кишкового епітелію, активує ноцицептивні сенсорні шляхи й викликає порушення в ентеральній нервовій системі [18]. Натомість використання пробіотиків здатне позитивно впливати на сенсомоторні порушення й вісцеральну гіперчутливість кишечника [19]. Корисна мікрофлора кишечника здатна перешкоджати адгезії патогенних бактерій на кишкову слизову, модулювати місцеву імунну відповідь, справляючи при цьому захисну дію на епітеліоцити кишечника [15]. Важливим доказом взаємозв’язку між СПК і кишковим дисбіозом є доведений позитивний вплив пробіотиків на симптоматику СПК.
За рахунок чого кишкова мікрофлора взаємодіє з макроорганізмом?
Одним з можливих механізмів такої взаємодії можуть бути коротколанцюгові жирні кислоти (КЛЖК). Кишкова мікробіота метаболізує непереварені частини їжі (полісахариди й білки) у КЛЖК, що можуть мати численні регуляторні функції й бути важливим компонентом взаємодії «макроорганізм — мікрофлора».
На сьогодні найбільш важливими визнають три КЛЖК: оцтову (С3), пропіонову (С3) і масляну (С4) кислоти. Вони в різних концентраціях виявляються в різних відділах кишечника: приблизно 13 ммоль — у термінальному відділі здухвинної кишки, 130 ммоль — у сліпій кишці, 80 ммоль — у низхідній кишці [3]. Відомо, що КЛЖК є головним енергетичним субстратом для колоноцитів та інших клітин, є дані, що до 5–10 % базальної енергії в організмі продукується КЛЖК [3]. Вважається, що КЛЖК можуть впливати на секрецію деяких важливих біологічно активних речовин, зокрема лептину й пептиду YY.
Давно відомо, що КЛЖК здатні стимулювати кровотік у кишечнику й впливати на водний та електролітний обмін у слизовій кишечника, а також проліферацію в слизовій оболонці [8]. Отже, КЛЖК (особливо масляна кислота) є важливим компонентом колоноцитів.
Доведено, що КЛЖК мають вплив на ентероцити й лейкоцити [3]. На сьогодні відомі два механізми такої дії КЛЖК: гальмування гістон-деацетилази (HDACs) та активація G-протеїн-парних рецепторів (GPCRs) [6]. КЛЖК за рахунок впливу на ці сполуки здатні впливати на хемотаксис і фагоцитоз, індукувати реактивні кисневі сполуки, змінювати клітинну функцію. КЛЖК чинять протизапальну, протипухлинну й антимікробну дію, здатні впливати на цілісність кишкового епітелію [2]. З огляду на відомі нині багатофакторні механізми розвитку СПК вказані функції КЛЖК, очевидно, можуть відігравати при СПК важливу роль. Загалом вважається, що КЛЖК є вагомим компонентом підтримання кишкового й імунного гомеостазу [2].
Як відомо, важливою функцією лейкоцитів є міграція у вогнище запалення й руйнування мікробних патогенів. КЛЖК впливають на лейкоцити кишечника шляхом регуляції продукування цитокінів (фактор некрозу пухлини альфа (ФНП-α), інтерлейкін (ІЛ) -2, IЛ-6, IЛ-10) і хемотаксинів, можуть впливати на процеси адгезії. У деяких дослідженнях показана здатність деяких КЛЖК (передусім масляної кислоти) гальмувати продукцію протизапальних цитокінів (ФНП-α, IЛ-6) і посилювати продукцію протизапального цитокіну IЛ-10. Отже, КЛЖК можуть чинити антизапальний вплив на слизову кишечника. Проте слід зазначити, що в деяких ситуаціях був показаний прозапальний ефект КЛЖК. Ймовірним поясненням цього є здатність КЛЖК посилювати міграцію лейкоцитів. Наприклад, в умовах анаеробної бактеріальної інфекції й порушення цілісності кишкового епітелію висока концентрація КЛЖК може призводити до надмірної акумуляції нейтрофілів і посилення запального процесу. Отже, на сьогодні показано, що в різних умовах КЛЖК можуть чинити різноспрямовану дію на кишковій епітелій: прозапальну або протизапальну [3].
КЛЖК можуть впливати не лише на імунну реактивність кишечника, але й на його моторику, причому цей вплив може розрізнятися залежно від переважання окремих кислот. В одному з нещодавніх досліджень було показана, що оцтова, пропіонова й масляна кислота по-різному впливають на перистальтику кишечника в різних його відділах (проксимальних або дистальних) [5]. Отже, ця дія КЛЖК також може становити певний клінічний інтерес.
Цікавими є нові дані стосовно певної ролі КЛЖК у питаннях метаболічної регуляції. Відомо, що два рецептори GPR41 і GPR43, які активуються КЛЖК у кишечнику, є сигнальними молекулами, що впливають на енергетичний гомеостаз: GPR41 регулює симпатичну активність, GPR43 — адипозоінсулінову взаємодію. Саме ці процеси можуть бути тим, що пов’язує порушення кишкової мікробіоти й метаболічні розлади, включно з інсулінорезистентністю [4].
У дослідженні 2018 року, до якого було залучено 32 хворих із неалкогольною жировою хворобою печінки, яких порівнювали з 27 здоровими особами, було показано, що у хворих на неалкогольну жирову хворобу печінки відрізняється склад кишкової мікрофлори, зокрема, відзначається висока концентрація КЛЖК у калі й збільшення числа КЛЖК-продукуючих бактерій. Ці дані підтверджують важливу роль кишкової мікрофлори й імуномодулюючих бактеріальних метаболітів у розвитку неалкогольної жирової хвороби печінки [13].
Цікавими є дані про те, що активність кишкової мікрофлори, особливо продукція КЛЖК, здатна стимулювати L-клітини, що локалізовані в дистальному відділі здухвинної кишки й секретують пептиди YY і GLP-1 (глюкагоноподібний пептид 1), які викликають насичення їжею й впливають на харчову поведінку [9, 10]. Останні дослідження показують на те, що глюкагоноподібний пептид 1 є важливим у маніфестації симптомів СПК [11].
Важливим напрямком досліджень фахівців сьогодні є вісь «головний мозок — кишечник» або, як зараз усе частіше наголошують, «головний мозок — кишечник — кишкова мікрофлора», оскільки взаємозв’язок між головним мозком і роботою кишечника був доведений у багатьох дослідженнях. КЛЖК також, ймовірно, беруть участь у цьому процесі. Двосторонній зв’язок між центральною нервовою системою відбувається через кишкову мікрофлору за участю нейроімунних і нейроендокринних механізмів, включно з вагусом. Ця комунікація опосередкується декількома важливими сполуками, зокрема КЛЖК, вторинними жовчними кислотами й метаболітами триптофану. Вважається, що КЛЖК є важливими сигнальним молекулами, які здійснюють комунікацію між макроорганізмом і кишковою мікрофлорою за участю ентероендокринних та ентерохромафінних клітин [9].
Цікаві дані були отримані в колумбійському дослідженні J. de la Cuesta-Zuluaga зі співавт., опублікованому наприкінці 2018 року. Було досліджено 441 дорослу особу: проведені ретельне дослідження складу й різноманітності кишкової мікрофлори шляхом визначення 16S rRNA генної послідовності й індикація КЛЖК у калі методом газової хроматографії/мас-спектрометрії, а також дослідження кишкової проникності. Виявлено, що кількість фекальних КЛЖК обернено асоційована з різноманітністю кишкової мікрофлори. Встановлено, що підвищена екскреція КЛЖК асоційована з кишковим дисбіозом і кишковою проникністю, також була встановлена кореляція між підвищеним виділенням КЛЖК і надлишковою масою тіла й кардіоваскулярними ризиками [12]. Безумовно, отримані дані щодо зв’язку підвищеного вмісту КЛЖК у калі з кишковим дисбіозом і збільшенням кишкової проникності вказують на важливість подальшого вивчення діагностичної значимості індикації КЛЖК у хворих на СПК.
Стосовно застосування вимірювання фекальних КЛЖК у діагностиці СПК у реальній клінічній практиці цікавим є дослідження 2016 року, проведене в Норвегії. Була проведена оцінка фекального вмісту різних КЛЖК у 25 хворих на СПК порівняно з 25 особами без СПК. Встановлена різниця в концентрації різних КЛЖК між дослідженими групами, але здебільшого вона не була вірогідною. Проте вірогідно встановлено, що якщо різниця між пропіоновою й масляною кислотою становить понад 0,015 ммоль/л, це вказує на СПК з чутливістю 92 % і специфічністю 72 % [7].
Поки що не всі питання, пов’язані з КЛЖК, є остаточно з’ясованими. Проводиться подальше вивчення можливості застосування вимірювання фекальних КЛЖК як діагностичного тесту для СПК.
З огляду на важливість та актуальність питань, пов’язаних із кишковою мікрофлорою, зокрема з КЛЖК, доцільним є дослідження характеру змін показників КЛЖК у калі в пацієнтів із СПК.
Метою дослідження було оцінити концентрацію КЛЖК у калі у хворих на різні форми СПК.
Матеріали та методи
Дослідження проведено в ДУ «Інститут гастроентерології НАМН України» у відділенні захворювання кишечника. До дослідження залучено 15 хворих із СПК (12 жінок, 3 чоловіки, середній вік (28,3 ± 2,5) року). Діагноз синдрому подразненого кишечника встановлений при ретельному клініко-анамнестичному обстеженні з урахуванням відповідності Римським критеріям ІV (2016) при виключенні симптомів тривоги. Усі хворі відчували біль у кишечнику. Хворі були розподілені на 2 групи: перша — діарейна форма СПК (увійшли хворі з діареєю, n = 9); друга — недіарейна форма СПК (включала хворих із запорами, зі змішаними розладами дефекації, без розладів випорожнення, n = 6).
Проведена оцінка вмісту КЛЖК у всіх хворих, залучених у дослідження. Визначення КЛЖК здійснювалася методом хроматографічного дослідження з використанням апаратно-програмного комплексу для медичних досліджень на базі газового хроматографа «Хроматек-Кристал 5000» за методикою Guohua Zhao [20]. Кількісну ідентифікацію фракцій КЛЖК, калібрування колонки й обрахунок хроматограм проводили за методом нормування площ піків і їх частки згідно зі стандартами кислот фірми Sigma-Aldrich (США).
Референтними показниками КЛЖК у калі прийняті такі: оцтова кислота (С2) — 0,013–0,028 мкл/мл, пропіонова кислота (С3) — 0,0043–0,0057 мкл/мл, масляна кислота (С4) — 0,00068–0,0008 мкл/мл (контрольна група, n = 7).
Статистична обробка результатів досліджень здійснювалася за допомогою прикладних програм Excel Microsoft Office 2010 і SPSS 9.0 for Windows. Порівняння середніх значень змінних здійснювали за допомогою U-критерію Манна — Уїтні. Статистична значимість різниці оцінювалась на рівні, не нижчому від 95,0 % (ймовірність помилки р < 0,05).
Результати та обговорення
Уміст оцтової кислоти у хворих на СПК варіював у діапазоні 0–0,439 мкл/мл; середнє значення становило (0,181 ± 0,032) мкл/мл, що вірогідно вище від нормальних показників. Уміст оцтової кислоти був підвищеним у 93,3 % обстежених хворих (рис. 1).
Уміст пропіонової кислоти у пацієнтів коливався від 0,003 до 0,231 мкл/мл; середнє значення було на рівні (0,061 ± 0,018) мкл/мл, що вище від нормальних показників. У 80,0 % уміст пропіонової кислоти був підвищений, у 6,7 % — нормальний, у 13,3 % — знижений.
Уміст масляної кислоти у 93,3 % досліджених хворих був суттєво підвищеним і відзначався на рівні 0–0,111 мкл/мл, середнє значення становило (0,046 ± 0,008) мкл/мл, що було вірогідно вище від нормальних показників.
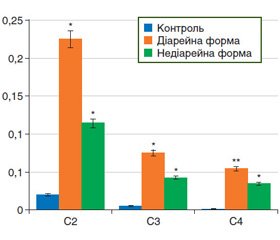
Окремо проведена оцінка КЛЖК у калі у двох групах досліджуваних хворих (рис. 2). Виявлено однонаправлені зміни їх вмісту, які були більш виражені у хворих із діарейною формою.
У групі хворих із діарейною формою СПК середній вміст оцтової кислоти становив (0,225 ± 0,043) мкл/мл, середній вміст пропіонової кислоти — (0,075 ± 0,028) мкл/мл, середній вміст масляної кислоти — (0,054 ± 0,009) мкл/мл.
Натомість у групі хворих з недіарейною формою СПК середній вміст оцтової кислоти — (0,114 ± 0,039) мкл/мл, середній вміст пропіонової кислоти — (0,042 ± 0,016) мкл/мл, середній вміст масляної кислоти — (0,034 ± 0,011) мкл/мл.
Отримані результати засвідчили, що вміст КЛЖК у калі є вищим при діарейній формі СПК порівняно з недіарейною формою СПК: оцтової кислоти — у 1,97 раза (p = 0,039), пропіонової кислоти — в 1,79 раза (p = 0,162), масляної кислоти — в 1,59 раза (p = 0,116).
Висновки
Можна зробити такі висновки:
1. У хворих на СПК відзначається суттєве підвищення вмісту КЛЖК у калі.
2. Середній вміст усіх КЛЖК є в 1,59–1,97 раза вищим у хворих із діарейною формою СПК порівняно з іншими формами хвороби.
Отримані дані вказують на асоціацію між СПК і підвищеним рівням КЛЖК. Більш детальне вивчення КЛЖК (як загалом, так і окремих кислот) може бути дуже перспективним у подальшому вивченні СПК.
Підсумовуючи, слід наголосити: КЛЖК є важливими сполуками, що формуються в кишечнику за допомогою кишкової мікрофлори й впливають на різноманітні аспекти нормального функціонування кишечника й осі «головний мозок — кишечник — кишкова мікрофлора». У хворих на СПК відбуваються різні порушення моторної й інших функцій кишечника, змінюється кишкова мікрофлора, кишкова проникність. Зрозуміло, що КЛЖК також відіграють у цьому певну роль. Отже, подальше вивчення КЛЖК в аспекті СПК може бути дуже актуальним.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Sood R., Gracie D.J., Law G.R., Ford A.C. Systematic review with meta-analysis: the accuracy of diagnosing irritable bowel syndrome with symptoms, biomarkers and/or psychological markers // Aliment. Pharmacol. Ther. — 2015. — 42. — 491-503.
2. Tan J., McKenzie C., Potamitis M., Thorburn A.N., Mackay C.R., Macia L. The role of short-chain fatty acids in health and disease // Adv. Immunol. — 2014. — 121. — 91-119.
3. Vinolo M.A., Rodrigues H.G., Nachbar R.T., Curi R. Regulation of Inflammation by Short Chain Fatty Acids // Nutrients. — 2011. — 3. — 858-876.
4. Kimura I. Host energy regulation via SCFAs receptors, as dietary nutrition sensors, by gut microbiota // Yakugaku Zasshi. — 2014. — 134(10). — 1037-42.
5. Hurst N.R., Kendig D.M., Murthy K.S., Grider J.R. The short chain fatty acids, butyrate and propionate, have differential effects on the motility of the guinea pig colon // Neurogastroenterol. Motil. — 2014. — 26(11). — 1586-96.
6. Natarajan N., Pluznick J.L. From microbe to man: the role of microbial short chain fatty acid metabolites in host cell biology // Am. J. Physiol. Cell. Physiol. — 2014. — 307(11). — C979-85.
7. Farup P.G., Rudi K., Hestad K. Faecal short-chain fatty acids — a diagnostic biomarker for irritable bowel syndrome? // BMC Gastroenterol. — 2016. — 16(1). — 51.
8. Topping D.L., Clifton P.M. Short-chain fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides // Physiol. Rev. — 2001. — 81. — 1031-1064.
9. Martin C.R., Osadchiy V., Kalani A., Mayer E.A. The Brain-Gut-Microbiome Axis // Cell. Mol. Gastroenterol. Hepatol. — 2018. — 6(2). — 133-148.
10. Tolhurst G., Heffron H., Lam Y.S., Parker H.E., Habib A.M., Diakogiannaki E., Cameron J., Grosse J., Reimann F., Gribble F.M. Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via the G-protein-coupled receptor FFAR2 // Diabetes. — 2012. — 61. — 364-371.
11. O’Malley D. Endocrine regulation of gut function — a role for glucagon-like peptide-1 in the pathophysiology of irritable bowel syndrome // Exp. Physiol. — 2019 Jan. — 104(1). — 3-10.
12. de la Cuesta-Zuluaga J., Mueller N.T., Álvarez-Quintero R., Velásquez-Mejía E.P., Sierra J.A., Corrales-Agudelo V., Carmona J.A., Abad J.M., Escobar J.S. Higher Fecal Short-Chain Fatty Acid Levels Are Associated with Gut Microbiome Dysbiosis, Obesity, Hypertension and Cardiometabolic Disease Risk Factors // Nutrients. — 2019. — 11. — 51.
13. Rau M., Rehman A., Dittrich M. et al. Fecal SCFAs and SCFA-producing bacteria in gut microbiome of human NAFLD as a putative link to systemic T-cell activation and advanced disease // United European Gastroenterol J. — 2018. — 6(10). — 1496-1507.
14. O’Hara A.M., Shanahan F. The gut flora as a forgotten organ // EMBO Rep. — 2006. — 7. — 688-93.
15. Ghoshal U., Shukla R., Ghoshal U., Gwee K., Ng S., Quigley E. The gut microbiota and irritable bowel syndrome: friend or foe? // Int. J. Inflam. — 2012. — 2012. — 151085.
16. Brint E.K., MacSharry J., Fanning A. et al. Differential expression of toll-like receptors in patients with irritable bowel syndrome // Am. J. Gastroenterol. — 2011. — 106. — 329-36.
17. Barbara G., Zecchi L., Barbaro R. et al. Mucosal permeability and immune activation as potential therapeutic targets of probiotics in irritable bowel syndrome // J. Clin. Gastroenterol. — 2012 Oct. — 46 Suppl. — S52-5.
18. Simrйn M., Barbara G., Flint H.J., Spiegel B.M., Spiller R.C., Vanner S., Verdu E.F., Whorwell P.J., Zoetendal E.G. Intestinal microbiota in functional bowel disorders: a Rome foundation report // Gut. — 2013. — 62. — 159-176.
19. Verdu E.F., Bercik P., Verma-Gandhu M. et al. Specific probiotic therapy attenuates antibiotic induced visceral hypersensitivity in mice // Gut. — 2006. — 55. — 182-90.
20. Guohua Zhao. Rapid determination of short-chain fatty acids in colonic contents and faeces of humans and rats by acidified water-extraction and direct-injection gas chromatography // Biomedical chromatography. — 2006. — 20. — 8. — 675-682.

/65-1.jpg)