Журнал «» №1 (63), 2019
Вернуться к номеру
Зміни артеріального тиску при добовому моніторуванні в пацієнтів з артеріальною гіпертензією в дослідженні Тримаран (переваги потрійної фіксованої комбінації над подвійною)
Авторы: Рековець О.Л., Сіренко Ю.М., Торбас О.О., Кушнір С.М., Примак Г.Ф.
ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», м. Київ, Україна
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
Метою дослідження було оцінити терапевтичну ефективність генеричного комбінованого препарату Комбісарт Н (фіксована потрійна комбінація валсартану/амлодипіну/гідрохлортіазиду виробництва АТ «Київський вітамінний завод») порівняно з препаратом Комбісарт (подвійна фіксована комбінація валсартану/амлодипіну виробництва АТ «Київський вітамінний завод») у лікуванні пацієнтів з артеріальною гіпертензією ІІ–ІІІ ступеня. Завдання дослідження: вивчити терапевтичну ефективність фіксованої потрійної й подвійної комбінації в лікуванні артеріальної гіпертензії; вивчити переносимість і можливі побічні реакції препаратів, що входять до складу комбінацій, які досліджувались. Матеріали та методи. У дослідження були включені 50 пацієнтів з артеріальною гіпертензією ІІ–ІІІ ступеня. Проводили офісне вимірювання артеріального тиску (АТ), добове моніторування АТ, біохімічне дослідження крові, оцінювали якість життя в динаміці за показниками опитувальника якості життя EQ-5D, вплив терапії на показники еректильної функції в чоловіків за допомогою анкети МІЕД (Міжнародний індекс еректильної дисфункції), жорсткість судинної стінки оцінювали за допомогою швидкості поширення пульсової хвилі на початку та через 3 місяці терапії. Результати. Зниження середньодобового АТ у цілому по групі становило 20,0/18,6 мм рт.ст. (р < 0,05), на подвійній (Комбісарт) комбінації — 18,0/16,1 мм рт.ст. (р < 0,05); на потрійній (Комбісарт Н) комбінації — 23,8/20,7 мм рт.ст. (р < 0,05). Зниження середньоденного АТ у цілому по групі становило 24,8/21,0 мм рт.ст. (р < 0,05), на подвійній (Комбісарт) комбінації — 19,4/17,8 мм рт.ст. (р < 0,05), на потрійній (Комбісарт Н) комбінації — 17,8/22,6 мм рт.ст. (р < 0,05). Зниження середньонічного АТ у цілому по групі становило 18,4/17,7 мм рт.ст. (р < 0,05); на подвійній (Комбісарт) комбінації — 17,0/12,1 мм рт.ст. (р < 0,05), на потрійній (Комбісарт Н) комбінації — 20,5/18,2 мм рт.ст. (р < 0,05). Досягнення цільового АТ при добовому моніторуванні в цілому по групі становило 86 %: 77,3 % пацієнтів — на подвійній комбінації, у 95,2 % — на потрійній комбінації. Висновки. Потрійна комбінація Комбісарт Н була більш ефективною в зниженні артеріального тиску при добовому моніторуванні порівняно з подвійною комбінацією Комбісарт без збільшення побічних ефектів.
Целью исследования было оценить терапевтическую эффективность генерического комбинированного препарата Комбисарт Н (фиксированная тройная комбинация валсартана/амлодипина/гидрохлортиазида производства АО «Киевский витаминный завод») по сравнению с препаратом Комбисарт (двойная фиксированная комбинация валсартана/амлодипина производства АО «Киевский витаминный завод») в лечении пациентов с артериальной гипертензией ІІ–ІІІ степени. Задачи исследования: изучить терапевтическую эффективность фиксированной тройной и двойной комбинации в лечении артериальной гипертензии; изучить переносимость и возможные побочные реакции препаратов, входящих в состав комбинаций, которые исследовались. Материалы и методы. В исследование были включены 50 пациентов с артериальной гипертензией ІІ–ІІІ степени. Проводили офисное измерение артериального давления (АД), суточное мониторирование АД, биохимическое исследование крови, оценивали качество жизни в динамике по показателям опросника качества жизни EQ-5D, влияние терапии на показатели эректильной функции у мужчин с помощью анкеты МИЭД (Международный индекс эректильной дисфункции), жесткость сосудистой стенки оценивали с помощью скорости распространения пульсовой волны в начале и через 3 месяца терапии. Результаты. Снижение среднесуточного АД в целом по группе составило 20,0/8,6 мм рт.ст. (Р < 0,05), на двойной (Комбисарт) комбинации — 18,0/16,1 мм рт.ст. (Р < 0,05), на тройной (Комбисарт Н) комбинации — 23,8/20,7 мм рт.ст. (Р < 0,05). Снижение среднедневного АД в целом по группе составило 24,8/21,0 мм рт.ст. (Р < 0,05), на двойной (Комбисарт) комбинации — 19,4/17,8 мм рт.ст. (Р < 0,05), на тройной (Комбисарт Н) комбинации — 17,8/22,6 мм рт.ст. (Р < 0,05). Снижение середненочного АД в целом по группе составило 18,4/17,7 мм рт.ст. (Р < 0,05), на двойной (Комбисарт) комбинации — 17,0/12,1 мм рт.ст. (Р < 0,05), на тройной (Комбисарт Н) комбинации — 20,5/18,2 мм рт.ст. (Р < 0,05). Достижение целевого АД при суточном мониторировании в целом по группе составило 86 %: у 77,3 % пациентов — на двойной комбинации, у 95,2 % — на тройной комбинации. Выводы. Тройная комбинация Комбисарт Н была более эффективной в снижении артериального давления при суточном мониторировании по сравнению с двойной комбинацией Комбисарт без увеличения побочных эффектов.
Background. The purpose of the study was to evaluate the therapeutic efficacy of the generic combination (a triple fixed combination of valsartan/amlodipine/hydrochlorothiazide (val/aml/HCT) compared to a double fixed combination of valsartan/amlodipine) in the treatment of patients with stage II–III hypertension. The objectives were: to study the therapeutic efficacy of a triple fixed and double combination in the treatment of hypertension; to investigate the tolerability and possible adverse reactions of the drugs included in the composition of the studied compounds. Materials and methods. The study involved 50 patients with stage II–III hypertension. The office measurement of blood pressure, ambulatory blood pressure monitoring, biochemical blood tests were performed, quality of life was assessed using EQ-5D questionnaire; the effect of therapy on male erectile function parameters was evaluated with the help of the International Index of Erectile Function, and vascular wall stiffness — according to pulse wave velocity in the beginning of therapy and 3 months after. Results. A decrease in the average daily blood pressure in the general group was 20.0/18.6 mmHg (p < 0.05), 18.0/16.1 mmHg (p < 0.05) on double combination (val/aml) and 23.8/20.7 mmHg (p < 0.05) on triple combination (val/aml/HCT). A decrease in the average daytime blood pressure in the general group was 24.8/21.0 mmHg (p < 0.05), 19.4/17.8 mmHg (p < 0.05) on double (val/aml) and 17.8/22.6 mmHg (p < 0.05) on triple combination (val/aml/HCT). A decrease in the average nocturnal blood pressure in the ge-neral group was 18.4/17.7 mmHg (p < 0.05), 17.0/12.1 mmHg (p < 0.05) on double (val/aml) and 20.5/18.2 mmHg (p < 0.05) on triple (val/aml/HCT) combination. Achievement of target blood pressure during ambulatory blood pressure monitoring in all patients was 86 %, in the group of double (val/aml) combina-tion — 77.3 %, and 95.2 % in patients who received triple (val/aml/HCT) combination. Conclusions. A triple fixed combination (val/aml/HCT) was more effective in reducing blood pressure with daily monitoring compared to a double fixed (val/aml) combination which was not accompanied by an increase in side effects.
артеріальна гіпертензія; валсартан; амлодипін; ефективність
артериальная гипертензия, валсартан; амлодипин; эффективность
hypertension; valsartan; amlodipine; efficacy
Вступ
Підвищення артеріального тиску є наслідком взаємодії багатьох факторів, специфічну причину вдається ідентифікувати рідко. Багатофакторний патогенез артеріальної гіпертензії (АГ) і складна взаємодія факторів, що регулюють рівень артеріального тиску (АТ), є причиною того, що часто не вдається нормалізувати артеріальний тиск, вибірково впливаючи на якийсь один механізм.
Вимогою до будь–якої комбінації є доведене більш виражене зниження артеріального тиску, ніж при використанні компонентів у монотерапії. Це може бути досягнуто при комбінуванні препаратів, що впливають на різні механізми або ефективно блокують контррегуляторні відповіді. Комбінування двох препаратів може привести до часткової або повної адитивності їх гіпотензивного ефекту.
Вираженість взаємного посилення антигіпертензивного ефекту залежить від того, наскільки чітка дія кожного компонента щодо пресорного механізму, на який він спрямований, і від того, наскільки різняться точки прикладання дії препаратів, які використовуються в комбінації. Покращання переносимості лікування є ключовим елементом раціонального комбінування лікарських засобів.
Це досягається в тих випадках, коли фармакологічні ефекти одного препарату нейтралізують небажані ефекти іншого. Так, використання комбінації інгібітору ангіотензинперетворюючого ферменту (АПФ) або блокатора рецепторів ангіотензину II (БРА II) з дигідропіридиновими антагоністами кальцію (АК) значно знижує частоту виникнення асоційованих з АК набряків, а також гіпокаліємію, асоційовану з прийомом діуретиків. Сумарні дані показують, що близько 75 % пацієнтів потребують комбінованої терапії для досягнення рекомендованого рівня цільового АТ [19].
Відповідно до сучасних рекомендацій із лікування АГ більшість пацієнтів потребують прийому двох або більше антигіпертензивних препаратів для досягнення цільових рівнів АТ [23, 24]. Такі висновки були зроблені на основі результатів великих клінічних досліджень, що продемонстрували необхідність комбінованої терапії [26]. Фіксована комбінація зменшує кількість таблеток, що пацієнт повинен приймати, покращуючи його прихильність до лікування. Метааналіз 9 досліджень, у яких порівнювали застосування фіксованої комбінації з монотерапією в лікуванні пацієнтів із цукровим діабетом (ЦД) та АГ, показав 26% покращення прихильності до лікування на фоні прийому фіксованої комбінації [33, 35].
У травні 2009 р. FDA схвалило першу потрійну комбінацію амлодипіну, валсартану і гідрохлортіазиду (ГХТ) в одній таблетці. Потім були схвалені комбінації, що складалися з амлодипіну/олмесартану/ГХТ і амлодипіну/ аліскірену/ГХТ. Вимоги FDA щодо схвалення фіксованих потрійних комбінацій антигіпертензивних препаратів крім проведення фармакологічних і токсикологічних досліджень на щурах протягом 12 тижнів, дослідження біоеквівалентності комбінації щодо її складових включають необхідність демонстрації того, що комбінація трьох препаратів дозволяє домогтися більш вираженого зниження артеріального тиску, ніж комбінація будь–яких двох складових. Підставою для схвалення є зниження АТ > 3 мм рт.ст. порівняно з ефектами всіх можливих подвійних комбінацій у максимальних дозах [18]. Схвалення комбінації амлодипіну/валсартану/гідрохлортіазиду базувалося на результатах проспективного рандомізованого подвійного сліпого дослідження [19], у якому оцінювалася ефективність і безпека щоденного одноразового прийому потрійної комбінації порівняно з трьома варіантами двокомпонентної терапії (амлодипін/валсартан, валсартан/гідрохлортіазид або амлодипін/гідрохлортіазид).
До кінця дослідження в групі потрійної терапії зниження АТ перевищувало подвійні комбінації більше ніж на 6 мм рт.ст. для систолічного АТ (САТ) і 3 мм рт.ст. — для діастолічного АТ (ДАТ). Рівень АТ у групі потрійної терапії «валсартан 320 мг/ам– лодипін 10 мг/гідрохлортіазид 25 мг» становив 130,1/81,8 мм рт.ст., у групі «валсартан 320 мг/амлодипін 10 мг» — 136,4/85,2 мм рт.ст., у групі «валсартан 320 мг/гідрохлортіазид 25 мг» — 137,8/86,8 мм рт.ст., «амлодипін 10 мг/гідрохлортіазид 25 мг» — 138,8/87,4 мм рт.ст.
Частка пацієнтів, які досягли цільового АТ < 140/90 мм рт.ст., була значно вищою в групі потрійної терапії (70,8 vs 48,3 % — у групі валсартану/ГХТ, 54,1 % — у групі амлодипіну/валсартану і 44,8 % — у групі амлодипіну/ГХТ, р < 0,0001 для всіх груп порівняння) [19]. Частота побічних ефектів (ПЕ) істотно не відрізнялася між групами. Периферичні набряки (найбільш частий ПЕ в групі потрійної терапії) у групі потрійної терапії виникали значно рідше, ніж у групі подвійної терапії із застосуванням АК (4,5 і 8,7 % випадків відповідно). Отже, вже після 1 тижня використання потрійної комбінації «валсартан 160 мг/амлодипін 5 мг/гідро–
хлортіазид 12,5 мг» було виявлено клінічно й статистично значуще більш виражене зниження артеріального тиску порівняно з подвійними комбінаціями. Більше того, уже на цьому етапі було досягнуто зниження артеріального тиску < 140/90 мм рт.ст. Ранній ефект потрійної комбінації був виявлений як у загальній популяції дослідження, так і в підгрупі з тяжкою систолічною АГ.
В іншому дослідженні [21] вивчалася ефективність потрійної комбінації амлодипіну/валсартану/ГХТ у пацієнтів, які не досягли контролю АТ на тлі двокомпонентної терапії валсартаном 320 мг/ГХТ 25 мг або амлодипіном 10 мг/ГХТ 25 мг. У цьому 8–тижневому подвійному сліпому багатоцентровому дослідженні з паралельними групами пацієнтам спочатку призначалася комбінація амлодипіну/валсартану/ГХТ 5–10/160–320/25 мг, а в разі недосягнення цільового АТ через 4 тижні доза збільшувалася до 10/320/25 мг. На 8–му тижні 67 % досягли АТ < 140/90 мм рт.ст. І на 4–му, і на 8–му тижні відзначалося зниження середнього САТ і ДАТ на 8,1/7,4 і 10,4/9 мм рт.ст. відповідно.
У групі валсартану/ГХТ після додавання амлодипіну не відзначалася поява периферичних набряків. Отже, потрійна комбінація амлодипіну/валсартану/ГХТ може бути ефективною й безпечною альтернативою для лікування АГ у пацієнтів, які не досягли цільового АТ на тлі прийому подвійної комбінації [21]. Потрійна комбінація в цілому добре переносилася.
Метою даного дослідження було оцінити терапевтичну ефективність генеричного комбінованого препарату Комбісарт Н (фіксована потрійна комбінація валсартану/амлодипіну/гідрохлортіазиду виробництва АТ «Київський вітамінний завод») порівняно з препаратом Комбісарт (подвійна фіксована комбінація валсартану/амлодипіну виробництва АТ «Київський вітамінний завод») у лікуванні пацієнтів з артеріальною гіпертензією ІІ–ІІІ ступеня.
Матеріали та методи
Завдання дослідження: вивчити терапевтичну ефективність фіксованої потрійної й подвійної комбінації в лікуванні артеріальної гіпертензії; вивчити переносимість і можливі побічні реакції препаратів, що входять до складу комбінацій, які досліджувались.
У дослідження були включені 50 пацієнтів з АГ ІІ–ІІІ ступеня за класифікацією ВООЗ, які проходили стаціонарне або амбулаторне лікування у відділенні симптоматичних гіпертензій ДУ «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України».
Критерії включення в дослідження:
— вік 25–75 років;
— есенціальна АГ ІІ стадії, рівень САТ і/або ДАТ ≥ 160/100 мм рт.ст. у кінці періоду відміни усіх антигіпертензивних препаратів;
— відсутність критеріїв виключення;
— підписання пацієнтом інформованої згоди на участь у дослідженні;
— можливості пацієнта до адекватного співробітництва.
Критерії виключення:
— рівень АТ > 220/140 мм рт.ст.;
— вторинна й злоякісна АГ;
— наявність цукрового діабету;
— наявність в анамнезі таких ускладнень, як інфаркт міокарда, інвазивні й неінвазивні втручання на серці, порушення мозкового кровообігу; порушення серцевого ритму (постійна форма фібриляції передсердь, часта шлуночкова або суправентрикулярна екстрасистолія, атріовентрикулярна блокада ІІ і ІІІ ступеня, синдром слабкості синусового вузла); серцева недостатність ІІІ–IV функціонального класу (NYHA); стенокардія напруження ІІІ–IV функціонального класу; тромбоемболія легеневої артерії;
— анафілактичні реакції в анамнезі;
— ретинопатія ІІІ і IV стадії;
— виражена хронічна ниркова недостатність (швидкість клубочкової фільтрації (ШКФ) < 45 мл/хв, анурія);
— стеноз ниркових артерій;
— стенози мітрального й аортального клапанів;
— кардіоміопатії;
— декомпенсовані ураження печінки;
— порушення кровотворення;
— подагра;
— психічні розлади;
— онкологічні захворювання;
— вагітність або лактація;
— підвищена чутливість до компонентів терапії в анамнезі;
— анемії;
— інфекційні захворювання;
— відсутність контактної інформації;
— необхідність призначати інші антигіпертензивні або антиангінальні препарати;
— епізоди гіпотензії;
— клінічно значущі відхилення лабораторних показників, у тому числі вихід за межі норми рівнів калію, натрію, сечової кислоти й кальцію сироватки крові;
— пацієнти, які беруть участь в інших клінічних дослідженнях.
Умовами припинення дослідження були: індивідуальна непереносимість препарату, поява тяжких або неочікуваних побічних реакцій, які потребують, на думку дослідника або пацієнта, відміни, значне погіршення загального стану в період дослідження, порушення пацієнтом протоколу дослідження, зміни лабораторних показників, які свідчать про потенційну загрозу для пацієнта, відкликання пацієнтом інформованої згоди.
Дане клінічне дослідження проводили згідно із Законом України «Про клінічні засоби» й відповідно до етичних принципів, що викладені в Гельсінській декларації, а також згідно з «Інструкцією з проведення клінічних досліджень та експертизи матеріалів при клінічних дослідженнях», що затверджена наказом МОЗ України від 01.11.2000.
Згідно з протоколом, усім пацієнтами були проведені такі дослідження: збір анамнезу, вимірювання маси тіла й зросту, об’єктивне обстеження, вимірювання офісного САТ і ДАТ, частоти серцевих скорочень (ЧСС), біохімічне дослідження крові, загальноклінічне дослідження крові й сечі, тест на вагітність для жінок фертильного віку, електрокардіографія (ЕКГ), ехокардіографічне обстеження (ЕхоКГ), добове моніторування АТ (ДМАТ) з вимірюванням центрального АТ (ЦАТ), визначення жорсткості судинної стінки за допомогою вимірювання CAVI, опитувальник еректильної дисфункції в чоловіків, опитувальник якості життя EQ–5D, опитувальник прихильності до лікування Моріскі — Гріна, реєстрація побічних явищ, контроль за виконанням режиму прийому препаратів (табл. 1).
Усім пацієнтам проводилося визначення росту й маси тіла, розраховувався індекс маси тіла (ІМТ = вага (кг)/зріст (м2)). Діагноз надлишкової маси тіла або ожиріння встановлювали відповідно до критеріїв ВООЗ (1997): надлишкову масу тіла встановлювали при значенні ІМТ від 25 до 29,9 кг/м2,
ожиріння I ступеня — ІМТ від 30 до 34,9 кг/м2, ожиріння II ступеня — ІМТ від 35 до 39,9 кг/м2, ожиріння III ступеня — ІМТ ≥ 40,0 кг/м2;
Вимірювання АТ проводили на апараті Omron M10 (Японія) вранці між восьмою та десятою годинами на всіх етапах дослідження. Реєстрацію САТ і ДАТ у положенні сидячи проводили на одній і тій же руці два рази з інтервалом у дві хвилини, якщо величини АТ не різнилися більше ніж на 5 мм рт.ст. При виявленні більшої різниці між отриманими величинами проводили третє вимірювання й обчислювали середнє значення з двох або трьох послідовних вимірювань. ЧСС визначали після другого вимірювання.
Реєстрацію електрокардіограми до та в кінці лікування проводили на шестиканальному самописці «Юнікард» (Україна).
Показники гемодинамiки й скорочувальної здатності мiокарда лівого шлуночка (ЛШ) серця оцінювали за допомогою ехокардiографiї на апараті Sonоlinе SL–1 (Siemens, Німеччина). Ультразвукове дослідження серця виконували в М– і В–режимi стандартним способом. Визначали розмір лівого передсердя, кінцево–діастолічний розмір (КДР) і кінцево–систолічний розмір ЛШ. Масу міокарда ЛШ серця (ММЛШ) вираховували за методикою Penn Convention [29]:
ММЛШ = 1,06 × ((КДР + ТЗС + ТМШП)3 – КДР3) – 13,6,
де ММЛШ — маса міокарда лівого шлуночка; г;
КДР — кінцево–діастолічний розмір, см; ТЗС — товщина задньої стінки лівого шлуночка, см; ТМШП — товщина міжшлуночкової перегородки лівого шлуночка, см; 1,06 — коефіцієнт розрахунковий; 13,6 — коефіцієнт розрахун–
ковий.
Площу поверхні тіла вираховували за стандартними таблицями за формулою Du Bois [13]. Індекс ММЛШ вираховували за формулою:
де індекс ММЛШ — індекс маси міокарда лівого шлуночка, г/м2; ММЛШ — маса міокарда лівого шлуночка, г.
Відносна товщина стінки (ВТС) ЛШ вираховувалася за формулою:
де КДР — кінцево–діастолічний розмір ЛШ, см; ТЗС — товщина задньої стінки лівого шлуночка, см.
Об’єми ЛШ, такi як кiнцево–дiастолiчний об’єм і кiнцево–систолiчний об’єм, обчислювали, використовуючи формулу Teйхольца. Розраховували також фракцію викиду ЛШ у відсотках.
ДМАТ виконували на портативному апараті АВРМ–04 (Meditech, Угорщина) або MobiloGraph (IOM, Німеччина) на початку й у кінці періоду лікування. При цьому вивчали такі показники: середньодобовий (24), денний (д), нічний (н) і максимальний (макс) систолічний АТ, середньодобовий, денний, нічний і максимальний діастолічний АТ, ЧСС, добовий центральний артеріальний тиск. Також визначали індекс варіабельності. Крім того, за допомогою програмного забезпечення апарата вираховували добовий індекс — відсоток зниження нічного АТ порівняно з денним. Моніторування проводилось у такому режимі: у денний час — кожні 15 хвилин, уночі (з 22:00 до 6:00) — кожні 30 хвилин. Хворим був рекомендований звичайний спосіб життя, з побутовими фізичними й психоемоційними навантаженнями.
Оцінювали якість життя в динаміці за показниками опитувальника якості життя EQ–5D, де визначались «рухливість», «догляд за собою», «звичайна щоденна діяльність (робота, навчання, робота по дому)», «біль (дискомфорт)», «тривога (депресія)» та оцінка стану здоров’я на сьогодні у відсотках.
Ми оцінювали вплив терапії на показники еректильної функції в чоловіків за допомогою анкети МІЕД (Міжнародний індекс еректильної дисфункції).
Жорсткість судинної стінки вимірювалось за допомогою приладу САVI (VaSera 1500, Fukuda Denshi, Японія), манжети накладалися на обидві руки й ноги в положенні лежачи, одночасно відбувалося вимірювання жорсткості судинної стінки.
Біохімічні аналізи виконувалися на автоматичному біохімічному аналізаторі А–25 (Франція) у ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України» до та в кінці дослідження. Визначали рівень креатиніну, електролітів (калію й натрію), глюкози, загального холестерину, тригліцеридів, холестерину ліпопротеїдів високої щільності, холестерину ліпопротеїдів низької щільності, холестерину ліпопротеїдів дуже низької щільності сироватки крові. Кліренс креатиніну, що відображає ШКФ, визначали розрахунково за формулою CKD–EPI. Оцінка ефективності лікування проводилась на основі динаміки АТ (офісного й добового), а також суб’єктивних скарг хворого. Головними критеріями ефективності були: зниження офісного САТ не менше ніж на 20 мм рт.ст. і ДАТ — не менше ніж на 10 мм рт.ст. або досягнення цільового рівня САТ/ДАТ (менше від 140/90 мм рт.ст.). Вторинними критеріями ефективності були: зниження середніх значень САТ і ДАТ за 24 години, у період сну й у денний період, зниження центрального АТ за даними добового моніторування, зміни жорсткості судинної стінки за даними CAVI, динаміка прихильності до лікування, динаміка показників опитувальників якості життя й еректильної дисфункції в чоловіків.
Усі дослідження проводились після 7–денної відміни антигіпертензивних препаратів, які пацієнт отримував до включення у дослідження, і через 3 місяці лікування. Контроль офісного АТ і реєстрація побічних явищ проводилися на кожному етапі обстеження.
До початку дослідження всім пацієнтам була відмінена на 7 днів антигіпертензивна терапія, після чого проведені лабораторно–інструментальні дослідження. При підвищенні АТ в період відміни медична допомога надавалася пацієнту згідно з пунктом 16 Наказу № 24 від 17.01.2005 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Медицина невідкладних станів».
Пацієнти були поділені на 2 групи методом конвертів по 25 у кожній. Першій групі (n = 25) було призначено препарат Комбісарт Н, фіксована потрійна комбінація, таблетки виробництва АТ «Київський вітамінний завод». Препарат призначався по 1 таблетці (160 мг валсартану/5 мг амлодипіну/
12,5 мг гідрохлортіазиду) один раз на добу, вранці, протягом 1 місяця. Препарат пацієнт мав приймати в один і той же час. Таблетки приймалися цілими з невеликою кількістю рідини під час або одразу після прийому їжі.
Пацієнти другої групи (n = 25) отримували за аналогічною схемою препарату Комбісарт, подвійну фіксовану комбінацію, виробництва АТ «Київ–
ський вітамінний завод». Препарат призначався по 1 таблетці (160 мг валсартану/5 мг амлодипіну) один раз на добу, вранці, протягом 1 місяця. Препарат пацієнт мав приймати в один і той же час. Таблетки приймалися цілими з невеликою кількістю рідини під час або одразу після прийому їжі.
Якщо через 1 місяць терапії був досягнутий цільовий рівень офісного АТ, то пацієнти продовжували приймати призначену терапію в попередній дозі. Якщо через 1 місяць лікування не було досягнення цільового рівня офісного АТ < 140/90 мм рт.ст., пацієнтам першої групи призначалася таблетка Комбісарт Н у дозі 160 мг валсартану/10 мг амлодипіну/12,5 мг гідрохлортіазиду ще на 1 місяць. Пацієнтам другої групи призначалася 1 таблетка Комбісарт у дозі 160 мг валсартану/10 мг амлодипіну ще на 1 місяць.
Якщо через 2 місяці терапії був досягнутий цільовий рівень офісного АТ, то пацієнти продовжували приймати призначену терапію в попередній дозі. Якщо через 2 місяці лікування не було досягнення цільового рівня офісного АТ < 140/90 мм рт.ст., пацієнтам першої групи призначалася додатково таблетка Комбісарт (160 мг валсартану/5 мг амлоди–піну) на вечірній прийом ще на 1 місяць. Пацієнтам другої групи призначалася додатково таблетка Комбісарт Н у дозі 160 мг валсартану/10 мг амлодипіну/12,5 мг гідрохлортіазиду на 1 місяць.
Через 3 місяці лікування відбувався контроль терапії.
Під час дослідження не дозволявся прийом інших антигіпертензивних препаратів, великої кількості рідини, нестероїдних і стероїдних протизапальних препаратів, симпатоміметичних препаратів. Дозволяється приймати ацетилсаліцилову кислоту й статини за показаннями на розсуд лікаря.
При кожному візиті проводився контроль прийому ліків, підраховували кількість прийнятих пацієнтом таблеток і кількість днів, що минули від попереднього візиту. Якщо коефіцієнт прихильності до лікування (кількість випитих таблеток/кількість днів прийому) був менше від 0,75, пацієнт виключався з дослідження.
Статистична обробка
Статистичну обробку результатів було проведено після створення баз даних у системах Microsoft Excel. Середні показники обстежених пацієнтів були визначені за допомогою пакета аналізу в системі Microsoft Excel. Усі інші статистичні розрахунки були проведені за допомогою програми SPSS 21.0. Нормальність рядів визначалася за допомогою критерію Шапіро — Уїлка. При нормальному розподілі достовірність різниці середніх на етапах лікування визначалася за допомогою парного двовибіркового тесту, достовірність різниці між групами — за допомогою незалежного t–тесту для середніх після визначення характеру розподілу показників. Ефективність у групах і різниця в групах за розподілом наявності тієї або іншої ознаки оцінювалася за дихометричною змінною за допомогою критерію χ2.
Результати
У дослідження були включені 50 пацієнтів із помірною й тяжкою АГ. Середній вік хворих становив 54,9 ± 1,8 (25–75) року. Середня маса тіла становила 92,4 ± 2,6 кг. Середній ІМТ — 31,2 ± 0,7 кг/м2. Середні цифри офісного САТ і ДАТ на початку дослідження становили 161,7 ± 1,8 мм рт.ст. і 98,5 ± 1,4 мм рт.ст. відповідно. Середня офісна ЧСС — 70,7 ± 1,4 уд/хв. Середні рівні АТ при амбулаторному моніторуванні становили для САТ 143,8 ± 1,1 мм рт.ст., для ДАТ — 92,4 ± 1,2 мм рт.ст. Середня добова ЧСС — 71,5 ± 1,5 уд/хв. Основні клініко–демографічні показники пацієнтів обох груп подані в табл. 2. Тільки 5 (10 %) пацієнтів мали нормальну масу тіла, 17 (34 %) пацієнтів мали надлишкову вагу, 33 (56 %) пацієнти мали ожиріння різного ступеня тяжкості, 19 (38 %) пацієнтів мали ожиріння I ступеня, 6 (12 %) пацієнтів — ожиріння II ступеня, 3 пацієнти (6 %) мали ожиріння III ступеня. Тобто серед наших пацієнтів із помірною й тяжкою гіпертензією, які потребували прийому подвійної й потрійної комбінації, переважали пацієнти з надмірною масою тіла й ожирінням (табл. 2).
На початку дослідження 25 пацієнтів (50 %) прий–мали подвійну терапію — Комбісарт 5/160 мг 1 раз на добу; 25 пацієнтів (50 %) приймали потрійну комбінацію — Комбісарт Н у дозі 5/160/12,5 мг 1 раз на добу. У групі подвійної терапії 8 пацієнтів (32 %) потребували титрації дози, а 68 % пацієнтів залишилися на початковій подвійній комбінації. У трьох пацієнтів із групи подвійної комбінації виникли побічні ефекти, що потребували відміни препарату: в 1 пацієнта виник набряк Квінке після прийому першої дози препарату, що було обумовлено реакцією на амлодипін, в 1 пацієнта виникла тахікардія, через що він відмовився від прийому препарату, ще в 1 пацієнта виникло різке зниження артеріального тиску, через що він також відмовився від прийому препарату. У групі потрійної терапії 15 пацієнтів (60 %) потребували титрації дози, а 40 % пацієнтів залишилися на початковій потрійній комбінації. У 4 пацієнтів із групи потрійної комбінації виникли побічні ефекти, що потребували відміни препарату: у 2 пацієнтів виникли набряки гомілок, що потребувало відміни препарату, у 2 пацієнтів виникла тахікардія, через що вони відмовилися від прийому препарату. Отже, 46 % пацієнтів у нашому дослідженні потребували титрації початкової дози препарату. Відміна препарату спостерігалась у 7 пацієнтів (14 %), що було пов’язано з виникненням побічних ефектів на амлодипін.
На фоні терапії подвійною й потрійною комбінацією валсартану/амлодипіну/гідрохлортіазиду в загальній групі зниження офісного САТ/ДАТ на етапах 1, 2 і 3 місяці становило 16,7/14,9 мм рт.ст.; 33,9/19,5 мм рт.ст.; 35,6/22,5 мм рт.ст. відповідно (р < 0,05) для всіх значень. Зміни офісної ЧСС були недостовірні — 70,7 уд/хв на початку дослідження й 65,4 уд/хв у кінці дослідження.
Ми проаналізували динаміку офісного САТ окремо в пацієнтів, які приймали подвійну комбінацію валсартану/амлодипіну, і тих, які приймали потрійну комбінацію валсартану/амлодипіну/гідрохлортіазиду. На фоні терапії валсартаном/амлодипіном зниження офісного САТ на етапах 1, 2 і 3 місяці становило 19, 34 і 35 мм рт.ст. відповідно (р < 0,05) для всіх значень. Аналогічні, але більш виражені зміни спостерігались на фоні потрійної комбінованої терапії валсартаном/амлодипіном/гідрохлортіазидом. Так, зниження офісного САТ на етапах 1, 2 і 3 місяці становило 15, 34 і 42 мм рт.ст. відповідно (р < 0,05) для всіх значень. Різниця через 3 місяці становила 7 мм рт.ст. між групами в кінці періоду лікування.
На фоні терапії подвійною й потрійною комбінацією валсартану/амлодипіну/гідрохлортіазиду в загальній групі зниження АТ при добовому моніторуванні САТ/ДАТ через 3 місяці терапії становило 20,0/18,6 мм рт.ст. (р < 0,05). Зміни добової ЧСС були недостовірні — 71,5 уд/хв на початку дослідження й 68,3 уд/хв у кінці дослідження.
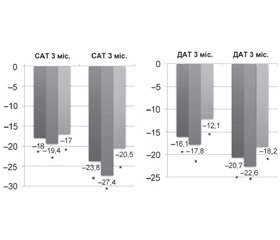
При аналізі динаміки АТ при добовому моніторуванні в пацієнтів, які приймали подвійну комбінацію валсартану/амлодипіну порівняно з потрійною комбінацією валсартану/амлодипіну/гідрохлортіазиду, ми виявили достовірне значне зниження 24САТ/ДАТ на фоні терапії валсартаном/амлодипіном — 18,0/16,1 мм рт.ст. (р < 0,05), за денний і нічний періоди — 19,4/17,8 мм рт.ст. і 17,0/12,1 мм рт.ст. відповідно (р < 0,05) для всіх значень. Аналогічні, але більш виражені зміни спостерігались на фоні потрійної комбінованої терапії комбінацією валсартану/амлодипіну/гідрохлортіазиду. Так, зниження 24САТ/ДАТ через 3 місяці терапії становило 23,8/20,7 мм рт.ст., а зниження АТ за денний і нічний періоди — 27,4/22,6 мм рт.ст. і 20,5/18,2 мм рт.ст. відповідно (р < 0,05) для всіх значень. Різниця через 3 місяці становила 5,6/4,6 мм рт.ст., 8/4,8 мм рт.ст. і 3,5/6,1 мм рт.ст. відповідно за весь період, денний і нічний період між групами в кінці періоду лікування. Зміни ЧСС при ДМАТ були недостовірними. Дані наведені на рис. 2 і 3.
Досягнення цільового рівня офісного АТ у кінці періоду спостереження в цілому по групі спостерігалось у 93,3 % пацієнтів: у групі подвійної терапії — 90,9 %, у групі потрійної комбінації — 95,7 % пацієнтів.
Досягнення цільового рівня АТ при добовому моніторуванні становило в цілому по групі 86 %. У групі подвійної терапії валсартном/амлодипіном досягнення цільового АТ при ДМАТ становило 77,3 %, у групі потрійної комбінації валсартном/амлодипіном/гідрохлортіазидом — 95,2 % (рис. 4). Отже, потрійна фіксована комбінація була більш ефективною в зниженні АТ при офісному вимірюванні й добовому моніторуванні через 3 місяці лікування.
Обговорення
Дане дослідження показало, що при прийомі подвійної (на основі валсартану й амлодипіну) або потрійної (на основі валсартану, амлодипіну й гідрохлортіазиду) фіксованої комбінованої терапії відбувалося значне достовірне зниження артеріального тиску при добовому моніторуванні в пацієнтів із помірною й тяжкою артеріальною гіпертензією. Зниження 24САТ/ДАТ у цілому по групі становило 20,0/18,6 мм рт.ст. (р < 0,05) і 24,8/21,0 мм рт.ст. (p < 0,05) за денний період і 18,4/17,7 мм рт.ст. (p < 0,05) — за нічний період. На подвійній фіксованій комбінації (валсартан/амлодипін — препарат Кобмісарт) зниження 24САТ/ДАТ становило 18,0/16,1 мм рт.ст. (р < 0,05); 19,4/17,8 мм рт.ст. (p < 0,05) — за денний період і 17,0/12,1 мм рт.ст. (p < 0,05) — за нічний період. На потрійній фіксованій комбінації (валсартан/амлодипін/гідрохлортіазид — препарат Комбісарт Н) зниження 24САТ/ДАТ становило 23,8/20,7 мм рт.ст. (р < 0,05), 17,8/22,6 мм рт.ст. (p < 0,05) — за денний період і 20,5/18,2 мм рт.ст. (p < 0,05) — за нічний період.
86 % усіх досліджуваних пацієнтів у цілому на терапії Комбісартом і Комбісартом Н досягли цільового рівня АТ при ДМАТ. На подвійній фіксованій комбінації Комбісартом (валсартан/амлодипін) досягнення цільового рівня АТ при ДМАТ становило 77,3 %, причому в групі Комбісарту Н (валсартан/амлодипін/гідрохлортіазид) кількість таких пацієнтів була ще більшою — 95,2 %.
Сартани з’явилися першими з усіх класів антигіпертензивних препаратів, які були рекомендовані для терапії пацієнтів з АГ із супутньою гіпертрофією лівого шлуночка (ГЛШ) (рекомендації Європейського товариства з артеріальної гіпертензії 2004, 2007, 2013, 2018 року). Цьому сприяли результати великого метааналізу щодо порівняння ефективності основних класів гіпотензивних засобів за впливом на регрес ГЛШ із включенням 3767 пацієнтів [10]. Результати показали, що клас антагоністів рецепторів ангіотензину II забезпечує максимальне зменшення індексу маси міокарда лівого шлуночка (ΔІММЛШ –13 %), перевершуючи всі інші класи антигіпертензивних препаратів. Механізм дії сартанів на регрес ГЛШ пов’язаний з їх гемодинамічними, антипроліферативними й антифібротичними ефектами, у результаті вони зменшують ремоделювання серця.
Іншим проявом кардіопротективної дії сартанів є їх ефект щодо запобігання фібриляції передсердь у пацієнтів з АГ і хронічною серцевою недостатністю (ХСН), що несприятливо впливає на прогноз і збільшує ризик серцево–судинних захворювань, таких як інсульт та інші тромбоемболії, і ризик смерті в 2–5 разів. В основі даного ефекту лежить блокада ренін–ангіотензин–альдостеронової системи (РААС), що дозволяє запобігати ремоделюванню серця. Причому ефект сартанів щодо профілактики фібриляції передсердь безпосередньо не пов’язаний із гіпотензивною дією, а є результатом безпосереднього впливу на структуру й електричну стабільність міокарда як через блокаду АТ і рецепторів, так і через модифікацію гуморальних, механічних та інших патологічних стимулів. У метааналізі J.S. Healey і співавт. (2005), у який було включено 4 клінічні дослідження із застосуванням сартанів, відносний ризик (ВР) розвитку фібриляції передсердь знижувався на 29 % (р = 0,0002).
У кількох дослідженнях була доведена роль валсартану в первинній профілактиці фібриляції передсердь. Так, у дослідженні VALUE в групі пацієнтів, які отримували терапію валсартаном, було відзначено достовірне зниження ризику розвитку нових випадків фібриляції передсердь у пацієнтів з АГ
(ВР = 0,84, р = 0,011), а в дослідженні Val–HeFT — у пацієнтів із ХСН (ВР = 0,63, р = 0,0002). В іншому дослідженні в 369 пацієнтів із АГ, які мали в анамнезі епізоди фібриляції передсердь, валсартан показав ефективність у зниженні частоти нових епізодів фібриляції передсердь нарівні з раміприлом [19].
Результати декількох невеликих клінічних досліджень із вивчення впливу валсартану на функцію нирок показали, що препарат не чинить негативного впливу на рівень креатиніну крові та ШКФ як у хворих з АГ і хронічною нирковою недостатністю, так і в пацієнтів із ЦД 2–го типу й діабетичною нефропатією. Крім того, у пацієнтів із тяжкою хронічною нирковою недостатністю, які перебували на амбулаторному перитонеальному гемодіалізі, валсартан гальмував подальше прогресування ниркової недостатності й підтримував резидуальну ниркову функцію.
В основі нефропротекторного ефекту валсартану лежить протизапальна (достовірне зниження С–реактивного протеїну) і антипроліферативна дія на нирковий фільтр, зменшення його проникності для білків (МАУ і β–мікроглобулінурії), а також зниження резистивності ниркових артерій.
Сартани показали ефективність у лікуванні нейродегенеративних захворювань і посттравматичних ушкоджень мозку [27]. БРА II можуть покращувати стан тривоги і депресії, що також регулюються РААС мозку, переважно через АТ2–рецептори.
Плейотропний церебропротекторний ефект БРА II був доведений у великому когортному дослідженні щодо запобігання деменції й хворобі Альцгеймера [20]. У ньому протягом 4 років спостереження
819 491 хворого з АГ та іншими серцево–судинними захворюваннями віком понад 65 років сартани показали найменший ризик розвитку випадків деменції (ВР = 0,76) і хвороби Альцгеймера (ВР = 0,84) порівняно з іншими антигіпертензивними препаратами. Причому ефект валсартану на залежав від дози препарату на відміну від інших сартанів. Вивчення можливих механізмів нейропротекції при деменції показало можливий вплив БРА II на β–амілоїдний протеїн, накопичення якого в тканинах мозку асоціюється з розвитком когнітивних порушень.
Так, у дослідженнях in vitro було встановлено, що валсартан зменшує вміст β–амілоїдного протеїну в тканинах мозку і його проникнення в клітини мозку, до того ж цей ефект не був пов’язаний із його гіпотензивною дією; у дослідженнях in vivo валсартан запобігав розвитку нейропатії типу Альцгеймера і амілоїдзалежного дефіциту пам’яті, причому в дозах, удвічі менших від середніх терапевтичних [16].
У двох великих клінічних дослідженнях (VALUE, NAVIGATOR) було встановлено, що застосування валсартану знижує частоту нових випадків цукрового діабету в групі пацієнтів з АГ (13,1 проти 16,4 % у контролі, ВР = 0,77) і пацієнтів із порушеною толерантністю до глюкози (33,1 проти 36,8 % у контролі, ВР = 0,86) [11, 18]. Цей ефект БРА II пов’язаний із впливом на функцію жирової тканини й гомеостаз глюкози, у регуляції яких бере участь РААС. АТ II порушує диференціювання преадипоцитів у зрілі адипоцити й призводить до гіпертрофії жирової тканини з появою великих інсулінорезистентних адипоцитів, що в результаті призводить до накопичення жирів замість їх утилізації адипоцитами, активації неоглікогенезу й інсулінорезистентності. Блокування РААС сприяє утворенню адипоцитів і перерозподілу жирів із периферійних тканин, підвищуючи чутливість до інсуліну. Крім того, гемодинамічний ефект сартанів покращує кровопостачання підшлункової залози й функціонування β–клітин.
Важливе значення серед метаболічних ефектів антигіпертензивних препаратів має обмін сечової кислоти, оскільки гіперурикемія асоціюється з АГ і є фактором ризику серцево–судинних захворювань. Так, підвищення рівня сечової кислоти в крові на 1 мг/дл можна порівняти за значимістю з підвищенням артеріального тиску на 10 мм рт.ст. Відомо, що лозартан має виражену урикозуричну дію. Вивчення ефектів валсартану на обмін сечової кислоти показало відсутність впливу на ниркову екскрецію сечової кислоти й рівень урикемії як у здорових добровольців, так і в пацієнтів з АГ [15–17]. Нові дані з вивчення механізмів впливу сартанів на обмін сечової кислоти були отримані в дослідженні з її транспортерами: валсартан і олмесартан показали здатність пригнічувати активність аніонного транспортера ОАТ3, що бере участь у канальцевій секреції сечової кислоти, а лозартан, телмісартан і кандесартан — здатність пригнічувати захват сечової кислоти через MRP4, причому лозартан це робить у найменших концентраціях.
У рандомізованому проспективному відкритому дослідженні VALISH (Valsartan in Elderly Isolated Systolic Hypertension; n = 3260, середній термін спостереження 3,07 року) було показано, що в літніх пацієнтів (вік 70–84 роки, середній вік 76,1 року) з ізольованою систолічною артеріальною гіпертензією валсартан у добовій дозі 40–80 мг у монотерапії або в поєднанні з іншими гіпотензивними засобами (антагоністи кальцію, діуретики) дозволяє забезпечити ефективний і досить безпечний контроль АТ [13, 14]. За даними W.C. Cushman і співавт., у літніх пацієнтів з ізольованою систолічною артеріальною гіпертензією комбінація валсартану з гідрохлортіазидом забезпечує кращий контроль артеріального тиску, ніж кожен компонент окремо [12].
Аналогічні результати були отримані в рандомізованому подвійному сліпому дослідженні ValVET. Встановлено, що в літніх пацієнтів із систолічною артеріальною гіпертензією комбінація валсартану з гідрохлортіазидом (160/12,5 мг) більш ефективно знижує артеріальний тиск через 4 тижні терапії, ніж застосування кожного з компонентів у вигляді монотерапії [25].
Ефективність фіксованої подвійної комбінації валсартану/амлодипіну була широко вивчена в багатьох рандомізваних дослідженнях. Так, було проведено 13 великих досліджень, які включали понад 60 тис. пацієнтів у 26 країнах світу [2, 3]. Ефективність потрійної фіксованої комбінації валсартану/амлодипіну/гідрохлортіазиду в одній таблетці була доведена в 5 великих рандомізованих дослідженнях, що включали 1500 пацієнтів, у тому числі пацієнтів похилого віку, з ожирінням, ЦД і різною етнічною приналежністю. Було також проведено 2 великих дослідження (EXCITE та SIMPLIFY) фіксованої комбінації валсартану/амлодипіну/гідрохлортіазиду в одній таблетці у 14 країнах світу на 8000 пацієнтів [8, 9, 10, 20–22, 28].
У дослідженні MARVAL проводили порівняння ефективності валсартану й антагоніста кальцію амлодипіну протягом 24 тижнів [6, 7]. Було показано, що лікування валсартаном призводило до істотного зниження протеїнурії (до 56 % від початкового рівня), у той час як терапія амлодипіном практично не впливала на цей показник, незважаючи на однаковий рівень зниження АТ в обох групах. У хворих, які приймали валсартан, у 2 рази частіше спостерігався регрес нефропатії до стадії нормоальбумінурії, ніж у групі амлодипіну.
Метою дослідження Kyoto Heart Study було визначити вплив валсартану, який додавався до традиційної терапії пацієнтів з АГ високого ризику, на частоту розвитку ускладнень і смерті [34]. Первинна кінцева точка була комбінованою: фатальні або нефатальні кардіоваскулярні події. У дослідження було включено 3031 японського пацієнта (43 % — жінки, середній вік 66 років) з неконтрольованою артеріальною гіпертензією. Вони були рандомізовані приймати або валсартан, або лікування без БРА. Валсартан додавався до вже раніше призначеної терапії.
Середній період спостереження становив 3,27 року. В обох групах вихідне АТ було 157/88 мм рт.ст., а в кінці спостереження — 133/76 мм рт.ст. У групі валсартану частота виникнення первинної кінцевої точки порівняно зі стандартною терапією була достовірно менше (83 проти 155, відношення ризику 0,55; 95% ДІ 0,42–0,72, P = 0,00001). Крім того, спостерігалося достовірне зменшення частоти розвитку інсульту (співвідношення ризику 0,55; P = 0,015) і стенокардії (співвідношення ризику 0,51; P = 0,011), нових випадків цукрового діабету (Р = 0,028). Отже, додавання валсартану сприяло покращанню конт–
ролю АТ і краще запобігало виникненню кардіоваскулярних подій, ніж традиційна терапія, що не може бути пояснено лише відмінностями в контролі артеріального тиску.
Раніше проведене дослідження показало, що вранці й увечері прийом комбінованої терапії валсартану/амлодипіну мав еквівалентну дію при зниженні нічного АТ. Дослідження ACROBAT (найбільш тривале комбіноване лікування БРА і АК при амбулаторному й домашньому моніторуванні АТ) не виявило суттєвих відмінностей у зниженні нічного брахіального артеріального тиску між прийомами вранці та ввечері комбінації БРА/АК [29].
Дослідження EXCITE (клінічний досвід застосування амлодипіну й валсартану при АГ) проводилося в реальній практиці для оцінки ефективності й безпечності подвійної й потрійної комбінації амлодипіну/валсартану та амлодипіну/валсартану/ГХТ в одній таблетці у пацієнтів із АГ в різних країнах, що розвиваються, на Близькому Сході та в Азії (Бахрейн, Єгипет, Кувейт, Ліван, Оман, Катар, Об’єднані Арабські Емірати, Індонезія, Гонконг, Пакистан, Філіппіни, Південна Корея та Тайвань) [33, 35].
У пацієнтів, які були включені в дослідження в Єгипті, середній вік становив 52,60 ± 10,31 року, середня тривалість АГ становила 7,90 ± 7,26 року, початковий рівень офісного САТ/ДАТ — 164,40 ± ± 14,92/100,50 ± 8,63 мм рт.ст. Пацієнти в цьому дослідженні мали такі основні фактори ризику серцево–судинних захворювань: сімейний анамнез АГ (39,5 %), дисліпідемія (39,1 %), цукровий діабет (34,4 %) та ішемічна хвороба серця (13,3 %).
На 13–му тижні зниження офісного АТ становило 28,8/16,1 мм рт.ст. на подвійній фіксованій комбінації амлодипіну/валсартану (початковий АТ 165,2/100,9 мм рт.ст., n = 2041); 26,9/15,5 мм рт.ст. — з амлодипіном/валсартаном 5/160 мг (початковий АТ 162,8/99,9 мм рт.ст., n = 1390) і 32,9/17,4 мм рт.ст. — з амлодипіном/валсартаном 10/160 мг (початковий АТ 170,1/102,9 мм рт.ст., n = 651). У кінці 26–го тижня при прийомі подвійної фіксованої комбінації амлодипіну/валсартану в цілому зниження АТ становило 34,5/19,4 мм рт.ст.
Загалом у 322 (12,5 %) пацієнтів спостерігалися побічні реакції. Найчастішими були периферійні набряки (1,8 %), бронхіт (1,1 %) і гастрит (0,8 %). Частота набряків становила 15,7 % (402 пацієнти) на початку дослідження та 13,3 % (329 пацієнтів) — у кінці дослідження.
Серйозні побічні реакції (СПР) були зафіксовані у 12 пацієнтів (0,5 %). Найчастішими СПР були серцеві розлади в п’яти пацієнтів (0,2 %).
У кінці 26–го тижня частка пацієнтів, які досягли цільового рівня АТ, становила 49,3 %.
У рандомізоване подвійне сліпе мультицентрове дослідження EX–FAST були включені пацієнти з 8 країн світу (Франція, Іспанія, Бельгія, Норвегія, Швейцарія, Словаччина, Канада та Сполучені Штати Америки) з неконтрольованим АТ на фоні монотерапії безпосередньо до початку прийому амлодипіну/валсартану 5/160 мг (n = 443) або 10/160 мг (n = 451). Серед пацієнтів, які отримували амлодипін/валсартан 5/160 мг, 24,8 % отримували додаткове лікування з ГХТ 12,5 мг, з яких 11,5 % необхідно було ГХТ 25 мг. Серед пацієнтів, які отримували амлодипін/валсартан 10/160 мг, 19,1 % потрібно було ГХТ 12,5 мг, з яких 6,4 % отримали ГХТ 25 мг. Через 16 тижнів контроль АТ (< 140/90 мм рт.ст. або < 130/80 мм рт.ст. для пацієнтів із ЦД) було досягнуто в 72,7 % пацієнтів, які отримували амлодипін/валсартан 5/160 мг, і 74,8 % хворих, які приймали амлодипін/валсартан 10/160 мг [1].
Досягнення цільового рівня ДАТ через 16 тижнів спостерігалось у 85,7 % пацієнтів у групі амлодипіну/валсартану 5/160 мг і 87,3 % тих, хто отримував амлодипін/валсартан 10/160 мг. Зниження у середньому офісного АТ було більшим у пацієнтів, які приймали вищу дозу, порівняно з нижчою дозою (20,0 мм рт.ст. порівняно з 17,5 мм рт.ст., P = 0,0003, для САТ і 11,6 проти 10,4 мм рт.ст., P = 0,0046, для ДАТ відповідно). 198 пацієнтів мали резистентну АГ. Зниження САТ у пацієнтів із резистентною АГ становило 23,9 мм рт.ст. для меншої дози і 29,7 мм рт.ст. — для вищої дози на кінець дослідження.
Загалом 113 пацієнтів припинили терапію: 36 із 443 пацієнтів (8,1 %) у групі амлодипіну/валсартану 5/160 мг і 77 із 451 (17,1 %) — у групі амлодипіну/валсартану 10/160 мг. Найпоширенішими причинами припинення були побічні ефекти — 25 пацієнтів (5,6 %), які отримували меншу дозу, і 62 (13,7 %), які лікувалися вищою дозою. Побічні події не були серйозними; найчастіше були периферичні набряки, головний біль, біль у спині, запаморочення й м’язові спазми.
Дані нашого дослідження порівнянні з результатами інших досліджень. Так, Don Poldermans зі співавт. і В. Waeber порівнювали ефективність і пе– реносимість комбінації амлодипіну 5–10 мг із валсартаном 160 мг і комбінації лізиноприлу 10–20 мг із гідрохлортіазидом 12,5 мг у пацієнтів з АГ II стадії (n = 130) протягом 6 тижнів [32, 36, 37]. Зниження офісного САТ/ДАТ у групі амлодипіну/валсартану становило 35,8/28,6 мм рт.ст., у групі лізиноприлу/гідрохлортіазиду — 31,8/27,6 мм рт.ст. Зниження ДАТ < 90 мм рт.ст. становило 79,7 та 77,3 % відповідно по групах. Досягнення цільових рівнів АТ < 140/90 мм рт.ст. становило 67,2 та 56,1 % відповідно в групах амлодипіну/валсартану й лізиноприлу/гідрохлортіазиду. Побічні реакції були зафіксовані в 40,6 % пацієнтів у групі амлодипіну/валсартану й у 31,8 % у групі лізиноприлу/гідрохлортіазиду. Найбільш часто в групі амлодипіну/валсартану зустрічалися головний біль — 10,9 % і периферичні набряки — 7,8 %. У групі лізиноприлу/гідрохлортіазиду частіше спостерігались діарея — 6,1 % і фарингіт — 6,1 %. У жодній групі не було зареєстровано запаморочення або колапсу. Так, периферичні набряки частіше спостерігалися в групі амлодипіну/валсартану порівняно з групою лізиноприлу/гідрохлортіазиду — 7,8 і 1,5 % відповідно, на той час як кашель, навпаки, зустрічався рідше в групі амлодипіну/валсартану (1,6 %) порівняно з групою лізиноприлу/гідрохлортіазиду (3,0 %). Середні цифри АТ у даному дослідженні становили > 170/112 мм рт.ст. Тяжка гіпертензія складно контролюється й потребує багатокомпонентної терапії. У пацієнтів віком понад 65 років переважає ізольована систолічна АГ. Дане дослідження показало переваги комбінації амлодипіну/валсартану в зниженні АТ порівняно з комбінацією лізиноприлу/гідрохлортіазиду в пацієнтів із тяжкою гіпертензією (САТ ≥ 180 мм рт.ст.) і пацієнтів віком понад 65 років. Так, зниження АТ становило 43,0/26,1 мм рт.ст. і 31,2/21,7 мм рт.ст. відповідно по групах, р < 0,002 [4, 5, 30].
Як відомо, прихильність пацієнтів до лікування зі збільшенням компонентів терапії пропорційно зменшується. Застосування фіксованої комбінації покращує прихильність до лікування [27].
В іншому дослідженні P. Trenkwalder зі співавторами вивчали вплив комбінації амлодипіну 10 мг із валсартаном 160 мг на зниження АТ у пацієнтів із неконтрольованою АГ на фоні комбінації раміприлом 5 мг із фелодипіном 5 мг [31]. У цьому 10–тижневому дослідженні на 133 пацієнтах досягнення цільових рівнів АТ (< 140/90 мм рт.ст.) на фоні застосування комбінації «амлодипін 10 мг/валсартан 160 мг» у пацієнтів із помірною АГ було відзначено в 63,8 % пацієнтів. Загальне зниження АТ у дослідженні становило 30,7/14,3 мм рт.ст. У підгрупі пацієнтів віком понад 65 років зниження АТ становило 15,4/8,4 мм рт.ст. на фоні прийому 10 мг амлодипіну й 160 мг валсартану.
У дослідженні EXTRA S. Oparil зі співавт. досліджували протягом 12 тижнів вплив інтенсивного й помірного лікування комбінацією амлодипіну/валсартану (5/320 мг зі збільшенням до 10/320 мг у групі інтенсивного лікування або 5/160 мг) у пацієнтів із неконтрольованою АГ на фоні монотерапії блокаторами рецепторів до АГ II (олмесартан 20 або 40 мг) [27]. Були рандомізовані 728 пацієнтів. При необхідності додавався гідрохлортіазид 12,5–25 мг. Середні цифри офісного АТ на початку дослідження в групі інтенсивного лікування становили 163,9/95,5 мм рт.ст., у групі помірного лікування — 163,3/95,0 мм рт.ст. Інтенсивне лікування достовірно більше знижувало цифри АТ — 29,0/14,8 мм рт.ст. порівняно з групою помірного лікування — 25,3/12,3 мм рт.ст. Побічні реакції спостерігались у 36,3 % випадків і 37,6 % випадків у групах інтенсивного та помірного лікування відповідно. Периферичні набряки були частіше виражені в групі інтенсивного лікування (8,7 % випадків) порівняно з групою помірного лікування (4,5 %) [27]. Більшість периферичних набряків мали м’який характер. Запаморочення й випадки гіпотензії були зареєстровані в 5,1 і 1,1 % випадків у групі інтенсивного лікування відповідно й у 3,9 і 0,8 % випадків у групі помірного лікування відповідно. Побічні реакції, що призвели до передчасного завершення дослідження, спостерігались у 2,4 % пацієнтів у групі інтенсивного лікування й 5,3 % хворих у групі помірного лікування (у 2 пацієнтів у групі інтенсивного лікування — набряки, а в
групі помірного лікування — запаморочення, голов– ний біль, інфаркт міокарда, підвищення АТ та у 2 пацієнтів — периферичні набряки).
У дослідженні Shakil Aslam зі співавт. периферичні набряки на фоні застосування фіксованої комбінації амлодипіну/валсартану виникали значно рідше (5,4 %) порівняно з монотерапією амлодипіном (8,7 %, р < 0,05), однак частіше, ніж на фоні монотерапії валсартаном (2,1 %, р < 0,001) [6].
Calhoun зі співавт. [6, 7] протягом 8 тижнів лікували 2271 пацієнта з помірною гіпертензією потрійною (амлодипін/валсартан/гідрохлортіазид із титруванням дози до 10/320/25 мг) або подвійною терапією (амлодипін/валсартан, амлодипін/ГХТ, валсартан/ГХТ), досягнення цільових рівнів АТ відзначено в 71 % пацієнтів на потрійній терапії і 45–54 % пацієнтів на подвійній терапії.
Наше дослідження продемонструвало високу антигіпертензивну ефективність за даними добового моніторування на фоні прийому генеричного комбінованого препарату Комбісарт Н (фіксована потрійна комбінація валсартану/амлодипіну/гідрохлортіазиду виробництва АТ «Київський вітамінний завод») і Комбісарт (подвійна фіксована комбінація валсартану/амлодипіну виробництва АТ «Київський вітамінний завод») у лікуванні пацієнтів з артеріальною гіпертензією ІІ–ІІІ ступеня.
Висновки
1. Зниження середньодобового АТ у цілому по групі становило 20,0/18,6 мм рт.ст. (р < 0,05); 18,0/16,1 мм рт.ст. (р < 0,05) — на подвійній (Комбісарт) і 23,8/20,7 мм рт.ст. (р < 0,05) — на потрійній (Комбісарт Н) комбінації.
2. Зниження середньоденного АТ у цілому по групі становило 24,8/21,0 мм рт.ст. (р < 0,05); 19,4/17,8 мм рт.ст. (р < 0,05) — на подвійній (Комбісарт) і 17,8/22,6 мм рт.ст. (р < 0,05) — на потрійній (Комбісарт Н) комбінації.
3. Зниження середньонічного АТ у цілому по групі становило 18,4/17,7 мм рт.ст. (р < 0,05); 17,0/12,1 мм рт.ст. (р < 0,05) — на подвійній (Комбісарт) і 20,5/18,2 мм рт.ст. (р < 0,05) — на потрійній (Комбісарт Н) комбінації.
4. Досягнення цільового АТ при добовому моніторуванні загалом по групі становило 86 %. У 77,3% — на подвійній комбінації, у 95,2 % — на потрійній комбінації.
5. Потрійна комбінація Комбісарт Н була більш ефективною в зниженні артеріального тиску при добовому моніторуванні порівняно з подвійною комбінацією Комбісарт, що не супроводжувалось збільшенням побічних ефектів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Allemann Y., Fraile B., Lambert M. et al. Efficacy of the combination of amlodipine and valsartan in patients with hypertension uncontrolled with previous monotherapy: the Exforge in Failure after Single Therapy (EX–FAST) study // J. Clin. Hypertens. (Greenwich). — 2008. — 10. — 185–194.
2. Asmar R., Gosse P., Quere S. et al. Efficacy of morning and evening dosing of amlodipine/valsartan combination in hypertensive patients uncontrolled by 5 mg of amlodipine // Blood Press. Monit. — 2011. — 16. — 80–86.
3. Baser O., Andrews L.M., Wang L., Xie L. Comparison of realworld adherence, healthcare resource utilization and costs for newly initiated valsartan/amlodipine single–pill combination versus angiotensin receptor blocker/calcium channel blocker freecombination therapy // J. Med. Econ. — 2011. — 14. — 576–83.
4. Boggia J., Li Y., Thijs L. et al. Prognostic accuracy of day versus night ambulatory blood pressure: a cohort study // Lancet. — 2007. — 370. — 1219–1229.
5. Boutouyrie P., Achouba A., Trunet P., Laurent S.; EXPLOR Trialist Group. Amlodipine–valsartan combination decreases central systolic blood pressure more effectively than the amlodipine–atenolol combination: the EXPLOR study // Hypertension. — 2010. — 55. — 1314–1322.
6. Calhoun D.A., Crikelair N.A., Yen J., Glazer R.D. Amlodipine/valsartan/hydrochlorothiazide triple combination therapy in moderate/severe hypertension: secondary analyses evaluating efficacy and safety // Adv. Ther. — 2009. — 26. —
1012–23.
7. Calhoun D.A., Lacourciere Y., Crikelair N., Jia Y., Glazer R.D. Effects of demographics on the antihypertensive efficacy of triple therapy with amlodipine, valsartan, and hydrochlorothiazide for moderate to severe hypertension // Curr. Med. Res. Opin. — 2013. — 29. — 901–10.
8. Destro M., Luckow A., Samson M., Kandra A., Brunel P. Efficacy and safety of amlodipine/valsartan compared with amlodipine monotherapy in patients with stage 2 hypertension: a randomized, double–blind, multicenter study: the EX–EFFeCTS Study // J. Am. Soc. Hypertens. — 2008. — 2. — 294–302.
9. Ferdinand K.C., Nasser S.A. A Review of the Efficacy and Tolerability of Combination Amlodipine/Valsartan in Non–White Patients with Hypertension // Am. J. Cardiovasc. Drugs. — 2013. — 13(5). — 301–313. doi: 10.1007/s40256–013– 0033–4.
10. Flack J.M., Calhoun D.A., Satlin L., Barbier M., Hilkert R., Brunel P. Efficacy and safety of initial combination therapy with amlodipine/valsartan compared with amlodipine monotherapy in black patients with stage 2 hypertension: the EX–STAND study // J. Hum. Hypertens. — 2009. — 23. — 479–89
11. Fujiwara T., Hoshide S., Yano Y., Kanegae H., Kario K. Comparison of morning vs bedtime administration of the combination of valsartan/ amlodipine on nocturnal brachial and central blood pressure in patients with hypertension // J. Clin. Hypertens (Greenwich). — 2017. — 19. — 1319–1326.
12. Cushman W.C., Bakris G.L., White W.B. et al. A randomized titrate–to–target study comparing fixed–dose combinations of azilsartan medoxomil and chlorthalidone with olmesartan and hydrochlorothiazide in stage–2 systolic hypertension // J. Hypertens. — 2018 Apr. — 36(4). — 947–956.
13. Hermida R.C., Ayala D.E., Fontao M.J. et al. Chronotherapy with valsartan/amlodipine fixed combination: improved blood pressure control of essential hypertension with bedtime dosing // Chronobiol. Int. — 2010. — 27. — 1287–1303.
14. Hermida R.C., Ayala D.E., Mojon A. et al. Decreasing sleep–time blood pressure determined by ambulatory monitoring reduces cardiovascular risk // J. Am. Coll. Cardiol. — 2011. — 58. — 1165–1173.
15. Hermida R.C., Calvo C., Ayala D.E. et al. Administration time–dependent effects of valsartan on ambulatory blood pressure in hypertensive subjects // Hypertension. — 2003. — 42. — 283–290.
16. Hoshino A., Nakamura T., Matsubara H. The bedtime administration ameliorates blood pressure variability and reduces urinary albumin excretion in amlodipine–olmesartan combination therapy // Clin. Exp. Hypertens. — 2010. — 32. — 416–422.
17. Ijlal Uddin, Shakil Aslam. Safety and tolerability of fixed antihypertensive combinations in blood pressure control: focus on olmesartan medoxomil and amlodipine combination // Integr. Blood Press. Control. — 2010. — 3. — 155–162. doi: 10.2147/IBPC.S6662.
18. Sison J., Ríos Vega R.M., Dayi Н., Bader G., Brunel Р. Efficacy and effectiveness of valsartan/amlodipine and valsartan/amlodipine/hydrochlorothiazide in hypertension: randomized–controlled versus observational studies // Current Medical Research and Opinion DOI: 10.1080/03007995.2017. 1412682.
19. Kafrawy N.E., Rashwan M., Lion K., Khedr K., Nashaat N. Effectiveness and tolerability of fixed dose combination of amlodipine/valsartan in treatment of hypertension in the real–life setting among Egyptian patients // Egyptian Heart J. — 2014. — 66. — 30–5.
20. Kario K., Tomitani N., Kanegae H., Ishii H., Uchiyama K., Yamagiwa K., Shiraiwa T., Katsuya T., Yoshida T., Kanda K., Hasegawa S., Hoshide S. Comparative effects of an angiotensin II receptor blocker (ARB)/diuretic vs. ARB/calcium–channel blocker combination on uncontrolled nocturnal hypertension evaluated by information and communication technology–based nocturnal home blood pressure monitoring — the NOCTURNE Study // Circ. J. — 2017. — 81. — 948–957.
21. Khan W., Moin N., Iktidar S., Sakrani J., Abid R., Afzal J. et al. Real–life effectiveness, safety, and tolerability of amlodipine/valsartan or amlodipine/valsartan/hydrochlorothiazide singlepill combination in patients with hypertension from Pakistan // Ther. Adv. Cardiovasc. Dis. — 2014. — 8. — 45–55.
22. Lins R., Aerts A., Coen N., Hermans C., MacDonald K., Brie H. et al. Effectiveness of amlodipine–valsartan single–pill combinations: hierarchical modeling of blood pressure and total cardiovascular disease risk outcomes (the EXCELLENT study) // Ann. Pharmacother. — 2011. — 45. — 727–39.
23. Mallat S.G., Itani H.S., Tanios B.Y. Current perspectives on combination therapy in the management of hypertension // Integr. Blood Press. Control. — 2013. — 6. — 69–78.
24. Mancia G., Fagard R., Narkiewicz K., Redon J., Zanchetti A., Bohm M. et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J. Hypertens. — 2013. — 31. — 1281–357.
25. Matsui Y., Eguchi K., O’Rourke M.F., Ishikawa J., Miyashita H., Shimada K., Kario K. Differential effects between a calcium channel blocker and a diuretic when used in combination with angiotensin II receptor blocker on central aortic pressure in hypertensive patients // Hypertension. — 2009. — 54. — 716–723.
26. Omboni S., Parati G., Palatini P. et al. Reproducibility and clinical value of nocturnal hypotension: prospective evidence from the SAMPLE study // J. Hypertens. — 1998. — 16. — 733–738.
27. Oparil S., Giles T., Ofili E.O., Pitt B., Seifu Y., Hilkert R., Samuel R, Sowers J.R. Moderate versus intensive treatment of hypertension with amlodipine/valsartan for patients uncontrolled on angiotensin receptor blocker monotherapy // J. Hypertens. — 2011 Jan. — 29(1). — 161–170. doi: 10.1097/HJH.0b013e32834000a7.
28. Pereira M., Lunet N., Azevedo A., Barros H. Differences in prevalence, awareness, treatment and control of hypertension between developing and developed countries // J. Hypertens. — 2009. — 27. — 963–75.
29. Philipp T., Smith T.R., Glazer R., Wernsing M., Yen J., Jin J. et al. Two multicenter, 8–week, randomized, double–blind, placebocontrolled, parallel–group studies evaluating the efficacy and tolerability of amlodipine and valsartan in combination and as monotherapy in adult patients with mild to moderate essential hypertension // Clin. Ther. — 2007. — 29. — 563–80.
30. Pogue V., Rahman M., Lipkowitz M. et al. Disparate estimates of hypertension control from ambulatory and clinic blood pressure measurements in hypertensive kidney disease // Hypertension. — 2009. — 53. — 20–27.
31. Safar M.E., Protogerou A., Blacher J. Central blood pressure under angiotensin and calcium channel blockade // Hypertension. — 2009. — 54. — 704–706.
32. Salles G.F., Reboldi G., Fagard R.H. et al. Prognostic effect of the nocturnal blood pressure fall in hypertensive patients: the Ambulatory Blood Pressure Collaboration in Patients With Hypertension (ABC–H) meta–analysis // Hypertension. — 2016. — 67. — 693–700.
33. Assaad–Khalil S.H., Nashaat N. Real–life Effectiveness and Safety of Amlodipine/Valsartan Single–pill Combination in Patients with Hypertension in Egypt: Results from the EXCITE Study // Drugs — Real World Outcomes. — 2016. — 3. — 307–315. DOI 10.1007/s40801–016– 0082–5.
34. Sawada T., Yamada H., Dahlf B., Matsubara H. for the KYOTO HEART Study Group. Effects of valsartan on morbidity and mortality in uncontrolled hypertensive patients with high cardiovascular risks: KYOTO HEART Study // Eur. Heart J. — 2009. — Vol. 30. — P. 2461– 2469
35. Sison J., Assaad–Khalil S.H., Najem R., Kitchlew A.R., Cho B., Ueng K.C. et al. Real–world clinical experience of amlodipine/valsartan and amlodipine/valsartan/hydrochlorothiazide in hypertension: the EXCITE study // Curr. Med. Res Opin. — 2014. — 30. — 1937–45.
36. Weycker D., Keskinaslan A., Levy D.G. et al. Effectiveness of add–on therapy with amlodipine in hypertensive patients receiving valsartan // Blood Press. Suppl. — 2008. — 2. — 5–12.
37. Waeber B., Ruilope L.M. Amlodipine and valsartan as components of a rational and effective fixed–dose combination // Vasc. Health Risk Manag. — 2009. — 5. — 165– 174.

/21-1.jpg)
/20-1.jpg)
/20-2.jpg)
/22-1.jpg)
/23-1.jpg)
/24-1.jpg)
/25-1.jpg)