Журнал «» №1 (63), 2019
Вернуться к номеру
Цільові рівні артеріального тиску в періоперативному догляді. Попередні міркування на основі всебічного огляду літератури
Авторы: Lingzhong Meng(1), Weifeng Yu(2), Tianlong Wang(3), Lina Zhang(4), Paul M. Heerdt(1), Adrian W. Gelb(5)
(1) — Відділ анестезіології медичного факультету Єльського університету (Yale University School of Medicine, New Haven, USA)
(2) — Відділ анестезіології госпіталю Реньї медичного факультету Шанхайського університету (Renji Hospital, Shanghai Jiao Tong University School of Medicine, China)
(3) — Відділ анестезіології госпіталю Хуанву Столичного (Пекін) медичного університету (Xuanwu Hospital, Capital Medical University, Beijing, China)
(4) — Відділ медицини критичних станів госпіталю Ксіангія Центрального південного університету (Xiangya Hospital, Central South University, Changsha, Hunan Province, China)
(5) — Відділ анестезіології та періоперативного догляду Каліфорнійського університету (University of California, San Francisco, USA)
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Як один із життєво важливих параметрів, артеріальний тиск (АТ) необхідно вимірювати щонайменше раз на 5 хвилин із використанням неінвазивного методу автоматичним приладом у пацієнтів під час анестезії протягом проведення хірургічної операції, а в багатьох випадках рівень АТ контролюється постійно з використанням інвазивного методу. Обґрунтування рутинного й регулярного моніторингу АТ у періопераційному періоді ґрунтується на таких аргументах: 1) рівень АТ може бути надзвичайно мінливим; 2) ненормальний рівень АТ асоціюється із несприятливими наслідками; 3) рівень АТ можна легко лікувати; 4) керування рівнем АТ відповідно до рекомендованих протоколів може покращувати результати на підставі даних декількох рандомізованих контрольованих досліджень (РКД).
Хоча ретельний моніторинг АТ при періоперативному догляді є обов’язковим, на сьогодні немає єдиного консенсусу щодо відповідного цільового рівня АТ для кожного окремого пацієнта, якому виконуються анестезія й оперативне лікування. Така ситуація є повним контрастом до лікування хронічної гіпертензії на первинному етапі. Нещодавно переглянуті рекомендації визначають як порогові рівні артеріальної гіпертензії (АГ) для систолічного АТ (САТ) і діастолічного АТ (ДАТ) 130 і 80 мм рт.ст. відповідно [1]. Очевидно, що, хоча рівень АТ набагато рідше перевіряється при первинному лікуванні — з інтервалом від декількох днів до декількох тижнів або місяців, для первинної ланки медичної допомоги встановлено цільові рівні АТ при лікуванні однієї з найбільших груп пацієнтів у сфері охорони здоров’я. Важливим питанням залишається таке: чи можна встановити подібні терапевтичні цільові рівні АТ у періопераційному лікуванні й використовувати їх для > 300 мільйонів хірургічних процедур, що проводяться щороку в усьому світі [2].
Ми провели вичерпний пошук літератури для вивчення досліджень, у яких розглядали зв’язок між рівнем АТ і результатами або вплив стратегії керування рівнем АТ на результати при періоперативному догляді. З огляду на найкращі наявні дані клінічного досвіду ми пропонуємо попередні міркування для полегшення визначення індивідуального цільового рівня АТ для окремого хірургічного пацієнта.
Пошук літератури
Ми шукали дослідження, які вивчали зв’язок між рівнем АТ і результатами або вплив стратегії керування рівнем АТ на результати в дорослих пацієнтів (≥ 18 років), яким проводили анестезію й оперативне лікування. Дослідження, орієнтовані на асоціацію хронічної гіпертензії, пульсового тиску, варіабельності АТ або навмисної гіпотензії з результатами у хворих, були виключені. Був здійснений систематичний пошук в електронних бібліографічних базах даних Ovid MEDLINE, Embase, PubMed і Web of Science 3×, останній пошук проводився 1 червня 2018 р. Деталі цих пошуків доступні за запитом. Ми також перевірили відповідні списки літературних джерел і виконали несистематичні пошуки в Google Scholar і PubMed, нарешті, визначили 72 відібраних статті, які включали 63 нерандомізовані дослідження та 9 РКД. Подальше обговорення поділяється на розділи відповідно до дизайну досліджень і типу оперативного лікування.
Нерандомізовані дослідження, проведені в несерцевій хірургії
Більшість досліджень, за кількома винятками [3–7], показали, що гіпотензія під час різних некардіальних операцій пов’язана з різними несприятливими результатами, у тому числі: підвищеною смертністю [8–23], більшою тривалістю госпіталізації [12, 24], смертністю від усіх причин [25], гострою нирковою недостатністю [26–31], ураженням міо-карда [9, 17, 26, 28, 29, 32–38], післяопераційною застійною серцевою недостатністю [39], інсультом [23, 38, 40], післяопераційними порушеннями когнітивних функцій [41], післяопераційним делірієм [42], порушенням функцій трансплантата печінки [16] і нирки [43] і анастомозним витоком після езофагоектомії [44].
Критерії інтраопераційної гіпотензії, що використовуються в цих дослідженнях, були дуже різноманітними. Використовували обидва підходи: абсолютний (наприклад, рівень середнього АТ (СерАТ) < 65 мм рт.ст.) і відносний (наприклад, зниження СерАТ ≥ 20 % від початкового рівня). Одне дослідження показало, що інтраопераційна гіпотензія, заснована на відносних, а не на абсолютних порогових значеннях, асоціювалася з післяопераційними серцевими або нирковими ускладненнями [29], тоді як інше дослідження показало, що поріг абсолютної й відносної гіпотензії мав однакову дискримінативну силу для хворих із пошкодженням життєво важливих органів і без них відповідно [26]. Низка досліджень продемонстрували, що тривалість гіпотензії є важливою детермінантою ймовірності, а можливо, і тяжкості несприятливих результатів [15, 24, 26].
Доказів, що пов’язують інтраопераційну гіпертензію з післяопераційними результатами, недостатньо, а висновки з наявних досліджень суперечливі. Одне дослідження показало, що інтраопераційний рівень САТ > 160 мм рт.ст. (тривалість не вказана) під час великого некардіального хірургічного втручання з тривалістю операції > 220 хвилин незалежно асоціюється з негативним хірургічним результатом, визначеним як тривалість перебування в стаціонарі > 10 днів із збільшеним числом ускладнень або смерті [45]. На відміну від цього велике когортне дослідження показало, що інтраопераційна гіпертензія не була асоційована з підвищеною оперативною смертністю після некардіального хірургічного втручання протягом 30 днів, а гіпотензія, навпаки, була пов’язана з нею [10].
Рандомізовані дослідження, проведені в несерцевій хірургії
Хоча нерандомізовані дослідження привертають нашу увагу до асоціації між рівнем АТ і результатом після операції, вони не в змозі з’ясувати вплив цілеспрямованого управління рівнем АТ на результат. На сьогодні є лише три РКД, у яких конкретно порівнювали результати, пов’язані з різними цільовими рівнями АТ у некардіальній хірургії.
РКД, проведене Williams-Russo зі співавторами [46], включало пацієнтів похилого віку, яким виконували ендопротезування кульшового суглоба під епідуральною анестезією. У цьому дослідженні не було виявлено жодної різниці в результатах між групою із значимою гіпотензією (СерАТ 45–55 мм рт.ст.; n = 117) і групою із помірною гіпотензією (СерАТ 55–70 мм рт.ст.; n = 118). Випробування має кілька обмежень, що включають відсутність контрольної нормотензивної групи, використання тільки абсолютних значень АТ як терапевтичних цілей, а також потенційний додатковий ефект інфузії адреналіну, що застосовувалася в усіх пацієнтів.
РКД, проведене Carrick з співавторами [47], порівнювало вплив різних цільових значень СерАТ (50 проти 65 мм рт.ст.) на рівень 30-денної смертності у хворих, яким проводили лапаротомію або торакотомію через травму (n = 168). Це дослідження було припинено рано, частково — через клінічну рівномірність і нездатність довести результат. Знову ж таки у цьому дослідженні як терапевтичні мішені використовувалися тільки абсолютні значення АТ, і обидва значення можуть бути нижчими, ніж початкові або оптимальні рівні АТ.
Нещодавнє РКД, проведене Futier зі співавторами [48] у дорослих пацієнтів з великою абдомінальною операцією з метою порівняння персоналізованого цільового рівня АТ, який було визначено як збереження САТ у межах від 90 до 110 % від початкового рівня (n = 147), із звичайним цільовим рівнем АТ, який означав підтримку САТ на рівні > 80 мм рт.ст. або > 60 % від початкового значення (n = 145). Первинним результатом був синдром системної запальної відповіді й щонайменше дисфункція однієї головної системи органів до 7-го дня після операції. Це дослідження показало, що лікування, яке керувалося індивідуальною метою, покращувало первинний результат (відносний ризик 0,73; 95% ДІ 0,56–0,94; р = 0,02) і зменшувало ризик розвитку дисфункції органа навіть після 30-го дня після операції (стандартизований коефіцієнт ризику 0,66; 95% ДІ 0,52–0,84; р = 0,001).
Інше РКД — POISE (Perioperative Ischemic Evaluation) — показало, що періопераційне застосування метопрололу порівняно з плацебо зменшувало ризик виникнення інфаркту міокарда, але збільшувало частоту інсульту й смертності у хворих із некардіальною хірургічною операцією [23]. Це дослідження також показало, що клінічно значима гіпотензія збільшує ризик розвитку інсульту й смерті [23]. Однак у цьому дослідженні не були встановлені цільові показники АТ, хоча відомо, що метопролол і плацебо впливають на рівень АТ по-різному.
Ці РКД разом продемонстрували, що вищий показник АТ порівняно з нижчим не призводить до погіршення результату в пацієнтів із некардіальною хірургічною операцією й може призвести до покращання результату, коли інтраопераційний рівень АТ підтримується в безпосередній близькості до початкового значення в пацієнта.
Нерандомізовані дослідження, проведені в серцевій хірургії
У літературі доступні дані про 12 нерандомізованих досліджень, проведених у пацієнтів при хірургічній операції на серці, і всі вони включали хворих, у яких застосовано штучний кровообіг (ШК) [49–60]. Тісний зв’язок між гіпотензією й результатом у цій популяції пацієнтів був показаний численними дослідженнями, у яких оцінювали вплив на смертність [49, 54], кількість основних ускладнень [54], інсульти в зоні вододілу [60], ранню когнітивну дисфункцію [50], післяопераційний делірій [56] і гостру ниркову недостатність [51, 53, 59]. Також було показано асоціацію гіпертензії з інсультом [49] і післяопераційним делірієм [56]. Проте одне дослідження не знайшло асоціації між гіпотензією й післяопераційним делірієм [57], і в 3 дослідженнях не вдалося виявити зв’язок між рівнем АТ і гострою нирковою недостатністю [52, 55, 58].
Негативний вплив субоптимального рівня АТ на результати, ймовірно, визначається не тільки величиною, але й тривалістю цієї аномалії. Виражені зміни рівня АТ, хоч і упродовж короткого періоду, можуть бути шкідливими, але і незначні відхилення протягом тривалого часу також можуть викликати такі самі наслідки. Це концепція підтверджується дослідженнями, проведеними в кардіохірургічних хворих. Три дослідження показали, що площа під кривою, яка визначалася як добуток величини й тривалості знаходження рівня СерАТ нижче від нижньої межі церебральної авторегуляції (на підставі індексу оксиметрії головного мозку) [53, 54] або нижче від оптимального рівня АТ (визначеного як рівень СерАТ із найменшою кореляцією з індексом потоку, розрахованим на основі рухомого, лінійного коефіцієнта кореляції між церебральним індексом потоку, виміряного за допомогою ультра-звукової спектроскопії в ближній інфрачервоній ділянці, та СерАТ [59]), була незалежно пов’язана з післяопераційною гострою нирковою недостатністю [53, 59] і більшим числом загальних ускладнень або операційною смертністю [54]. Одне дослідження показало, що площа під кривою, яка визначалась як добуток величини і тривалості СерАТ вище від верхньої межі церебральної авторегуляції (на основі індексу оксиметрії головного мозку), була пов’язана з розвитком післяопераційного делірію [56].
Загалом отримані докази свідчать, що обидва стани (і гіпотензія, і гіпертензія) пов’язані з несприятливими наслідками в кардіохірургічних пацієнтів, і цей несприятливий вплив пов’язаний з інтегральний продуктом величини й тривалості аномального значення АТ. Концепція гіпотензивного або гіпертензивного навантаження заслуговує на подальше дослідження.
Рандомізовані дослідження, проведені в серцевій хірургії
П’ять РКД спеціально порівнювали ефекти низького та високого цільового рівня АТ під час застосування ШК в кардіохірургічних пацієнтів.
В одному РКД (n = 248) було показано, що комбінована кінцева точка, яка включала серцеві й неврологічні ускладнення, було достовірно нижче в групі високого СерАТ (80–100 мм рт.ст., частота 4,8 %), ніж у групі з низьким СерАТ (50–60 мм рт.ст., частота 12,9 %) [61]. Низка даних інших РКД (n = 92) підтвердили ці знахідки й показали, що підтримка більш високого цільового перфузійного тиску (80–90 мм рт.ст.) порівняно з більш низьким цільовим тиском (60–70 мм рт.ст.) під час застосування нормотермічного ШК було асоційовано зі значно меншою частотою ранньої післяопераційної когнітивної дисфункції й делірію [62].
На відміну від решти в 3 РКД не знайшли відмінностей у результатах, пов’язаних із використанням різних цільових рівнів перфузійного тиску. В одному з них (n = 412) комбінована кінцева точка, що включала смертність, частоту основних ускладнень (серцеві, неврологічні або когнітивні) і погіршення якості життя, істотно не відрізнялася в групі високого цільового СерАТ (80 мм рт.ст.) і групі звичайного тиску (цільовий = рівень тиску до операції) [63]. За результатами кількох різних РДК (n = 300) частота розвитку гострої ниркової недостатності суттєво не відрізнялася і між групами з різним рівнем перфузійного тиску (75–85 проти 50–60 мм рт.ст.) під час нормотермічного ШК [64]. За даними іншого нещодавнього РКД (n = 197), обсяг або кількість нових ішемічних уражень головного мозку, виявлених методом дифузійно-зваженої магнітно-резонансної візуалізації, достовірно не відрізнялася між групами з більш високим (70–80 мм рт.ст.) і більш низьким (40–50 мм рт.ст.) перфузійним тиском під час ШК [65].
Загалом докази, отримані в РКД, демонструють, що стратегії збереження більш високого перфузійного тиску порівняно з більш низьким його рівнем під час застосування ШК не мають шкідливого ефекту й можуть давати більш сприятливі результати у кардіохірургічних хворих.
Хірургія сонних і мозкових артерій
У хворих, яким проводили каротидну ендартеректомію, в одному ретроспективному дослідженні було виявлено достовірний зв’язок між інтраопераційною гіпотензією (визначалася як САТ < 80 мм рт.ст. протягом > 15 хвилин) і більш високим ризиком нових випадків фібриляції передсердь та інших великих ускладнень [66]. У тієї ж популяції пацієнтів перспективне когортне дослідження показало, що збереження СерАТ ≥ 120 % від доопераційного рівня під час перехресного перетискання сонної артерії асоціюється з достовірно меншим ризиком розвитку ранньої когнітивної дисфункції, оціненою протягом 24 годин після операції [67]. На відміну від цього в пацієнтів, яким проводили стентування сонних артерій, одне ретроспективне дослідження не показало розвитку небажаних неврологічних ускладнень навіть при зниженні САТ на < 50 мм рт.ст. [68].
У великому ретроспективному когортному дослідженні, що базувалося на даних 7677 хворих, яким проводили каротидну ендартеректомію, було виявлено, що нестабільність гемодинаміки після операції, яка визначалася як післяопераційна гіпертензія або гіпотензія, що вимагали внутрішньовенного введення вазоактивних препаратів, була асоційована зі збільшенням числа ускладнень і смертності протягом 1 року після операції [69]. Це дослідження підкреслює важливість значення безперервного інтенсивного управління АТ після каротидної ендартеректомії.
При кліпіруванні внутрішньочерепної аневризми пацієнти схильні до ішемії мозку. Одне ретроспективне дослідження показало достовірну асоціацію між інтраопераційною гіпотензією, визначеною як САТ < 90 мм рт.ст. протягом > 15 хвилин, і несприятливими результатами, оціненими за шкалою Глазго, а також частотою виникнення й тяжкістю вазоспазму [70]. Одне проспективне когортне дослідження показало, що коли рівень СерАТ стає < 70 мм рт.ст., напруга кисню в тканинах головного мозку починає значно зменшуватися [71]. Проте зв’язок між інтраопераційною гіпотензією (визначалася як рівень СерАТ < 70 % від доопераційного) і відстроченою ішемією головного мозку й тяжким його ураженням за шкалою Глазго (< 4) був спростований даними різних ретроспективних досліджень [72].
Результати цих нерандомізованих досліджень є непослідовними. Потрібно оцінити частоту серцевих ускладнень, пов’язаних із необхідністю підтримувати АТ на рівні, що на 20 % вище від початкових показників, під час перехресного затискання сонної артерії. На даний момент немає РКД, у яких би порівнювали різні цільові рівні АТ у хворих, яким проводять хірургічні втручання на сонних або мозкових артеріях.
Чи виявлено обґрунтований доказами цільовий рівень АТ при періоперативному догляді?
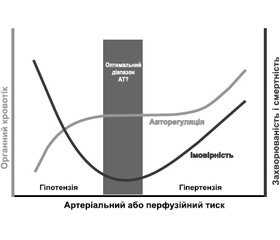
Тісний зв’язок між рівнем АТ і результатом при періопераційному догляді підтримується значним числом посилань на наукову літературу, хоч і не в усіх дослідженнях. Загалом докази базуються насамперед на нерандомізованих дослідженнях, проведених у пацієнтів, яким виконували серцеве або некардіальне оперативне втручання, і вони свідчать про те, що обидва стани, гіпотензія і гіпертензія, пов’язані з несприятливими наслідками (рис. 1). Проте питання стосуються того, наскільки низьким є низький і наскільки високим є високий цільові рівні АТ для конкретного пацієнта. Нещодавнє РКД, проведене у хворих, яким робили великі абдомінальні операції, продемонструвало користь збереження періопераційного АТ в безпосередній близькості від базового рівня в кожного пацієнта (± 10 %) [48]. Однак у різних групах у цьому дослідженні використовувалися різні вазопресори (тобто ефедрин проти норепінефрину). Більше того, залишається визначати, чи є ця персоналізована стратегія управління АТ придатною для інших груп хірургічних пацієнтів.
Чому немає консенсусу щодо цільового рівня АТ при періоперативному догляді?
Хоча рівень АТ обов’язково й регулярно контролюється при періопераційному догляді, на поточний момент бракує консенсусу щодо визначених цілей АТ для різних хірургічних груп пацієнтів. Для цього існують численні потенційні причини. По-перше, і популяція пацієнтів, і тип операції, оцінені в попередніх дослідженнях, є неоднорідними. Різні пацієнти й відмінні типи операцій пов’язані з різними проблемами й пріоритетами визначення цільового рівня АТ. По-друге, різні й часто складні методи аналізу АТ, зокрема систолічне, середнє, діастолічне, абсолютне значення, відносна зміна, різні порогові рівні, площа під порогом, середній показник, середньозважений, мінімальний, тривалість мінімуму тощо, крім різних терапевтичних мішеней АТ, що використовувалися у різних РКД, роблять уніфікацію цільового АТ складним завданням. Нарешті, кінцеві результати, які були оцінені в різних дослідженнях, також є неоднорідними, що збільшує складність об’єднання доказів.
Інтеграція результатів клінічних досліджень у догляд за конкретним хірургічним пацієнтом
Усі дослідження, розглянуті в цій статті, були виконані у вибіркових популяціях хворих, а не в окремого пацієнта, і зроблені висновки базуються на інтеграції даних від усіх пацієнтів, а не від одного пацієнта. Отже, пряме перенесення даних, отриманих із клінічних досліджень, у догляд за окремим пацієнтом може бути недоречним. Наприклад, хоча численні свідчення показують, що інтраопераційний рівень СерАТ < 60 мм рт.ст. може бути пов’язаний з ураженням різних органів після некардіального хірургічного втручання [26, 28], такі дані не надають лікарям доказів щодо того, яким буде оптимальний рівень інтраопераційного СерАТ для пацієнта з початковим значенням АТ 160/90 мм рт.ст. (СерАТ ≈ 113 мм рт.ст.). Більшість клініцистів не підтримуватиме СерАТ у такого пацієнта на рівні 60 мм рт.ст. Постає питання про те, яким є оптимальний АТ для цього конкретного пацієнта. Тому результати наявних досліджень повинні бути продумано інтегровані в індивідуалізований догляд за хірургічним пацієнтом (рис. 2).
Попередні міркування для визначення цільового АТ в конкретного хірургічного пацієнта
Для визначення цільового рівня АТ для окремого хірургічного пацієнта необхідно використовувати прагматичний підхід, що ґрунтується на доказовій базі. Однак на даний момент для більшості реальних клінічних ситуацій якісні докази часто відсутні, обмежені або їх складно застосувати для догляду за конкретним пацієнтом. На підставі найкращих наявних доказів і клінічного досвіду ми пропонуємо такі попередні міркування для полегшення визначення цільового періопераційного АТ (рис. 3). Клас і рівень доказів цих міркувань указані в табл. 1.
Диференціювання типу хірургії
Різні операції спрямовані на відмінні групи пацієнтів і мають різний вплив на АТ і перфузію органів. Через часте використання ШК та особливий вплив хірургічних маніпуляцій на кровообіг кардіохірургія відрізняється від некардіальних втручань. Кардіохірургічна операція при використанні ШК має відмінності до, під час і після ШК. Хірургія сонних і мозкових артерій загрожує мозковій перфузії під час тимчасової оклюзії внутрішньої сонної артерії або тимчасового її перетискання під час відсікання аневризми. Тому доцільно диференціювати тип операції як перший крок.
Класифікація початкового рівня АТ
Питання, чи буде однаковою користь від одного і того ж цільового рівня АТ у нормотензивного пацієнта та хворого з гіпертонічною хворобою, є ключовим, і воно явно ставить під сумнів практику «один розмір підходить для всіх». Широка міжіндивідуальна різниця початкових рівнів АТ робить управління його рівнем на основі посилання на базове вимірювання обґрунтованим і відповідає результатам нещодавнього РКД, описаного вище [48]. З огляду на ці міркування ми пропонуємо розподілити початковий рівень АТ на три групи: низький (САТ < 90 мм рт.ст. або ДАТ < 50 мм
рт.ст.), нормальний (САТ 90–129 мм рт.ст. і ДАТ 50–79 мм рт.ст.) і високий (САТ ≥ 130 мм рт.ст. або ДАТ ≥ 80 мм рт.ст.). Початковий (базовий) рівень АТ — це середнє значення кількох вимірювань, проведених у пацієнта, без стресу, без болю під час неспання (або на фоні легкої седації). Через різноманітність типів АТ (тобто САТ проти ДАТ, проти СерАТ), що використовувалися в поперед-ніх дослідженнях, важко уніфікувати різні типи вимірювань АТ до однієї форми.
Міркування щодо пацієнта з некардіальною хірургічною операцією й початково низьким рівнем АТ (САТ < 90 мм рт.ст. або ДАТ < 50 мм рт.ст.)
Для пацієнтів із низьким початковим рівнем АТ метою може бути підтримка СерАТ ≥ 60 мм рт.ст. і рівень АТ у межах 100–120 % від початкового рівня. Ця думка базується на даних численних досліджень, у яких послідовно було показано, що рівень СерАТ < 60 мм рт.ст. під час операції асоціюється з різними несприятливими наслідками [8, 24, 26–28]. Хоча початкові показники АТ у цих дослідженнях не були указані, (ми вважаємо, що) раціонально помилятися на стороні обережності, підтримуючи СерАТ ≥ 60 мм рт.ст. навіть у пацієнтів із низьким початковим рівнем АТ. Найвищий початковий рівень АТ у даній популяції пацієнтів становить ≈ 90/50 мм рт.ст., що дає СерАТ ≈ 63 мм рт.ст. Відносно допустимого збільшення АТ у цій популяції пацієнтів (ми вважаємо), що доцільно зберігати його на рівні ≤ 20 % (замість 10 %) від початкового значення, оскільки найвищий допустимий СерАТ буде ≈ 76 мм рт.ст. для найвищого початкового значення СерАТ ≈ 63 мм рт.ст. (63 мм рт.ст. × × 120 % = 76 мм рт.ст.). Клінічно рівень СерАТ 76 мм рт.ст. є звичайним і вважається нормальним. Також у цій популяції пацієнтів доцільно підтримувати АТ не нижче від початкового рівня, це означає, що допустиме зниження АТ становить 0 %, тому що якщо необхідною умовою є збереження рівня СерАТ ≥ 60 мм рт.ст. у цій популяції, то не буде простору для подальшого зниження АТ у пацієнта з найвищим початковим рівнем СерАТ ≈ 63 мм рт.ст. Можна зробити висновок, що в пацієнтів із початковим значеннями СерАТ < 60 мм рт.ст. не повинно бути шансів отримати періопераційний рівень СерАТ менший, ніж початковий рівень, оскільки головним завданням є підтримка СерАТ ≥ 60 мм рт.ст.
Міркування щодо пацієнта із некардіальною хірургічною операцією й початково нормальним рівнем АТ (САТ 90–129 мм рт.ст. і ДАТ 50–79 мм рт.ст.)
Метою для пацієнтів із нормальним початковим рівнем АТ може бути підтримка цього показника в межах 90–110 % від початкового значення і рівень СерАТ в межах ≈ 65–95 мм рт.ст. Правило 10 %, тобто допустиме відхилення рівня АТ на 10 % від початкового значення, базується на результатах нещодавно проведеного РКД у пацієнтів, яким виконували велику абдомінальну хірургічну операцію [48]. Незважаючи на те, що це дослідження має обмеження і в ньому не розрізняли початкові показники АТ учасників дослідження, доцільно прийняти правило 10 % у пацієнтів з нормальним початковим рівнем АТ. Діапазон СерАТ від ≈ 65 до 95 мм рт.ст. базується на тому факті, що найнижчі й найвищі початкові значення АТ у даній популяції пацієнтів становлять 90/50 і 130/80 мм рт.ст. відповідно.
Міркування щодо пацієнта з некардіальною хірургічною операцією й початково високим рівнем АТ (САТ ≥ 130 мм рт.ст. або ДАТ ≥ 80 мм рт.ст.)
Метою для пацієнтів із високим початковим значенням АТ може бути підтримка рівня АТ у межах 80–110 % від початкового значення і САТ < 160 мм рт.ст. Ця популяція пацієнтів належить до групи ризику щодо коливань АТ у періопераційний період. Відносно допустимого зниження АТ: доцільно зберігати його на рівні ≤ 20 % замість 10 % від початкового рівня, виходячи з розрахунку, що порогове значення 10 % порівняно з 20 % може призвести до невиправданого високого рівня АТ. Наприклад, при початковому значенні САТ 190 мм рт.ст. найнижчий допустимий рівень САТ становить ≈ 170 мм рт.ст. і ≈ 150 мм рт.ст. на основі правила 10 і 20 % відповідно. У цього пацієнта більшість клініцистів, якщо є вибір із цих двох варіантів, віддали б перевагу стратегії тримати САТ на рівні 150 мм рт.ст. замість 170 мм рт.ст. Правило 20 % підтримується результатами декількох нерандомізованих досліджень [26, 29, 40, 44]. На відміну від цього, щодо межі допустимого збільшення АТ може бути доцільним дотримуватися правила 10 %, тобто ≤ 10 % від початкового значення [48]. На додаток до згаданого зазначимо, що на основі результатів 1 ретроспективного [45] та 1 проспективного досліджень [9] ми рекомендуємо підтримувати рівень САТ < 160 мм рт.ст.
Міркування щодо пацієнта із серцевою хірургічною операцією
Доказів, пов’язаних з цільовими рівнями АТ до і після ШК при кардіохірургічній операції, вкрай мало. На даний момент як еталон доцільно використовувати ті самі міркування, що й у некардіальній хірургії. На основі результатів 5 РКД як цільовій рівень АТ під час використання ШК доречно розглядати значення СерАТ у межах від 70 до 100 мм рт.ст. [61–65]. У двох із цих РКД було продемонстровано сприятливі ефекти, пов’язані з більш високим рівнем перфузійного тиску [61, 62], на той час як 3 з них не виявили різниці між високим і низьким цільовим рівнем АТ [63–65]. З огляду на ці дані можна вважати за доцільне підтримувати більш високий перфузійний тиск під час ШК, тому що хоча й не вся сукупність доказів показує його сприятливий ефект, але немає жодних доказів несприятливого ефекту ситуації, коли перфузійний тиск підтримується на більш високому рівні. Діапазон цільового СерАТ від 70 до 100 мм
рт.ст. все ще залишається дуже широким. Специфічні цільові рівні СерАТ під час ШК для окремого пацієнта повинні бути визначені на основі початкових даних і моніторингу перфузії життєво важливих органів, коли це можливо забезпечити.
Міркування щодо пацієнта з хірургічною операцією на сонних і мозкових артеріях
На основі результатів нерандомізованого дослідження з кінцевою точкою у вигляді ранньої когнітивної дисфункції при проведенні каротидної ендартеректомії цільовий АТ під час тимчасової оклюзії внутрішньої сонної артерії може бути ≥ 120 % від початкового значення [67]. На підставі результатів 2 нерандомізованих досліджень під час цереброваскулярної хірургічної операції цільовим рівнем АТ може бути підтримка значень САТ
> 90 мм рт.ст. і СерАТ > 70 мм рт.ст. На основі думки експертів вважається за доцільне підтримувати рівень АТ ≥ початкового під час кліпірування артерії, що веде до внутрішньочерепної аневризми [73].
Балансування між ризиком ішемії органів, викликаної гіпотензією, і ризиком пов’язаних із гіпертензією хірургічних кровотеч
Двома основними модифікаторами цільового рівня АТ у періопераційному лікуванні є ризик виникнення ішемії органів і пов’язаних з АТ хірургічних кровотеч. Значення АТ повинні підтримуватися у верхньому допустимому діапазоні, коли ризик виникнення органної ішемії високий; і, навпаки, коли ризик кровотечі, пов’язаний із АТ, є значним, його рівень слід підтримувати в нижчому допустимому діапазоні [75, 76]. Приймати рішення щодо співвідношення ризику й користі слід тоді, коли ці два ризики співіснують.
Управління АТ, кероване моніторингом оксигенації тканин
Гемодинаміка — це сходи, що складаються з декількох взаємопов’язаних сходинок (рис. 4). АТ є сходинкою, розташованою всередині, тоді як тканинна оксигенація є сходинкою, розташованою вгорі. Параметри тканинної оксигенації, виміряні методом спектроскопії в ближній інфрачервоній ділянці, такі як насичення киснем тканин мозку, являють собою баланс між споживанням кисню тканинами і його постачанням. Постачання кисню до тканин визначається численними сходинками, розташованими більш низько, причому АТ є лише однією з цих детермінант. У результаті взаємозв’язок між тканинною оксигенацією й АТ є нестійким і потребує інтерпретації в клінічному контексті [77, 78]. Оптимальне управління АТ, кероване моніторингом оксигенації тканин, залишається і перспективним методом, і викликом, що заслуговує на подальше дослідження.
Точне лікування гіпотензії: проект
Точне лікування періопераційної гіпотензії має базуватись на посиланні на початково виміряні в пацієнта величини АТ, серцевого викиду, ударного об’єму, частоти серцевих скорочень і системного судинного опору (рис. 5). Рівень АТ визначається добутком величини серцевого викиду й системного судинного опору. Якщо зменшення серцевого викиду відповідає за гіпотензію, слід визначити причину зміни серцевого викиду, тобто зменшення ударного об’єму або зменшенням частоти серцевих скорочень. Зменшення ударного об’єму може бути вторинним: або через недостатній внутрішньосудинний об’єм, або внаслідок зменшення скоротливості міокарда. Якщо пацієнт реагує на введення рідини, тобто проявляє відносно велике збільшення ударного об’єму (наприклад, ≥ 10 %) після болюсного введення рідини, йому показана терапія заміщенням об’єму; в іншому випадку показані позитивні інотропні препарати [79]. Позитивні хронотропи показані, якщо причиною зменшення серцевого викиду є зменшення частоти серцевих скорочень. Зниження системного судинного опору можна корегувати шляхом регулювання глибини анестезії, або призначенням вазопресорів, або обома методами. Застосування запропонованого підходу вимагає удосконаленого гемодинамічного моніторингу з оцінкою об’єму й перфузії. Ці пропозиції повинні бути підтверджені даними РКД.
Важливість управління АТ після хірургічної операції
Вищенаведені міркування стосуються визначення цільового рівня АТ під час, а не після операції. Проте вразливість рівня АТ може бути і в післяопераційному періоді. Навіть при незначних операціях після загальної анестезії часто зустрічається ортостатична гіпотензія [80]. Наприклад, гемодинамічна нестабільність після операції каротидної ендартеректомії була пов’язана з підвищеною періопераційною й однорічною захворюваністю та смертністю [69, 81]. В одному з останніх ретроспективних досліджень було показано, що гіпотензія, яка визначалася як рівень САТ < 90 мм рт.ст. і потребувала лікування протягом кожної з періопераційних фаз, тобто під час операції, безпосередньо в день після операції і на 1–4-й післяопераційний день, достовірно була асоційована з ризиком комбінованої кінцевої точки — інфарктом міокарда й смертністю [17]. Протокол РКД, у якому було показано сприятливий ефект, пов’язаний із персоналізованим рівнем АТ (90–110 % від початкового рівня), охоплював період під час операції та перші 4 години після неї [48]. З огляду на вищезазначене безперервне управління АТ після операції заслуговує на подальше дослідження.
Міркування не є підставою для критичної оцінки професійної недбалості
Добре відомо, що, як одна з найбільш мінливих фізіологічних змінних, значення АТ може легко вийти за межі цільового діапазону в періопераційних умовах. Проте екстремальні зміни рівня АТ — це не відхилення від стандарту догляду, а скоріше сигнал до дії [82]. Докази засвідчують, що гіпотензія під час індукції анестезії не може бути ні надійним, ні корисним якісним заходом для порівняння ефективності роботи анестезіолога [83]. На основі клінічного досвіду можна стверджувати, що якщо будуть своєчасно призначені заходи, які базуються на ретельному моніторингу, як правило, не буде навіть мінімальної необоротної шкоди. Ці висновки узгоджуються з даними, що пошкодження, пов’язані з рівнем АТ, залежать не тільки від ступеня, а й від тривалості зміни рівня АТ. Запропоновані тут міркування мають на меті полегшити визначення цільового рівня АТ у періопераційному лікуванні, вони не є підставою для критичної оцінки професійної недбалості (некомпетентності). Ці пропозиції є тимчасовими й мають бути переглянуті, коли з’являються нові докази.
Керування АТ при періоперативному догляді порівняно з первинною ланкою
Відмінності в керуванні АТ між періопераційним доглядом і первинною медичною допомогою є значними. Рівень АТ є набагато більш мінливим протягом періопераційного періоду, ніж на етапі первинної допомоги. Хоча немає консенсусу щодо визначення гіпотензії, вона є важливою проблемою в періопераційному періоді, але не при первинній допомозі. Модель управління хронічною гіпертензією на етапі первинної медичної допомоги визначає відповідні точні абсолютні значення щодо цільового рівня АТ на фоні терапії для надзвичайно великої популяції пацієнтів, що неможливо відтворити при періопераційному догляді. Терапевтичні цільові рівні АТ при періопераційному догляді повинні визначатися на основі інтеграції результатів клінічних досліджень та індивідуалізованої оцінки кожного пацієнта. При періопераційному догляді можливе інтенсивне керування АТ на основі персоналізованої цілі, тому що принаймні під час операції анестезіолог знаходиться постійно поруч із пацієнтом і перевіряє рівень АТ щонайменше кожні 5 хвилин, що неможливо виконати на етапі первинної допомоги.
Висновок
На підставі даних численних нерандомізованих досліджень показано тісний зв’язок між рівнем АТ і результатом при періопераційному лікуванні. Підтримка вищого рівня АТ порівняно з більш низьким значенням АТ не призводить до погіршення результатів, навпаки, за результатами 3 РКД, виконаних у некардіальних хірургічних пацієнтів, і 5 РКД, проведених у кардіохірургічних пацієнтів, може призвести до покращення наслідків. На відміну від лікування хронічної гіпертензії на етапі первинної медичної допомоги, керування АТ при періопераційному догляді необхідно персоналізувати. Організація періопераційного лікування, наприклад, принаймні при співвідношенні 1 : 1 між пацієнтом і медичним персоналом протягом усієї операції, робить інтенсивне керування АТ можливим. При визначенні цільового рівня АТ при періопераційному догляді слід брати до уваги як мінімум тип операції, початкове значення АТ у пацієнта й ризики ішемії органів, пов’язаної з гіпотензією, і кровотечі, пов’язаної з гіпертензією. Через відсутність якісних доказів і варіабельність значень АТ при періопераційному догляді запропоновані тут міркування повинні використовуватися як попередній допоміжний інструмент для прийняття клінічних рішень, вони не є підставою для висновку про професійну некомпетентність. Необхідно терміново провести більше якісних РКД, особливо орієнтованих на кінцевий результат.
Переклад проф. Ю.М. Сіренка
Оригінал статті надрукований у журналі Hypertension, 2018; 72: 806-817. DOI: 10.1161/HYPERTENSIONAHA.118.11688.
1. Whelton P.K., Carey R.M., Aronow W.S. et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/ NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines // Hypertension. 2018; 71: e13-e115. doi: 10.1161/HYP.0000000000000065.
2. Rose J., Weiser T.G., Hider P., Wilson L., Gruen R.L., Bickler S.W. Estimated need for surgery worldwide based on prevalence of diseases: a modelling strategy for the WHO Global Health Estimate // Lancet Glob Health. 2015; 3(suppl 2): S13-S20. doi: 10.1016/S2214-109X(15)70087-2.
3. Bijker J.B., van Klei W.A., Vergouwe Y., Eleveld D.J., van Wolfswinkel L., Moons K.G., Kalkman C.J. Intraoperative hypotension and 1-year mortality after noncardiac surgery // Anesthesiology. 2009; 111: 1217-1226. doi: 10.1097/ALN.0b013e3181c14930.
4. Hsieh J.K., Dalton J.E., Yang D., Farag E.S., Sessler D.I., Kurz A.M. The association between mild intraoperative hypotension and stroke in general surgery patients // Anesth. Analg. 2016; 123: 933-939. doi: 10.1213/ANE.0000000000001526.
5. Hirsch J., DePalma G., Tsai T.T., Sands L.P., Leung J.M. Impact of intraoperative hypotension and blood pressure fluctuations on early postoperative delirium after non-cardiac surgery // Br. J. Anaesth. 2015; 115: 418-426. doi: 10.1093/bja/aeu458.
6. Kertai M.D., White W.D., Gan T.J. Cumulative duration of “triple low” state of low blood pressure, low bispectral index, and low minimum alveolar concentration of volatile anesthesia is not associated with increased mortality // Anesthesiology. 2014; 121: 18-28. doi: 10.1097/ALN.0000000000000281.
7. Babazade R., Yilmaz H.O., Zimmerman N.M., Stocchi L., Gorgun E., Kessler H., Sessler D.I., Kurz A., Turan A. Association between intraoperative low blood pressure and development of surgical site infection after colorectal surgery: a retrospective cohort study // Ann. Surg. 2016; 264: 1058-1064. doi: 10.1097/SLA.0000000000001607.
8. Mascha E.J., Yang D., Weiss S., Sessler D.I. Intraoperative mean arterial pressure variability and 30-day mortality in patients having noncardiac surgery // Anesthesiology. 2015; 123: 79-91. doi: 10.1097/ALN.0000000000000686.
9. Abbott T.E.F., Pearse R.M., Archbold R.A., Ahmad T., Niebrzegowska E., Wragg A., Rodseth R.N., Devereaux P.J., Ackland G.L. A prospective international multicentre cohort study of intraoperative heart rate and systolic blood pressure and myocardial injury after noncardiac surgery: results of the VISION Study // Anesth. Analg. 2018; 126: 1936-1945. doi: 10.1213/ANE.0000000000002560.
10. Monk T.G., Bronsert M.R., Henderson W.G., Mangione M.P., Sum-Ping S.T., Bentt D.R., Nguyen J.D., Richman J.S., Meguid R.A., Hammermeister K.E. Association between intraoperative hypotension and hypertension and 30-day postoperative mortality in noncardiac surgery // Anesthesiology. 2015; 123: 307-319. doi: 10.1097/ALN.0000000000000756
11. Monk T.G., Saini V., Weldon B.C., Sigl J.C. Anesthetic management and one year mortality after noncardiac surgery // Anesth. Analg. 2005; 100: 4-10. doi: 10.1213/01.ANE.0000147519.82841.5E.
12. Sessler D.I., Sigl J.C., Kelley S.D., Chamoun N.G., Manberg P.J., Saager L., Kurz A., Greenwald S. Hospital stay and mortality are increased in patients having a “triple low” of low blood pressure, low bispectral index, and low minimum alveolar concentration of volatile anesthesia // Anesthesiology. 2012; 116: 1195-1203. doi: 10.1097/ALN.0b013e31825683dc
13. Sprung J., Abdelmalak B., Gottlieb A., Mayhew C., Hammel J., Levy P.J., O’Hara P., Hertzer N.R. Analysis of risk factors for myocardial infarction and cardiac mortality after major vascular surgery // Anesthesiology. 2000; 93: 129-140.
14. Willingham M.D., Karren E., Shanks A.M., O’Connor M.F., Jacobsohn E., Kheterpal S., Avidan M.S. Concurrence of intraoperative hypotension, low minimum alveolar concentration, and low bispectral index is associated with postoperative death // Anesthesiology. 2015; 123: 775-785. doi: 10.1097/ALN.0000000000000822.
15. Pietropaoli J.A., Rogers F.B., Shackford S.R., Wald S.L., Schmoker J.D., Zhuang J. The deleterious effects of intraoperative hypotension on outcome in patients with severe head injuries // J. Trauma. 1992; 33: 403-407.
16. Reich D.L., Wood R.K. Jr, Emre S., Bodian C.A., Hossain S., Krol M., Feierman D. Association of intraoperative hypotension and pulmonary hypertension with adverse outcomes after orthotopic liver transplantation // J. Cardiothorac. Vasc. Anesth. 2003; 17: 699-702.
17. Sessler D.I., Meyhoff C.S., Zimmerman N.M. et al. Period-dependent associations between hypotension during and for four days after noncardiac surgery and a composite of myocardial infarction and death: a substudy of the POISE-2 Trial // Anesthesiology. 2018; 128: 317-327. doi: 10.1097/ALN.0000000000001985.
18. Goldman L., Caldera D.L., Southwick F.S., Nussbaum S.R., Murray B., O’Malley T.A., Goroll A.H., Caplan C.H., Nolan J., Burke D.S., Krogstad D., Carabello B., Slater E.E. Cardiac risk factors and complications in noncardiac surgery // Medicine (Baltimore). 1978; 57: 357-370.
19. Ziser A., Plevak D.J., Wiesner R.H., Rakela J., Offord K.P., Brown D.L. Morbidity and mortality in cirrhotic patients undergoing anesthesia and surgery // Anesthesiology. 1999; 90: 42-53.
20. Willingham M., Ben Abdallah A., Gradwohl S., Helsten D., Lin N., Villafranca A., Jacobsohn E., Avidan M., Kaiser H. Association between intraoperative electroencephalographic suppression and postoperative mortality // Br. J. Anaesth. 2014; 113: 1001-1008. doi: 10.1093/bja/aeu105
21. White S.M., Moppett I.K., Griffiths R., Johansen A., Wakeman R., Boulton C., Plant F., Williams A., Pappenheim K., Majeed A., Currie C.T., Grocott M.P. Secondary analysis of outcomes after 11,085 hip fracture operations from the prospective UK Anaesthesia Sprint Audit of Practice (ASAP-2) // Anaesthesia. 2016; 71: 506-514. doi: 10.1111/anae.13415
22. Cheng X.Q., Wu H., Zuo Y.M., Mei B., Zhang L., Cai Y.Z., Zhao Q., Lu X.F., Liu X.S., Gu E.W. Perioperative risk factors and cumulative duration of “triple-low” state associated with worse 30-day mortality of cardiac valvular surgery // J. Clin. Monit. Comput. 2017; 31: 387-395. doi: 10.1007/s10877-016-9856-2.
23. Devereaux P.J., Yang H., Yusuf S. et al. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (poise trial): a randomised controlled trial // Lancet. 2008; 371: 1839-1847.
24. Tassoudis V., Vretzakis G., Petsiti A., Stamatiou G., Bouzia K., Melekos M., Tzovaras G. Impact of intraoperative hypotension on hospital stay in major abdominal surgery // J Anesth. 2011; 25: 492-499. doi: 10.1007/s00540-011-1152-1.
25. Brunaud L., Nguyen-Thi P.L., Mirallie E., Raffaelli M., Vriens M., Theveniaud P.E., Boutami M., Finnerty B.M., Vorselaars W.M., Rinkes I.B., Bellantone R., Lombardi C., Fahey T. III, Zarnegar R., Bresler L. Predictive factors for postoperative morbidity after laparoscopic adrenalectomy for pheochromocytoma: a multicenter retrospective analysis in 225 patients // Surg. Endosc. 2016; 30: 1051-1059. doi: 10.1007/s00464-015-4294-7.
26. Salmasi V., Maheshwari K., Yang D., Mascha E.J., Singh A., Sessler D.I., Kurz A. Relationship between intraoperative hypotension, defined by either reduction from baseline or absolute thresholds, and acute kidney and myocardial injury after noncardiac surgery: a retrospective cohort analysis // Anesthesiology. 2017; 126: 47-65. doi: 10.1097/ALN.0000000000001432.
27. Sun L.Y., Wijeysundera D.N., Tait G.A., Beattie W.S. Association of intraoperative hypotension with acute kidney injury after elective noncardiac surgery // Anesthesiology. 2015; 123: 515-523. doi: 10.1097/ALN.0000000000000765
28. Walsh M., Devereaux P.J., Garg A.X., Kurz A., Turan A., Rodseth R.N., Cywinski J., Thabane L., Sessler D.I. Relationship between intraoperative mean arterial pressure and clinical outcomes after noncardiac surgery: toward an empirical definition of hypotension // Anesthesiology. 2013; 119: 507-515. doi: 10.1097/ALN.0b013e3182a10e26
29. Charlson M.E., MacKenzie C.R., Gold J.P., Ales K.L., Topkins M., Shires G.T. Intraoperative blood pressure. What patterns identify patients at risk for postoperative complications? // Ann. Surg. 1990; 212: 567-580.
30. Hallqvist L., Granath F., Huldt E., Bell M. Intraoperative hypotension is associated with acute kidney injury in noncardiac surgery: an observational study // Eur. J. Anaesthesiol. 2018; 35: 273-279. doi: 10.1097/EJA.0000000000000735.
31. Tallgren M., Niemi T., Poyhia R., Raininko E., Railo M., Salmenpera M., Lepantalo M., Hynninen M. Acute renal injury and dysfunction following elective abdominal aortic surgery // Eur. J. Vasc. Endovasc. Surg. 2007; 336: 550-555. doi: 10.1016/j.ejvs.2006.12.005.
32. House L.M., Marolen K.N., St Jacques P.J., McEvoy M.D., Ehrenfeld J.M. Surgical Apgar score is associated with myocardial injury after noncardiac surgery // J. Clin. Anesth. 2016; 34: 395-402. doi: 10.1016/j.jclinane.2016.05.009.
33. Kim B.H., Lee S., Yoo B., Lee W.Y., Lim Y., Kim M.C., Yon J.H., Kim K.M. Risk factors associated with outcomes of hip fracture surgery in elderly patients // Korean J. Anesthesiol. 2015; 68: 561-567. doi: 10.4097/kjae.2015.68.6.561.
34. van Waes J.A., van Klei W.A., Wijeysundera D.N., van Wolfswinkel L., Lindsay T.F., Beattie W.S. Association between intraoperative hypotension and myocardial injury after vascular surgery // Anesthesiology. 2016; 124: 35-44. doi: 10.1097/ALN.0000000000000922.
35. Alcock R.F., Kouzios D., Naoum C., Hillis G.S., Brieger D.B. Perioperative myocardial necrosis in patients at high cardiovascular risk undergoing elective non-cardiac surgery // Heart. 2012; 98: 792-798. doi: 10.1136/heartjnl-2011-301577.
36. Hallqvist L., Mårtensson J., Granath F., Sahlén A., Bell M. Intraoperative hypotension is associated with myocardial damage in noncardiac surgery: an observational study // Eur. J. Anaesthesiol. 2016; 33: 450-456. doi: 10.1097/EJA.0000000000000429
37. von Knorring J. Postoperative myocardial infarction: a prospective study in a risk group of surgical patients // Surgery. 1981; 90: 55-60.
38. Sabate S., Mases A., Guilera N., Canet J., Castillo J., Orrego C., Sabate A., Fita G., Parramуn F., Paniagua P., Rodriguez A., Sabate M.; ANESCARDIOCAT Group. Incidence and predictors of major perioperative adverse cardiac and cerebrovascular events in non-cardiac surgery // Br. J. Anaesth. 2011; 107: 879-890. doi: 10.1093/bja/aer268.
39. Charlson M.E., MacKenzie C.R., Gold J.P., Ales K.L., Topkins M., Shires G.T. Risk for postoperative congestive heart failure // Surg. Gynecol. Obstet. 1991; 172: 95-104.
40. Bijker J.B., Persoon S., Peelen L.M., Moons K.G., Kalkman C.J., Kappelle L.J., van Klei W.A. Intraoperative hypotension and perioperative ischemic stroke after general surgery: a nested case-control study // Anesthesiology. 2012; 116: 658-664. doi: 10.1097/ALN.0b013e3182472320.
41. Yocum G.T., Gaudet J.G., Teverbaugh L.A., Quest D.O., McCormick P.C., Connolly E.S. Jr, Heyer E.J. Neurocognitive performance in hypertensive patients after spine surgery // Anesthesiology. 2009; 110: 254-261. doi: 10.1097/ALN.0b013e3181942c7a.
42. Wang N.Y., Hirao A., Sieber F. Association between intraoperative blood pressure and postoperative delirium in elderly hip fracture patients // PLoS One. 2015; 10: e0123892. doi: 10.1371/journal.pone.0123892.
43. Sandid M.S., Assi M.A., Hall S. Intraoperative hypotension and prolonged operative time as risk factors for slow graft function in kidney transplant recipients // Clin. Transplant. 2006; 20: 762-768. doi: 10.1111/j.1399-0012.2006.00567.x.
44. Fumagalli U., Melis A., Balazova J., Lascari V., Morenghi E., Rosati R. Intra-operative hypotensive episodes may be associated with post-operative esophageal anastomotic leak // Updates Surg. 2016; 68: 185-190. doi: 10.1007/s13304-016-0369-9.
45. Reich D.L., Bennett-Guerrero E., Bodian C.A., Hossain S., Winfree W., Krol M. Intraoperative tachycardia and hypertension are independently associated with adverse outcome in noncardiac surgery of long duration // Anesth. Analg. 2002; 95: 273-277, table of contents.
46. Williams-Russo P., Sharrock N.E., Mattis S., Liguori G.A., Mancuso C., Peterson M.G., Hollenberg J., Ranawat C., Salvati E., Sculco T. Randomized trial of hypotensive epidural anesthesia in older adults // Anesthesiology. 1999; 91: 926-935.
47. Carrick M.M., Morrison C.A., Tapia N.M., Leonard J., Suliburk J.W., Norman M.A., Welsh F.J., Scott B.G., Liscum K.R., Raty S.R., Wall M.J. Jr, Mattox K.L. Intraoperative hypotensive resuscitation for patients undergoing laparotomy or thoracotomy for trauma: early termination of a randomized prospective clinical trial // J. Trauma Acute Care Surg. 2016; 80: 886-896. doi: 10.1097/TA.0000000000001044.
48. Futier E., Lefrant J.Y., Guinot P.G. et al.; INPRESS Study Group. Effect of individualized vs standard blood pressure management strategies on postoperative organ dysfunction among high-risk patients undergoing major surgery: a randomized clinical trial // JAMA. 2017; 318: 1346-1357. doi: 10.1001/jama.2017.14172.
49. Reich D.L., Bodian C.A., Krol M., Kuroda M., Osinski T., Thys D.M. Intraoperative hemodynamic predictors of mortality, stroke, and myocardial infarction after coronary artery bypass surgery // Anesth. Analg. 1999; 89: 814-822.
50. Gottesman R.F., Hillis A.E., Grega M.A., Borowicz L.M. Jr, Selnes O.A., Baumgartner W.A., McKhann G.M. Early postoperative cognitive dysfunction and blood pressure during coronary artery bypass graft operation // Arch. Neurol. 2007; 64: 1111-1114. doi: 10.1001/archneur.64.8.noc70028.
51. Kanji H.D., Schulze C.J., Hervas-Malo M., Wang P., Ross D.B., Zibdawi M., Bagshaw S.M. Difference between pre-operative and cardiopulmonary bypass mean arterial pressure is independently associated with early cardiac surgery-associated acute kidney injury // J. Cardiothorac. Surg. 2010; 5: 71. doi: 10.1186/1749-8090-5-71.
52. Haase M., Bellomo R., Story D., Letis A., Klemz K., Matalanis G., Seevanayagam S., Dragun D., Seeliger E., Mertens P.R., Haase-Fielitz A. Effect of mean arterial pressure, haemoglobin and blood transfusion during cardiopulmonary bypass on post-operative acute kidney injury // Nephrol. Dial. Transplant. 2012; 27: 153-160. doi: 10.1093/ndt/gfr275.
53. Ono M., Arnaoutakis G.J., Fine D.M., Brady K., Easley R.B., Zheng Y., Brown C., Katz N.M., Grams M.E., Hogue C.W. Blood pressure excursions below the cerebral autoregulation threshold during cardiac surgery are associated with acute kidney injury // Crit. Care Med. 2013; 41: 464-471. doi: 10.1097/CCM.0b013e31826ab3a1.
54. Ono M., Brady K., Easley R.B., Brown C., Kraut M., Gottesman R.F., Hogue C.W. Jr. Duration and magnitude of blood pressure below cerebral autoregulation threshold during cardiopulmonary bypass is associated with major morbidity and operative mortality // J. Thorac. Cardiovasc. Surg. 2014; 147: 483- 489. doi: 10.1016/j.jtcvs.2013.07.069.
55. Sickeler R., Phillips-Bute B., Kertai M.D., Schroder J., Mathew J.P., Swaminathan M., Stafford-Smith M. The risk of acute kidney injury with co-occurrence of anemia and hypotension during cardiopulmonary bypass relative to anemia alone // Ann. Thorac. Surg. 2014; 97: 865-871. doi: 10.1016/j.athoracsur.2013.09.060.
56. Hori D., Brown C., Ono M., Rappold T., Sieber F., Gottschalk A., Neufeld K.J., Gottesman R., Adachi H., Hogue C.W. Arterial pressure above the upper cerebral autoregulation limit during cardiopulmonary bypass is associated with postoperative delirium // Br. J. Anaesth. 2014; 113: 1009-1017. doi: 10.1093/bja/aeu319.
57. Wesselink E.M., Kappen T.H., van Klei W.A., Dieleman J.M., van Dijk D., Slooter A.J. Intraoperative hypotension and delirium after on-pump cardiac surgery // Br. J. Anaesth. 2015; 115: 427-433. doi: 10.1093/bja/aev256.
58. Kandler K., Jensen M.E., Nilsson J.C., Møller C.H., Steinbrьchel D.A. Arterial pressure during cardiopulmonary bypass is not associated with acute kidney injury // Acta Anaesthesiol. Scand. 2015; 59: 625-631. doi: 10.1111/aas.12484.
59. Hori D., Hogue C., Adachi H., Max L., Price J., Sciortino C., Zehr K., Conte J., Cameron D., Mandal K. Perioperative optimal blood pressure as determined by ultrasound tagged near infrared spectroscopy and its association with postoperative acute kidney injury in cardiac surgery patients // Interact. Cardiovasc. Thorac. Surg. 2016; 22: 445-451. doi: 10.1093/icvts/ivv371.
60. Gottesman R.F., Sherman P.M., Grega M.A., You-sem D.M., Borowicz L.M. Jr, Selnes O.A., Baumgartner W.A., McKhann G.M. Watershed strokes after cardiac surgery: diagnosis, etiology, and outcome // Stroke. 2006; 37: 2306-2311. doi: 10.1161/01.STR.0000236024.68020.3a.
61. Gold J.P., Charlson M.E., Williams-Russo P., Szatrowski T.P., Peterson J.C., Pirraglia P.A., Hartman G.S., Yao F.S., Hollenberg J.P., Barbut D. Improvement of outcomes after coronary artery bypass. A randomized trial comparing intraoperative high versus low mean arterial pressure // J. Thorac. Cardiovasc. Surg. 1995; 110: 1302-1311; discussion 1311. doi: 10.1016/S0022-5223(95)70053-6.
62. Siepe M., Pfeiffer T., Gieringer A., Zemann S., Benk C., Schlensak C., Beyersdorf F. Increased systemic perfusion pressure during cardiopulmonary bypass is associated with less early postoperative cognitive dysfunction and delirium // Eur. J. Cardiothorac. Surg. 2011; 40: 200-207. doi: 10.1016/j.ejcts.2010.11.024.
63. Charlson M.E., Peterson J.C., Krieger K.H., Hartman G.S., Hollenberg J.P., Briggs W.M., Segal A.Z., Parikh M., Thomas S.J., Donahue R.G., Purcell M.H., Pirraglia P.A., Isom O.W. Improvement of outcomes after coronary artery bypass II: a randomized trial comparing intraoperative high versus customized mean arterial pressure // J. Card. Surg. 2007; 22: 465-472. doi: 10.1111/j.1540-8191.2007.00471.x.
64. Azau A., Markowicz P., Corbeau J.J., Cottineau C., Moreau X., Baufreton C., Beydon L. Increasing mean arterial pressure during cardiac surgery does not reduce the rate of postoperative acute kidney injury // Perfusion. 2014; 29: 496-504. doi: 10.1177/0267659114527331.
65. Vedel A.G., Holmgaard F., Rasmussen L.S., Langkilde A., Paulson O.B., Lange T., Thomsen C., Olsen P.S., Ravn H.B., Nilsson J.C. High-target versus low-target blood pressure management during cardiopulmonary bypass to prevent cerebral injury in cardiac surgery patients: a randomized controlled trial // Circulation. 2018; 137: 1770-1780. doi: 10.1161/CIRCULATIONAHA.117.030308.
66. Sposato L.A., Suárez A., Jáuregui A., Riccio P.M., Altounian M., Andreoli M.G., Rodriguez A.I., Ressia J.F., Bressan G.J., Klein F.R., Raffaelli H., Bozovich G.E. Intraoperative hypotension, new onset atrial fibrillation, and adverse outcome after carotid endarterectomy // J. Neurol .Sci. 2011; 309: 5-8. doi: 10.1016/j.jns.2011.07.052.
67. Heyer E.J., Mergeche J.L., Anastasian Z.H., Kim M., Mallon K.A., Connolly E.S. Arterial blood pressure management during carotid endarterectomy and early cognitive dysfunction // Neurosurgery. 2014; 74: 245-251; discussion 251. doi: 10.1227/NEU.0000000000000256.
68. Howell M., Krajcer Z., Dougherty K., Strickman N., Skolkin M., Toombs B., Paniagua D. Correlation of periprocedural systolic blood pressure changes with neurological events in high-risk carotid stent patients // J. Endovasc. Ther. 2002; 9: 810-816. doi: 10.1177/152660280200900614.
69. Tan T.W., Eslami M.H., Kalish J.A., Eberhardt R.T., Doros G., Goodney P.P., Cronenwett J.L., Farber A.; Vascular Study Group of New England. The need for treatment of hemodynamic instability following carotid endarterectomy is associated with increased perioperative and 1-year morbidity and mortality // J. Vasc. Surg. 2014; 59: 16.e1-24.e1. doi: 10.1016/j.jvs.2013.07.025.
70. Chang H.S., Hongo K., Nakagawa H. Adverse effects of limited hypotensive anesthesia on the outcome of patients with subarachnoid hemorrhage // J. Neurosurg. 2000; 92: 971-975. doi: 10.3171/jns.2000.92.6.0971.
71. Kett-White R., Hutchinson P.J., Al-Rawi P.G., Czosnyka M., Gupta A.K., Pickard J.D., Kirkpatrick P.J. Cerebral oxygen and microdialysis monitoring during aneurysm surgery: effects of blood pressure, cerebrospinal fluid drainage, and temporary clipping on infarction // J. Neurosurg. 2002; 96: 1013-1019. doi: 10.3171/jns.2002.96.6.1013.
72. Hoff R.G., VAN Dijk G.W., Mettes S., Verweij B.H., Algra A., Rinkel G.J., Kalkman C.J. Hypotension in anaesthetized patients during aneurysm clipping: not as bad as expected? // Acta Anaesthesiol. Scand. 2008; 52: 1006-1011. doi: 10.1111/j.1399-6576.2008.01682.x.
73. Priebe H.J. Aneurysmal subarachnoid haemorrhage and the anaesthetist // Br. J. Anaesth. 2007; 99: 102-118. doi: 10.1093/bja/aem119.
74. Powers W.J., Rabinstein A.A., Ackerson T. et al; American Heart Association Stroke Council. 2018 guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association // Stroke. 2018; 49: e46-e110. doi: 10.1161/STR.0000000000000158.
75. Morgan M.K., Wiedmann M.K.H., Assaad N.N.A., Parr M.J.A., Heller G.Z. Deliberate employment of postoperative hypotension for brain arteriovenous malformation surgery and the incidence of delayed postoperative hemorrhage: a prospective cohort study // J. Neurosurg. 2017; 127: 1025-1040. doi: 10.3171/2016.9.JNS161333.
76. Morrison C.A., Carrick M.M., Norman M.A., Scott B.G., Welsh F.J., Tsai P., Liscum K.R., Wall M.J. Jr, Mattox K.L. Hypotensive resuscitation strategy reduces transfusion requirements and severe postoperative coagulopathy in trauma patients with hemorrhagic shock: preliminary results of a randomized controlled trial // J. Trauma. 2011; 70: 652-663. doi: 10.1097/TA.0b013e31820e77ea.
77. Meng L., Gruenbaum S.E., Dai F., Wang T. Physiology, intervention, and outcome: three critical questions about cerebral tissue oxygen saturation monitoring // Minerva Anestesiol. 2018; 84: 599-614. doi: 10.23736/S0375-9393.18.12476-X.
78. Bickler P., Feiner J., Rollins M., Meng L. Tissue oximetry and clinical outcomes // Anesth. Analg. 2017; 124: 72-82. doi: 10.1213/ANE. 0000000000001348.
79. Meng L., Heerdt P.M. Perioperative goal-directed haemodynamic therapy based on flow parameters: a concept in evolution // Br. J. Anaesth. 2016; 117(suppl 3): iii3–iii17. doi: 10.1093/bja/aew363.
80. Cowie D.A., Shoemaker J.K., Gelb A.W. Orthostatic hypotension occurs frequently in the first hour after anesthesia // Anesth. Analg. 2004; 98: 40-45, table of contents.
81. Hans S.S., Glover J.L. The relationship of cardiac and neurological complications to blood pressure chan-ges following carotid endarterectomy // Am. Surg. 1995; 61:
356-359.
82. Block F.E .Jr. Normal fluctuation of physiologic cardiovascular variables during anesthesia and the phenomenon of “smoothing” // J. Clin. Monit. 1991; 7: 141-145.
83. Epstein R.H., Dexter F., Schwenk E.S. Hypotension during induction of anaesthesia is neither a reliable nor a useful quality measure for comparison of anaesthetists’ performance // Br. J. Anaesth. 2017; 119: 106-114. doi: 10.1093/bja/aex153.
84. Bijker J.B., van Klei W.A., Kappen T.H., van Wolfswinkel L., Moons K.G., Kalkman CJ. Incidence of intraoperative hypotension as a function of the chosen definition: literature definitions applied to a retrospective cohort using automated data collection // Anesthesiology. 2007; 107: 213-220. doi: 10.1097/01.anes.0000270724.40897.8e.

/72-1.jpg)
/73-1.jpg)
/74-1.jpg)
/75-1.jpg)
/76-1.jpg)
/78-1.jpg)
/79-1.jpg)