Журнал «Почки» Том 8, №2, 2019
Вернуться к номеру
Можливості сучасної протирецидивної терапії інфекцій сечових шляхів у дітей: дослідження CRUTIL
Авторы: Іванов Д.Д.(1), Іванова Т.П.(2), Федоренко О.Г.(3) , Кушніренко С.В.(1), Іванова М.Д.(4)
(1) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(2) — НДСЛ «ОХМАТДИТ», м. Київ, Україна
(3) — Медична практика проф. Д. Іванова, м. Київ, Україна
(4) — Università degli Studi di Milano-Bicocca, м. Мілан, Італія
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
Актуальність. Рецидивуючі інфекції сечового тракту становлять серйозну проблему в дитячій нефрології, впливаючи на якість життя й збільшуючи навантаження на систему охорони здоров’я. Облік індивідуальних чинників і розробка підходів до протирецидивної терапії, особливо в дітей без видимих об’єктивних причин рецидиву інфекції, є актуальним завданням. Матеріали та методи. Проспективне відкрите багатоцентрове рандомізоване в паралельних групах дослідження CRUTIL (Children’s Recurrent Urinary Tract Infections on bacteria Lysate) проводили за участі 83 дітей віком від 3 до 15 років (8,0 ± 2,2 року) із рецидивуючими інфекціями сечового тракту. Діти були рандомізовані на 3 групи: перша — 22 дитини, які одержували додаткову терапію лізатом Urivac, друга — 28 дітей, які отримували додаткову терапію лізатом Uro-Vaxom, і третя (контрольна) — 33 дитини, які отримували стандартну терапію. Тривалість імуноактивної терапії становила 6 місяців, пацієнти цих груп також отримували протирецидивне лікування одноразовою дозою уроантисептика на ніч протягом 18 місяців; тривалість спостереження становила 24 місяці. Результати. У першій групі дітей, які отримували 6-валентну вакцину з лізатів бактерій Urivac, безрецидивний перебіг до кінця дослідження спостерігався у 87 % (19 дітей). У групі, що отримувала монолізати бактерій Uro-Vaxom, безрецидивний перебіг спостерігався у 72 % (20 дітей) (співвідношення шансів (СШ) 2,5; P > 0,05, мінімальне значення очікуваного явища — 4,84). Серед тих, хто не отримував уроантисептики на ніч і лізати бактерій, безрецидивний перебіг документували в 13 дітей (40 %) (Р ≤ 0,05, СШ = 0,26 із групою 6-валентної вакцини). 15% підвищення ефективності при використанні 6-валентного лізату бактерій було отримане за рахунок елімінації Pseudomonas aeruginosa й Enterococcus faecalis. Надалі з 24-го по 30-й місяць спостереження в групі Uro-Vaxom ще 3 дітей мали рецидив (P ≤ 0,05 з групою, яка отримувала Urivac). Висновки. Лізати бактерій істотно підвищують ефективність терапії при рецидивуючих інфекціях сечового тракту в дітей. Найкращі результати у формуванні безрецидивного перебігу рецидивуючих інфекцій сечового тракту демонструє призначення профілактичної дози уроантисептика одноразово на ніч і застосування 6-валентної вакцини Urivac.
Актуальность. Рецидивирующие инфекции мочевого тракта представляют серьезную проблему в детской нефрологии, влияя на качество жизни и увеличивая нагрузку на систему здравоохранения. Учет индивидуальных факторов и разработка подходов к противорецидивной терапии, особенно у детей без видимых объективных причин для рецидива инфекции, является актуальной задачей современной нефрологии. Материалы и методы. Проспективное открытое многоцентровое рандомизированное в параллельных группах исследование CRUTIL (Children’s Recurrent Urinary Tract Infections on bacteria Lysate) проведено у 83 детей в возрасте от 3 до 15 лет (8,0 ± 2,2 года) с рецидивирующими инфекциями мочевого тракта. Дети были рандомизированы на 3 группы: первая — 22 ребенка, получавших дополнительную терапию лизатом Urivac, вторая — 28 детей, получавших дополнительную терапию лизатом Uro-Vaxom, и третья (контрольная) — 33 ребенка, получавших стандартную терапию. Продолжительность иммуностимулирующей терапии составила 6 месяцев, пациенты этих групп также получали противорецидивное лечение однократной дозой уроантисептика на ночь в течение 18 месяцев, продолжительность наблюдения составила 24 месяца. Результаты. В первой группе детей, получавших 6-валентную вакцину лизатов бактерий Urivac, безрецидивное течение к окончанию исследования наблюдалось у 87 % (19 детей). В группе, получавшей монолизаты бактерий Uro-Vaxom, безрецидивное течение наблюдалось у 72 % (20 детей) (отношение шансов (ОШ) 2,5; P > 0,05; минимальное значение ожидаемого явления — 4,84). Среди тех, кто не получал уроантисептики на ночь и лизаты бактерий, безрецидивное течение документировали у 13 детей (40 %) (р ≤ 0,05; OШ = 0,26 с группой 6-валентной вакцины). 15% повышение эффективности при использовании 6-валентного лизата бактерий было получено за счет элиминации Pseudomonas aeruginosa и Enterococcus faecalis. В дальнейшем с 24-го по 30-й месяц наблюдения в группе Uro-Vaxom еще 3 детей имели рецидив (P ≤ 0,05 с группой, получавшей Urivac). Выводы. Лизаты бактерий существенно повышают эффективность терапии при рецидивирующих инфекциях мочевого тракта у детей. Лучшие результаты в формировании безрецидивного течения рецидивирующих инфекций мочевого тракта демонстрирует назначение профилактической дозы уроантисептика однократно на ночь и применение 6-валентной вакцины Urivac.
Background. Recurrent urinary tract infection (UTI) is a serious problem in pediatric nephrology, affecting the quality of life and increasing the burden on the health system. Consideration of individual factors and the development of approaches to anti-relapse therapy, especially in children without apparent objective reasons for the relapse of infection, is an urgent task. Materials and methods. A prospective, multicentre, randomized, parallel-group, open-label CRUTIL (Children’s Recurrent Urinary Tract Infections on bacterial Lysate) study was conducted, it included 83 children aged 3 to 15 years (8.0 ± 2.2 years) with recurrent UTI. The children were randomized into 3 groups: the first one — 22 patients who received supplementary therapy with Urivac lysate, the second one — 28 children who received supplementary therapy with Uro-Vaxom lysate, and the third group (controls) — 33 patients who received standard therapy. Duration of immunoactive therapy was 6 months, patients of these groups also received anti-relapse treatment with a single dose of urinary antiseptic at bedtime for 18 months; follow-up was 24 months. Results. In the first group of children who received Urivac, a 6-valent vaccine from bacterial lysates, a non-recurrent course to the end of the study was observed in 19 patients (87 %). In the group receiving Uro-Vaxom bacterial monolysates, 20 children (72 %) had non-recurrent course (odds ratio (OR) = 2.5; P > 0.05; the minimum expected effect was 4.84). Among those who did not receive urinary antiseptic at bedtime and bacterial lysates, the non-recurrent course was reported in 13 children (40 %) (P ≤ 0.05, OR = 0.26 with a 6-valent vaccine group). A 15% improvement in the effectiveness was obtained due to elimination of Pseudomonas aeruginosa and Enterococcus faecalis when using a 6-valent bacterial lysate. Subsequently, from 24 to 30 months of follow-up, 3 more children in the Uro-Vaxom group had a relapse (P ≤ 0.05 with the Urivac group). Conclusions. Bacterial lysates significantly increase the effectiveness of therapy for recurrent urinary tract infections in children. The best results in the formation of a non-recurrent course of relapsing UTI were obtained when using a prophylactic dose of urinary antiseptic once at bedtime and a 6-valent Urivac vaccine.
рецидивуючі інфекції сечових шляхів у дітей; індустріальні лізати бактерій; Urivac; Uro-Vaxom; подальше спостереження при інфекціях сечового тракту
рецидивирующие инфекции мочевых путей у детей; индустриальные лизаты бактерий; Urivac; Uro-Vaxom; последующее наблюдение при инфекциях мочевого тракта
recurrent urinary tract infections in children; industrial bacterial lysates; Urivac; Uro-Vaxom; follow-up in urinary tract infections
Вступ
Рецидивуючі інфекції сечового тракту (ІСТ; recurrent urinary tract infections) у дітей є серйозною проблемою в сучасній дитячій нефрології [1]. Умовно ІСТ можна розподілити на 2 групи. Перша група — повторні інфекції в дітей з аномаліями органів сечової системи (синдром CAKUT), що частіше перебігають як інфекції верхніх сечових шляхів (пієлонефрит) і належать до групи хронічних інфекцій [2]. Друга група — ІСТ, в основі яких немає порушень уродинаміки, вони зазвичай класифікуються як незакінчені й клінічно перебігають як інфекції нижніх сечових шляхів (цистит) [3]. При незакінченій інфекції початкової терапії недостатньо для усунення бактеріального розмноження в сечовивідних шляхах (невідповідна терапія, невідповідна протимікробна концентрація сечі (погана ниркова концентрація/шлунково-кишкова мальабсорбція), а також інфекції, що включають декілька організмів із різною протимікробною чутливістю, і стійкість до антибіотиків) [2, 4]. Діти без синдрому CAKUT викликають значний клінічний інтерес, зважаючи на відсутність об’єктивної причини для рецидивів, однак нерідко мають незакінчені інфекції [5] і безсимптомний перебіг [6]. Рецидивуючий перебіг інфекцій може призвести до утворення рубців і поступової втрати функції нирок [7, 8].
Частота рецидивування ІСТ у дітей може змінюватися залежно від демографічних характеристик. У регіоні, де було проведене наведене нижче дослідження, частота рецидивуючих ІСТ становить до 15 % від усіх ІСТ [9].
Керівні положення Європейської асоціації урологів (2018) рекомендують антибіотико- й імунопрофілактику для лікування рецидивуючих інфекцій сечового тракту. Довгострокову антибактеріальну профілактику слід розглядати у випадках високої схильності до ІСТ і ризику набутого ураження нирок: два нещодавно опубліковані проспективні рандомізовані дослідження, а також один метааналіз продемонстрували значне зниження ризику розвитку нової ІСТ у результаті безперервної антибіотикопрофілактики [2].
Кокранівська база даних систематичних оглядів стверджує: довгостроковий прийом антибіотиків, як видається, знижує ризик повторної симптоматики ІСТ у схильних дітей, але користь невелика, втрачається при виведенні антибіотиків і має розглядатися разом з підвищеним ризиком резистентності мікроорганізмів [10].
Сік журавлини й пробіотики також може запобігти рецидиву ІСТ [11]. Імунопрофілактика дає більш стійкий ефект, вона може проводитися індустріально приготованими бактеріальними лізатами, наприклад Uro-Vaxom, і бактеріальними автолізатами. Останні більш ефективні, але вони інвазивні й мають більшу кількість побічних ефектів [3].
Наведені дані свідчать про те, що на сьогодні ще не сформульований універсальний ефективний підхід, який дозволив би повністю припинити рецидивування ІСТ [9].
Метою цього дослідження була порівняльна оцінка ефективності протирецидивної терапії ІСТ у дітей шляхом застосування індустріально приготованих лізатів бактерій у вигляді вакцин Uro-Vaxom і Urivac.
Матеріали та методи
Дизайн
Проспективне відкрите багатоцентрове рандомізоване в паралельних групах дослідження CRUTIL (Children’s Recurrent Urinary Tract Infections on bacterial Lysate) було проведене за участі 83 дітей віком від 3 до 15 років (8,0 ± 2,2 року) із рецидивуючими ІСТ у трьох сертифікованих медичних центрах м. Києва (Україна) у період із 2016 по 2018 рік. Діагноз ІСТ був верифікований згідно з критеріями EAU, 2016–2018 [2]. Тривалість дослідження становила 18 місяців + 6 місяців подальшого спостереження після відміни терапії (табл. 1).
Критерії включення в дослідження: наявність рецидивуючої ІСТ (2 епізоди за 6 місяців або 3 епізоди протягом року). Метод відбору пацієнтів: добровільна участь за згодою батьків. Рандомізація проводилася методом випадкових чисел, набір спирався на рекомендації ВООЗ [12].
Критерії виключення: візуальні аномалії органів сечового тракту, носійство Chlamydia Trachomatis, Ureaplasma Urealiticum, Mycoplasma genitalium, Trichomonas Vaginalis, наявність запальних захворювань зовнішніх статевих органів.
Первинна кінцева точка: число дітей із безрецидивним перебігом ІСТ.
Вторинна кінцева точка: збереження безсимптомної бактеріурії, що класифікується як відсутність клінічних симптомів ІСТ, лейкоцитурії при бактеріурії понад 10 000 КУО/мл (103 КУО/мл).
Протокол дослідження
83 дитини були рандомізовані на 3 групи: перша (UC) — 22 дитини, друга (UM) — 28 дітей, третя (контрольна) — 33 дитини (рис. 1, 2).
Uro-Vaxom складається з лізату бактерій Escherichia coli, 6 мг в одній капсулі, до складу Urivac 5 мг входять лізати: Propionibacterium acnes lysatum cryodessicatum (ССМ 7083) — 1,66 мг, Klebsiella pneumoniae lysatum cryodessicatum (ССМ 7589) — 0,67 мг, Pseudomonas aeruginosa lysatum cryodessicatum (ССМ 7590) — 0,67 мг, Enterococcus faecalis lysatum cryodessicatum (ССМ 7591) — 0,67 мг, Escherichia coli lysatum cryodessicatum (ССМ 7593) — 0,67 мг, Proteus mirabilis lysatum cryodessicatum (ССМ 7592) — 0,67 мг. ССМ — Catalog of Сultures of Microorganisms (довідник культур мікроорганізмів). Діти в усіх групах отримували стандартне лікування в разі загострення ІСТ відповідно до рекомендацій EAU [1, 2].
Групи дітей з ІСТ, порівнянні за віком, отримували лізати бактерій Uro-Vaxom (група UM, n = 28, протягом 6 місяців (90 днів вранці натще по одній капсулі і ще 90 днів по 10 днів на місяць), потім був рекомендований курс по 30 днів один раз на півроку) та Urivac (група UC, n = 22, протягом 6 місяців (по 10 днів кожного місяця вранці натще по одній капсулі), потім був рекомендований курс по 10 днів один раз на півроку). Крім того, пацієнти цих груп також отримували протирецидивне лікування одноразовою дозою уроантисептика на ніч протягом 18 місяців. Ці препарати були офіційно затверджені в Україні для застосування при рецидивуючих ІСТ. Пацієнт може придбати цей лікарський засіб офіційно в аптеці для особистого користування за рецептом лікаря. Дозування буде відповідним чином індивідуалізоване лікарем.
Контрольну групу становили 33 дитини з ІСТ, які не отримували уроантисептик і бактеріальні лізати після проведеного лікування інфекції сечового тракту.
Статистичні методи
Дані будуть введені й проаналізовані з використанням відповідних статистичних заходів. Категорійні дані були подані у вигляді кількості й відсотка. Безперервні дані подані як середнє й стандартне відхилення (SD), якщо вони нормально розподілені, або як середній і міжквартильний діапазон (IQR), якщо вони не розподілені нормально. Для порівняння середнього значення й медіани використовується t-критерій Стьюдента. Множинна логістична регресія використовується для оцінки скорегованого ризику побічних ефектів і серцево-судинних ризиків. Р-значення нижче від 0,05 вважається значущим.
Результати
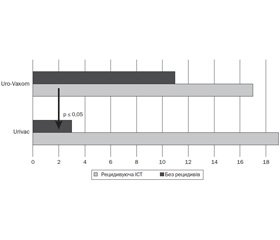
У першій групі, що отримувала 6-валентну вакцину Urivac, безрецидивний перебіг до кінця дослідження спостерігався у 87 % (19 дітей). У групі, що отримувала монолізати бактерій Uro-Vaxom, безрецидивний перебіг спостерігали в 72 % (20 дітей) (співвідношення шансів (СШ) 2,5; точний критерій Фішера (двосторонній) — 0,30622; P > 0,05; мінімальне значення очікуваного явища — 4,84). Серед пацієнтів, які одержували уроантисептики на ніч і лізати бактерій, безрецидивний перебіг документували в 13 дітей (40 %) (Р ≤ 0,05; СШ = 0,26 із групою 6-валентної вакцини Urivac). 15% підвищення ефективності при застосуванні 6-валентної вакцини було отримане за рахунок елімінації Pseudomonas aeruginosa й Еnterococcus faecalis (рис. 4).
Подальше спостереження протягом 6 місяців показало формування вірогідної статистичної відмінності між групами дітей, які отримували лізати бактерій (рис. 5). Так, у групі UM із 28 дітей в 11 до кінця другого року спостереження відзначався безрецидивний перебіг, а 17 мали рецидив. Навпаки, у групі UC із 22 дітей 19 мали безрецидивний перебіг, а 3 мали рецидив. Статистичні характеристики наведено в табл. 1.
Обговорення
У нашій клініці прийнятий алгоритм, що передбачає виключення факторів ризику, які, можливо, є причинами рецидивування ІСТ, і оцінюється ретельність виконання батьками раніше сформульованих призначень [13–15]. При повторному епізоді ІСТ дитину консультує дитячий гінеколог або уролог для виключення запальних захворювань зовнішніх статевих органів (вульвіт, вульвовагініт, баланопостит на тлі фімозу), проводиться цистоуретрографія під час сечовипускання й ультразвукове дослідження (у разі потреби — магнітно-резонансна томографія) для виключення обструктивного характеру ІСТ, виконується серологічний аналіз на носійство інфекцій Chlamydia trachomatis, Ureaplasma urealiticum, Mycoplasma genitalium, Trichomonas vaginalis шляхом дослідження наявності титрів IgG до вказаних мікроорганізмів, що мають бути відсутні в здорових дітей. Виключення факторів ризику вимагає індивідуалізації лікувального підходу [9].
Використовувана сьогодні схема ведення дітей із рецидивуючими ІСТ передбачає досягнення стерильності сечі при лікуванні уроантисептиком (посів сечі виконується до призначення антимікробного препарату й на 6-й день його прийому для оцінки ерадикації збудника), призначення профілактичної дози уроантисептика на ніч (фурагіну магнієва сіль, ніфурател, триметоприм/сульфаметоксозол) і проведення імунопрофілактики лізатом бактерій [9, 16–18].
Дослідження CRUTIL продемонструвало високу ефективність обох використовуваних лізатів. При цьому більш стійкий ефект спостерігали при призначенні Urivac. Механізм дії Urivac спрямований на швидке включення адаптивної (набутої) імунної відповіді при локальному запаленні через активацію MALT-системи: збільшення активності макрофагів і Т-лімфоцитів, підвищення концентрації секреторного IgA на поверхні слизових сечовивідних шляхів і активацію утворення захисних адгезивних молекул [19]. Очевидно, краща ефективність Urivac обумовлена великим охопленням причинних збудників і законом посилення відповіді при збільшенні суми подразнень [20].
Загальновідомо, що ІСТ викликаються переважно E.сoli, на той час як інші грамнегативні бацили, а саме Klebsiella, Proteus, Enterobacter, Citrobacter, Serratia, Pseudomonas, грампозитивні коки Enterococci, Staphylococcus epidermidis, Streptococcus faecalis, Streptococcus saprophyticus, а також Chlamydia trachomatis частіше зустрічаються при ускладнених інфекціях і рецидивуючих інфекціях сечового тракту [21, 22]. Розширення спектра антигенів у складі імунотерапії дозволяє досягати кращого результату. Дійсно, до моменту написання статті спостереження після закінчення лікування тривало вже рік [23]. Подальший індивідуальний підхід до призначення лізатів показав низьку ефективність щоденного прийому протягом місяця й більш стійкий ефект при прийомі Urivac по 10 днів на місяць протягом 6 місяців. У групі UC не спостерігали жодного рецидиву в наступні 6 місяців. Навпаки, у групі UM ще 3 дитини мали рецидив (P ≤ 0,05).
Очевидно, що ефективність лікування з використанням пробіотиків [24, 25], препаратів журавлини [26], як і раціональна терапія антибіотиками [27], багато в чому залежать від регіональних умов їх застосування [28].
Досвід дослідження CRUTIL дозволив сформувати схеми терапії вакциною Urivac у різних клінічних ситуаціях:
— 10 днів по 1 капсулі натще — терапія активації запальної відповіді з метою швидкого переривання запального процесу паралельно з антибіотиками/уроантисептиками, оскільки до складу Urivac входять інактивовані збудники, схема рекомендована в гострий період;
— три цикли: 10 днів по 1 капсулі натще, 20 днів перерви — терапія ефективного завершення локального запалення з метою запобігання повторним епізодам у пацієнтів, в анамнезі яких були епізоди неускладненої ІСТ;
— шість циклів: 10 днів по 1 капсулі натще, 20 днів перерва — терапія, спрямована проти персистенції збудника, рекомендована з протирецидивною метою в пацієнтів із хронічними рецидивуючими ІСТ.
Значення дослідження CRUTIL для пацієнтів полягало в тому, що крім лікування відповідно до міжнародних протоколів діти отримували індивідуалізовану терапію індустріальними лізатами бактерій з метою забезпечення безрецидивного перебігу. Значення його для фахівців полягає в тому, що виявлена порівняльна ефективність протирецидивної терапії за допомогою індустріальних лізатів бактерій. При цьому стали зрозумілі слабкі місця такої терапії, а саме: невизначеність тривалості терапії в цілому й доцільність підвищення ефективності лікування за рахунок безперервного місячного курсу Uro-Vaxom на відміну від курсів Urivac, що тривають 10 днів на місяць протягом трьох місяців.
Висновки
1. Вакцинація є обґрунтованою при рецидивуючих ІСТ у дітей.
2. Тривала профілактика одноразовою дозою уроантисептика перед сном може бути поєднана із застосуванням лізатів бактерій натще вранці.
3. Будь-яка мікробна асоціація з E.сoli підходить для шестивалентної вакцини проти Klebsiella pneumonia, Pseudomonas aeruginosa, Enterococcus faecalis і Proteus mirabilis. При 15 % випадків терапевтичних невдач через етіологію, не пов’язану з E.сoli, можна успішно застосовувати шестивалентну вакцину.
4. 1,5–2-річне керування перебігом із 6-місячним подальшим спостереженням при рецидивуючих інфекціях сечового тракту показує довгострокову користь Urivac.
5. Шестивалентний лізат бактерій підвищує безрецидивний перебіг інфекції сечового тракту в дітей (до 87 %) і має переваги щодо зручності застосування.
Обмеження. Інструкції до препаратів Uro-Vaxom і Urivac не передбачають подальшу терапію лізатами бактерій у тривалому спостереженні за пацієнтами. Дослідження CRUTIL свідчить про доцільність продовження призначення лізатів бактерій для стійкої відповіді організму при рецидивуючих інфекціях сечового тракту.
Конфлікт інтересів. Автор отримав грошові винагороди від виробників Uro-Vaxom і Urivac. Автори заявляють, що вони не мають конфлікту інтересів.
Дотримання етичних стандартів. Дані були частково подані Дмитром Івановим як усна презентація «Можливості сучасної протирецидивної терапії інфекцій сечових шляхів у дітей» під час 51-ї щорічної наукової зустрічі ESPN 4 жовтня 2018 року в Анталії, Туреччина.
Схвалення етичного комітету. Усі процедури, що виконуються в дослідженнях, які проводяться за участі людей, відповідали етичним стандартам дослідницького комітету закладу та/або національного дослідницького комітету, а також Гельсінської декларації 1964 року та її пізніших поправок або порівнянних етичних стандартів. Батьки й пацієнти надавали усну згоду.
Рецензенти: проф. Бережний В.В., проф. Одинець Ю.В.
Отримано 18.02.2019,
отримано у виправленому вигляді 07.03.2019,
прийнято до друку 11.03.2019
1. National Library of Medicine, or “Vancouver style” (International Committee of Medical Journal Editors): DynaMed Plus [Internet]. — Ipswich (MA): EBSCO Information Services, 1995. — Record No. 115591, Urinary tract infection (UTI) in children; [updated 2018 Jul 23]. — http://www.dynamed.com/topics/dmp~AN~T115591/Urinary-tract-infection-UTI-in-children#Complications-and-Prognosis.
2. Radmayr C., Bogaert G., Dogan H.S., Kočvara R., Nijman J.M. et al. Paеdiatric urology. — https://uroweb.org/guideline/paediatric-urology/#3_8_2.
3. Chang S.J. et al. Elevated postvoid residual urine volume predicting recurrence of urinary tract infections in toilet-trained children // Pediatr. Nephrol. — 2015. — 30. — 1131. — https://www.ncbi.nlm.nih.gov/pubmed/25673516.
4. Koyle M.A., Shifrin D. Issues in febrile urinary tract infection management // Pediatr. Clin. North Am. — 2012 Aug. — 59(4). — 909-22.
5. Craig J.C. et al. The accuracy of clinical symptoms and signs for the diagnosis of serious bacterial infection in young febrile children: prospective cohort study of 15 781 febrile illnesses // BMJ. — 2010. — 340. — c1594. — https://www.ncbi.nlm.nih.gov/pubmed/
20406860.
6. Kass E.H. Asymptomatic infections of the urinary tract // Trans. Assoc. Am. Physicians. — 1956. — 69. — 56. — https://www.ncbi.nlm.nih.gov/pubmed/13380946.
7. Chang S.L., Shortliffe L.D. Pediatric urinary tract infections // Pediatr. Clin. North Am. — 2006 Jun. — 53(3). — 379-400.
8. Karavanaki K.A. et al. Delayed treatment of the first febrile urinary tract infection in early childhood increased the risk of renal scarring // Acta Paediatr. — 2017. — 106. — 149. — https://www.ncbi.nlm.nih.gov/pubmed/27748543.
9. Іванов Д.Д., Корг О.М. Нефрологія у практиці сімейного лікаря: Підручник. — Донецьк: Заславський, 2014.
10. Williams G., Craig J.C. Long-term antibiotics for preventing recurrent urinary tract infection in children. Cochrane Systematic Review — Intervention Version published: 16 March 2011 Long-term antibiotics appear to reduce the risk of repeat symptomatic UTI in susceptible children but the benefit is small and must be considered together with the increased risk of microbial resistance. — https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001534.pub3/full?highlightAbstract=uti&highlightAbstract=children&highlightAbstract=in&highlightAbstract=child.
11. Afshar K. et al. Cranberry juice for the prevention of pediatric urinary tract infection: a randomized controlled trial // J. Urol. — 2012. — 188. — 1584. — https://www.ncbi.nlm.nih.gov/pubmed/22910239.
12. http://www.who.int/rpc/research_ethics/informed_consent/en.
13. Spencer J.D. et al. The accuracy and health risks of a voiding cystourethrogram after a febrile urinary tract infection //
J. Pediatr. Urol. — 2012. — 8. — 72. — https://www.ncbi.nlm.nih.gov/pubmed/21126919.
14. Tullus K. Difficulties in diagnosing urinary tract infections in small children // Pediatr. Nephrol. — 2011. — 26. — 1923. — https://www.ncbi.nlm.nih.gov/pubmed/21773821.
15. Tosif S. et al. Contamination rates of different urine collection methods for the diagnosis of urinary tract infections in young children: an observational cohort study // J. Paediatr. Child Health. — 2012. — 48. — 659. — https://www.ncbi.nlm.nih.gov/pubmed/22537082.
16. Pennesi M. et al. Is antibiotic prophylaxis in children with vesicoureteral reflux effective in preventing pyelonephritis and renal scars? A randomized, controlled trial // Pediatrics. — 2008. — 121. — e1489. — https://www.ncbi.nlm.nih.gov/pubmed/18490378.
17. Tratselas A. et al. Outcome of urinary tract infections caused by extended spectrum beta-lactamase-producing Enterobacteriaceae in children // Pediatr. Infect. Dis. J. — 2011. — 30. — 707. — https://www.ncbi.nlm.nih.gov/pubmed/21248655.
18. Wang H.H. et al. Efficacy of antibiotic prophylaxis in children with vesicoureteral reflux: systematic review and meta-analysis // J. Urol. — 2015. — 193. — 963. — https://www.ncbi.nlm.nih.gov/pubmed/25196653.
19. Hanuš M., Matoušková M., Králová V. et al. Immunostimulation with polybaterial lysat in prevention of recurrence infection // Ces. Urol. — 2015. — 19(1). — 33-43.
20. Castro M., Lythe G., Molina-Paris C., Ribero R.M. Mathematics in modern immunology // Interface Focus. 2016. — Vol. 6, Issue 2. — https://doi.org/10.1098/rsfs.2015.0093.
21. Shaikh N. et al. Early Antibiotic Treatment for Pediatric Febrile Urinary Tract Infection and Renal Scarring // JAMA Pediatr. — 2016. — 170. — 848. — https://www.ncbi.nlm.nih.gov/pubmed/27455161.
22. Craig J.C. et al. Antibiotic prophylaxis and recurrent urinary tract infection in children // N. Engl. J. Med. — 2009. — 361. — 1748. — https://www.ncbi.nlm.nih.gov/pubmed/19864673.
23. Ivanov D. Possibilities of current anti-relapsing treatment of urinary tract infections in children // Pediatric Nephrology. — 2018. — Vol. 33, Issue 10.
24. Lee S.J. et al. Probiotics prophylaxis in infants with primary vesicoureteral reflux // Pediatr. Nephrol. — 2015. — 30. — 609. — https://www.ncbi.nlm.nih.gov/pubmed/25354903.
25. Schwenger E.M. et al. Probiotics for preventing urinary tract infections in adults and children // Cochrane Database Syst. Rev. — 2015. — CD008772. — https://www.ncbi.nlm.nih.gov/pubmed/26695595.
26. Salo J. et al. Cranberry juice for the prevention of recurrences of urinary tract infections in children: a randomized placebo-controlled trial // Clin. Infect. Dis. — 2012. — 54. — 340. — https://www.ncbi.nlm.nih.gov/pubmed/22100577.
27. Salomonsson P. et al. Best oral empirical treatment for pyelonephritis in children: Do we need to differentiate between age and gender? // Infect. Dis. (Lond). — 2016. — 48. — 721. — https://www.ncbi.nlm.nih.gov/pubmed/27300266.
28. Ramos N.L. et al. Characterisation of uropathogenic Escherichia coli from children with urinary tract infection in different countries // Eur. J. Clin. Microbiol. Infect. Dis. — 2011. — 30. — 1587. — https://www.ncbi.nlm.nih.gov/pubmed/21509475.

/11-1.jpg)
/12-1.jpg)
/13-1.jpg)
/14-1.jpg)