Международный эндокринологический журнал Том 15, №2, 2019
Вернуться к номеру
Аспекти безпеки замісної терапії препаратами тестостерону у чоловіків із цукровим діабетом 2-го типу і тестостероновою недостатністю
Авторы: Лучицький В.Є., Тронько М.Д., Лучицький Є.В.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україн
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
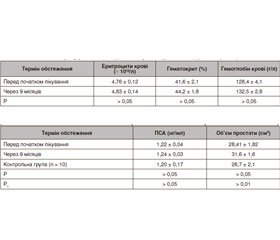
Актуальність. Тестостеронова недостатність (ТН) — стан, що негативно впливає на чоловічу сексуальність, репродукцію, загальне здоров’я та якість життя. Терапія тестостероном (ТТ) може покращити симптоми ТН і, можливо, призупинити розвиток коморбідних захворювань або полегшити їх прояви. Мета дослідження — визначити безпеку та прояви побічних ефектів замісної тестостеронової терапії у чоловіків із цукровим діабетом (ЦД) 2-го типу і тестостероновою недостатністю. Матеріали та методи. Замісна терапія препаратами тестостерону проводилася 89 чоловікам із цукровим діабетом 2-го типу та андрогенним дефіцитом, віком від 36 до 72 років, із тривалістю ЦД 1–18 років: перша група (35 чоловіків) отримувала тестостерону ундеканоат (1000 мг), друга група (54 пацієнти) — 1 мл масляного розчину (250 мг) суміші ефірів тестостерону. Результати. В обстежених хворих першої групи середні показники вмісту еритроцитів, гемоглобіну та гематокриту після закінчення періоду спостереження вірогідно не змінювалися. Середні показники простатичного специфічного антигена (ПСА) через 9 місяців після початку ТТ у хворих чоловіків першої групи зростали менше ніж на 10 % від початкових — з 1,48 ± 0,26 нг/мл до 1,62 ± 0,20 нг/мл (p > 0,05). Збільшення об’єму передміхурової залози в динаміці застосування препарату було невірогідним: перед початком лікування 32,1 ± 1,9 см3 та 35,7 ± 1,9 см3 через 9 місяців. У чоловіків другої групи середні показники еритроцитів, гемоглобіну та гематокриту після закінчення замісної терапії тестостероном вірогідно не змінювалися. Середні показники ПСА через 9 місяців після початку ТТ у хворих другої групи залишалися практично незмінними: 1,22 ± 0,30 нг/мл до початку терапії та 1,24 ± 0,20 нг/мл через 9 місяців (p > 0,1). Збільшення об’єму передміхурової залози в обстежених пацієнтів в динаміці застосування препаратів тестостерону було невірогідним: перед початком лікування 28,4 ± 2,2 см3 та 31,6 ± 1,6 см3 через 9 місяців. Висновки. Отримані результати засвідчили, що застосування тестостерону з різною тривалістю дії для компенсації андрогенного дефіциту у чоловіків, хворих на ЦД 2-го типу, є ефективним і безпечним методом.
Актуальность. Тестостероновая недостаточность (ТН) — состояние, негативно влияющее на мужскую сексуальность, репродукцию, общее здоровье и качество жизни. Терапия тестостероном (ТТ) может улучшить симптомы ТН и, возможно, приостановить развитие коморбидных заболеваний или облегчить их проявления. Цель исследования — определить безопасность и проявления побочных эффектов заместительной тестостероновой терапии у мужчин с сахарным диабетом (СД) 2-го типа и тестостероновой недостаточностью. Материалы и методы. Заместительная терапия препаратами тестостерона проводилась у 89 мужчин с сахарным диабетом 2-го типа и андрогенным дефицитом, в возрасте от 36 до 72 лет, с длительностью СД 1–18 лет: первая группа (35 мужчин) получала тестостерона ундеканоат (1000 мг), вторая группа (54 пациента) — 1 мл масляного раствора (250 мг) смеси эфиров тестостерона. Результаты. У обследованных больных первой группы средние показатели эритроцитов, гемоглобина и гематокрита после окончания периода наблюдения достоверно не менялись. Средние показатели простатического специфического антигена (ПСА) через 9 месяцев после начала ТТ у больных мужчин первой группы выросли менее чем на 10 % от исходных — с 1,48 ± 0,26 нг/мл до 1,62 ± 0,20 нг/мл (p > 0,05). Увеличение объема предстательной железы в динамике применения препарата было недостоверным: перед началом лечения 32,1 ± 1,9 см3 и 35,7 ± 1,9 см3 через 9 месяцев. У мужчин второй группы средние показатели эритроцитов, гемоглобина и гематокрита после окончания ТТ достоверно не изменялись. Средние показатели ПСА через 9 месяцев после начала ТТ у больных второй группы оставались практически неизмененными: 1,22 ± 0,30 нг/мл до начала терапии и 1,24 ± 0,20 нг/мл через 9 месяцев (p > 0,1). Увеличение объема предстательной железы у обследованных пациентов в динамике применения препарата тестостерона было недостоверным: перед началом лечения 28,4 ± 2,2 см3 и 31,6 ± 1,6 см3 через 9 месяцев. Выводы. Полученные результаты показали, что применение тестостерона с разной продолжительностью действия для компенсации андрогенного дефицита у мужчин, больных СД 2-го типа, является эффективным и безопасным методом.
Background. Testosterone deficiency is a medical condition that adversely affects male sexuality, reproduction, general health and quality of life. Testosterone therapy can improve the symptoms of testosterone deficiency and possibly stop the development of comorbid diseases. The purpose of the study is to determine the safety and side effects of substitution testosterone therapy in men with type 2 diabetes mellitus and testosterone deficiency. Materials and methods. Testosterone replacement therapy was carried out in 89 men aged 36–72 years with type 2 diabetes mellitus (duration from 1 to 18 years) and androgen deficiency: first group (35 patients) received testosterone undecanoate (1000 mg), second group (54 individuals) — 1 ml of an oil solution (250 mg) of a mixture of testosterone esters. Results. In the examined patients of the first group, the average values of erythrocytes, hemoglobin and hematocrit after the end of the observation period did not change significantly. Mean prostate-specific antigen level 9 months after the initiation of testosterone therapy increased by less than 10 % of the baseline, from 1.48 ± 0.26 ng/ml to 1.62 ± 0.20 ng/ml (p > 0.05). An increase in the volume of the prostate gland was non-significant: 32.1 ± 1.9 cm3 before the start of treatment vs 35.7 ± 1.9 cm3 in 9 months. In men of the second group, the average rates of erythrocytes, hemoglobin and hematocrit after the completion of testosterone replacement therapy did not change significantly. The mean prostate-specific antigen values 9 months after the initiation of testosterone therapy in patients of the second group remained virtually unchanged: 1.22 ± 0.30 ng/ml prior to therapy and 1.24 ± 0.20 ng/ml 9 months after (p > 0.1). An increase in the prostate volume in the examined patients was non-significant: 28.4 ± 2.2 cm3 before the start of treatment vs 31.6 ± 1.6 cm3 in 9 months. Conclusions. The results showed that the use of testosterone with different duration of action in men with diabetes mellitus is an effective and safe method.
тестостерон; чоловіки; цукровий діабет 2-го типу; простатичний специфічний антиген; гематокрит; передміхурова залоза
тестостерон; мужчины; сахарный диабет 2-го типа; простатический специфический антиген; гематокрит; предстательная железа
testosterone; mеn; type 2 diabetes mellitus; prostate-specific antigen; hematocrit; prostate gland
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Spitzer M, Huang G, Basaria S, Travison TG, Bhasin S. Risks and benefits of testosterone therapy in older man. Nat Rev Endocrinol. 2013 Jul;9(7):414-24. doi: 10.1038/nrendo.2013.73.
- Camacho EM, Huhtaniemi IT, O’Neill TW, et al. Age-associated changes in hypothalamic-pituitary-testicular function in middle-aged and older men are modified by weight change and lifestyle factors: longitudinal results from the European Male Ageing Study. Eur J Endocrinol. 2013 Feb 20;168(3):445-55. doi: 10.1530/EJE-12-0890.
- Wu FC, Tajar A, Beynon JM, et al. Identification of late-onset hypogonadism in middle-aged and elderly men. N Engl J Med. 2010 Jul 8;363(2):123-35. doi: 10.1056/NEJMoa0911101.
- Jones TH. Testosterone deficiency: a risk factor for cardiovascular disease? Trends Endocrinol Metab. 2010 Aug;21(8):496-503. doi: 10.1016/j.tem.2010.03.002.
- Jones TH. Effects of testosterone on type 2 diabetes and components of the metabolic syndrome. J Diabetes. 2010 Sep;2(3):146-56. doi: 10.1111/j.1753-0407.2010.00085.x.
- Kapoor D, Aldred H, Clark S, Channer KS, Jones TH. Clinical and biochemical assessment of hypogonadism in men with type 2 diabetes: correlations with bioavailable testosterone and visceral adiposity. Diabetes Care. 2007 Apr;30(4):911-7. doi: 10.2337/dc06-1426.
- Hackett G, Heald AH, Sinclair A, Jones PW, Strange RC, Ramachandran S. Serum testosterone, testosterone replacement therapy and all-cause mortality in men with type 2 diabetes: retrospective consideration of the impact of PDE5 inhibitors and statins. Int J Clin Pract. 2016 Mar;70(3):244-53. doi: 10.1111/ijcp.12779.
- Dhindsa S, Prabhacar S, Sethi M, Bandyopadhyay A, Chaudhuri A, Dandona P. Frequent occurrence of hypogonadotropic hypogonadism in type 2 diabetes. J Clin Endocrinol Metab. 2004 Nov;89(11):5462-8. doi: 10.1210/jc.2004-0804.
- Bhasin S, Pencina M, Jasuja GK, et al. Reference Ranges for Testosterone in Men Generated Using Liquid Chromatography Tandem Mass Spectrometry in a Community-Based Sample of Healthy Nonobese Young Men in the Framingham Heart Study and Applied to Three Geographically Distinct Cohorts. J Clin Endocr Metab. 2011;96(8):2430-2439. doi: 10.1210/jc.2010-3012.
- Bhasin S, Cunningham GR, Hayes FJ, et al. Testosterone Therapy in Men with Androgen Deficiency Syndromes: An Endocrine Society Clinical Practice Guideline. J Clin Endocr Metab. 2010;95(6):2536-2559. doi: 10.1210/jc.2009-2354.
- Hackett G, Cole N, Bhartia M, Kennedy D, Raju J, Wilkinson P. Testosterone replacement therapy with long-acting testosterone undeconoate improves sexual function and quality of life parameters vs. placebo in a population of men with type 2 diabetes. J Sex Med. 2013 Jun;10(6):1612-27. doi: 10.1111/jsm.12146.
- Hackett G, Cole N, Bhartia M, et al. The response to testosterone undecanoate in men with type 2 diabetes is dependent on achieving threshold serum levels (the BLAST study). Int J Clin Pract. 2014 Feb;68(2):203-15. doi: 10.1111/ijcp.12235.
- Martits AM, Costa EMF, Nardi AC, et al. Late-onset hypogonadism or DAM: diagnosis. Rev Assoc Med Bras (1992). 2014 Jul;60(4):286-94.
- Jones TH, Arver S, Behre HM, et al. Testosterone replacement in hypogonadal men with type 2 diabetes and/or metabolic syndrome (the TIMES2 study). Diabetes Care. 2011 Apr;34(4):828-37. doi: 10.2337/dc10-1233.
- Heufelder AE, Saad F, Bunck MC, Gooren L. Fifty-two-week treatment with diet and exercise plus transdermal testosterone reverses the metabolic syndrome and improves glycemic control in men with newly diagnosed type 2 diabetes and subnormal plasma testosterone. J Androl. 2009 Nov-Dec;30(6):726-33. doi: 10.2164/jandrol.108.007005.
- Hackett G, Cole N, Bhartia M, et al. Testosterone replacement therapy improves metabolic parameters in hypogonadal men with type 2 diabetes but not in men with coexisting depression: the BLAST study. J Sex Med. 2014 Mar;11(3):840-56. doi: 10.1111/jsm.12404.
- Luchitsky VE. Diagnosis and treatment of testosterone deficiency in type 2 diabetes mellitus. Endokrynologia. 2018;23(4):314-323. doi: 10.31793/1680-1466.2018.23-4.314. (in Ukrainian).
- Hackett G, Cole N, Deshpande A, et al. The BLAST study: treating hypogonadism in type 2 diabetes with long acting testosterone undecanoate versus placebo significantly improves HbA1c, waist circumference, aging male symptom scores and all sexual function domains of the IIEF. Results continue to improve for 12 to 18 months. Presented at the European Society of Sexual Medicine meeting, Milan (2011).
- Rao MP, Kelly DM, Jones TH. Testosterone and insulin resistance in the metabolic syndrome and T2 DM in men. Nat Rev Endocrinol. 2013 Aug;9(8):479-93. doi: 10.1038/nrendo.2013.122.
- Coviello AD, Kaplan B, Lakshman KM, Chen T, Singh AB, Bhasin S. Effects of graded doses of testosterone on erythropoiesis in healthy young and older men. J Clin Endocrinol Metab. 2008 Mar;93(3):914-9. doi: 10.1210/jc.2007-1692.
- Fenely MR, Carruthers. M. Is testosterone treatment good for the prostate? Study of safety during long-term treatment. J Sex Med. 2012 Aug;9(8):2138-49. doi: 10.1111/j.1743-6109.2012.02808.x.
- Fernandez-Balsells MM, Murad MH, Lane M, et al. Clinical review 1: Adverse effects of testosterone therapy in adult men: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2010 Jun;95(6):2560-75. doi: 10.1210/jc.2009-2575.
- Endogenous Hormones and Prostate Cancer Collaborative Group, Roddam AW, Allen NE, Appleby P, Key TJ. Endogenous sex hormones and prostate cancer: a collaborative analysis of 18 prospective studies. J Natl Cancer Inst. 2008 Feb 6;100(3):170-83. doi: 10.1093/jnci/djm323.
- Hoyos CM, Killick R, Yee BJ, Grunstein RR, Liu PY. Effects of testosterone therapy on sleep and breathing in obese men with severe obstructive sleep apnoea: a randomized placebo-controlled trial. Clin Endocrinol (Oxf). 2012 Oct;77(4):599-607. doi: 10.1111/j.1365-2265.2012.04413.x.

/101-1.jpg)
/102-1.jpg)