Журнал "Гастроэнтерология" Том 53, №2, 2019
Вернуться к номеру
Фактори ризику розвитку кандидозу слизової оболонки верхнього відділу шлунково-кишкового тракту. Проблема антибіотикотерапії
Авторы: Кушніренко І.В.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Актуальність. За даними літератури, існує низка факторів, що зумовлюють розвиток кандидозу верхнього відділу травного тракту, проте остаточно їх значимість у формуванні захворювання не визначена. Протиріччя існують і щодо антибіотикотерапії як фактора ризику у пацієнтів, які не знаходяться у відділеннях інтенсивної терапії. Відсутні рекомендації щодо тактики ведення пацієнтів після застосування антибіотиків. Мета. Визначення факторів ризику розвитку орофарингеального кандидозу за величиною внеску у ризик розвитку захворювання, а також вивчення проблеми антибіотикотерапії та розробка рекомендацій щодо тактики ведення пацієнтів. Матеріали та методи. Обстежено та проанкетовано 638 пацієнтів, які за результатами мікробіологічного дослідження зшкрібка з язика поділені на групи: 1 група — 151 пацієнт з орофарингеальним кандидозом, тобто ІV ступенем масивності обсіменіння; 2 група — 327 пацієнтів із незначним та помірним ростом грибів Candida (I, II та III ступінь), 3 група — 160 осіб із негативним результатом посіву (0 ступінь). Результати. Виявлено істотні відмінності між групами 1 і 3 за такими факторами розвитку орофарингеального кандидозу як прийом антибіотиків протягом року, паління, носіння зубних протезів, наявність кандидозного вульвовагініту в жінок, а також супутня патологія щитоподібної залози та анемія. При порівнянні груп 1 та 2 значимими є прийом антибіотиків протягом року та патологія щитоподібної залози. Діагностична чутливість сформованої на підставі отриманих даних анкети — 83,3 %, довірчий інтервал (ДІ) 75,9–88,8 %, специфічність — 75,1 %, ДІ 70,7–79,0 %, ефективність моделі — 77,0 %, ДІ 73,3–80,4 %. Із 291 особи, яким призначалися антибіотики, у 199 осіб (68,4 %) проведено антифунгальне лікування, але розподіл ступенів обсіменіння грибами у цих пацієнтів відмінностей не мав. Аналіз показав, що дози, термін та вибір антифунгального засобу не відповідали чинним міжнародним рекомендаціям. Висновки. Застосування розробленої з урахуванням факторів ризику розвитку орофарингеального кандидозу діагностичної анкети дозволяє підвищиити ефективність діагностики. Проведення антибіотикотерапії потребує нагляду пацієнтів та після мікробіологічної верифікації діагнозу кандидозу — проведення лікування. Оптимальною терапевтичною тактикою є застосування системних антигрибкових засобів згідно з міжнародними рекомендаціями при одночасній корекції факторів ризику, що піддаються модифікації.
Актуальность. По данным литературы, существует ряд факторов, обусловливающих развитие кандидоза верхнего отдела пищеварительного тракта, однако значимость их в формировании заболевания окончательно не определена. Противоречивые данные существуют и касательно антибиотикотерапии как фактора риска у пациентов, не находящихся на лечении в отделении интенсивной терапии. Отсутствуют рекомендации по тактике ведения пациентов после применения антибиотиков. Цель. Определение факторов риска развития орофарингеального кандидоза по величине вклада в риск развития заболевания, а также изучение проблемы антибиотикотерапии и разработка рекомендаций по тактике ведения пациентов. Материалы и методы. Обследованы и проанкетированы 638 пациентов, которые по результатам микробиологического исследования соскоба с языка разделены на группы: 1 группа — 151 пациент с орофарингеальным кандидозом, то есть ІV степенью массивности обсеменения; 2 группа — 327 пациентов с незначительным и умеренным ростом грибов (I, II та III степень массивности обсеменения); 3 группа — 160 лиц с негативным результатом посева (0 степень). Результати. Выявлены существенные различия между группами 1 и 3 по таким факторам риска орофарингеального кандидоза, как прием антибиотиков в течение года, курение, ношение зубных протезов, наличие кандидозного вульвовагинита у женщин, а также сопутствующая патология щитовидной железы и анемия. При сравнении групп 1 и 2 значимыми являются прием антибиотиков в течение года и патология щитовидной железы. Диагностическая чувствительность сформированной на основании полученных данных анкеты — 83,3 %, доверительный интервал (ДИ) 75,9–88,8 %, специфичность — 75,1 %, ДИ 70,7–79,0 %, эффективность модели — 77,0 %, ДИ 73,3–80,4 %. Из 291 пациента, которым назначались антибиотики, у 199 лиц (68,4 %) проведена антифунгальная терапия, однако распределение степеней массивности обсеменения грибами у них отличий не имело. Анализ показал, что дозы, сроки и выбор антифунгального препарата не соответствовали современным международным рекомендациям. Выводы. Применение разработанной с учетом факторов риска развития орофарингеального кандидоза диагностической анкеты позволяет повысить эффективность диагностики. Проведение антибиотикотерапии требует наблюдения за пациентом и после микробиологической верификации диагноза кандидоза — проведения лечения. Оптимальной терапевтической тактикой является применение системных антигрибковых препаратов согласно международным рекомендациям при одновременной коррекции факторов риска, поддающихся модификации.
Background. According to the literature, there are a number of factors causing the development of candidiasis of the upper digestive tract; however, their significance in the formation of the disease has not been fully determined. Controversial data exist regarding antibiotic therapy as a risk factor in patients who are not treated in the intensive care unit. There are no recommendations on the management of patients after the use of antibiotics. The purpose was to determine the risk factors for oropharyngeal candidiasis according to their contribution in the risk of developing the disease, as well as to study the problem of antibiotic therapy and to develop guidelines for the management of these patients. Materials and methods. Six hundred and thirty-eight patients were examined and surveyed, they were divided into groups according to the results of microbiological study of the tongue scraping: group 1 — 151 patients with oropharyngeal candidiasis, that is, ІV degree of colonization, group 2 — 327 persons with mild and moderate fungal growth (I, II and III degree of colonization), group 3 — 160 people with a negative result of seeding (degree 0). Results. Significant differences were found between groups 1 and 3 for such risk factors for oropharyngeal candidiasis as antibiotic therapy over a year, smoking, wearing dentures, the presence of vulvovaginal candidiasis in women, as well as concomitant thyroid disease and anemia. When comparing groups 1 and 2, taking antibiotics over a year and thyroid pathology are significant. The diagnostic sensitivity of the questionnaire formed on the basis of the obtained data is 83.3 %, confidence interval (CI) 75.9–88.8 %, specificity 75.1 %, CI 70.7–79.0 %, efficiency 77.0 %, CI 73.3–80.4 %. Of the 291 patients who were taking antibiotics, antifungal therapy was administered to 199 individuals (68.4 %), but the distribution of the degrees of fungal contamination did not differ between them. The analysis showed that the doses, the timing and the choice of the antifungal drug did not meet current international guidelines. Conclusions. The use of a diagnostic questionnaire developed with consideration of the risk factors for oropharyngeal candidiasis can increase the efficiency of diagnosis. Administration of antibiotic therapy requires observation of the patient and after microbiological verification of the diagnosis of candidiasis — treatment. The optimal therapeutic approach is the use of systemic antifungal drugs in accordance with international recommendations, with simultaneous correction of risk factors that can be modified.
кандидоз; слизова оболонка; фактори ризику; антибіотикотерапія; антифунгальна терапія
кандидоз; слизистая оболочка; факторы риска; антибиотикотерапия; антифунгальная терапия
candidiasis; mucous membrane; risk factors; antibiotic therapy; antifungal therapy
Вступ
Проблема кандидозу слизової оболонки верхнього відділу травного тракту (СО ВВТТ), зокрема орофарингеального кандидозу (ОФК), кандидозу стравоходу (СХ), кандидозу шлунка, знаходиться на пересіченні інтересів лікарів декількох спеціальностей, переважно лікарів загального профілю, стоматологів, інфекціоністів. Проте поширення кандидної інфекції на дистальні відділи шлунково-кишкового тракту (ШКТ) вже постає проблемою для лікарів-гастроентерологів, а отже, кандидоз СО ВВТТ є захворюванням, що вимагає уваги широкого кола спеціалістів. За результатами досліджень, дріжджоподібні гриби входять до числа одних із найважливіших патогенів, що найчастіше виявляють в імуноскомпрометованих хворих, та займають четверте місце серед патогенів, що виявляють у крові стаціонарних хворих [1]
Гриби роду Candida є унікальними мікроорганізмами, опортуністичними патогенами, властивості яких дозволяють їм персистувати не тільки в зовнішньому середовищі, а й у різних біотопах макроорганізму. Вони, зокрема, колонізують шкіру, орофарингеальну зону, СО ШКТ. Легке пристосування грибів до виживання в різних нішах макроорганізму досягається завдяки великому спектру механізмів адаптації для зберігання своєї життєдіяльності [2]. Шлунково-кишковий тракт людини є відкритою системою, що вільно сполучається із зовнішнім середовищем, і персистування грибів у ньому вимагає постійного балансу між патогенними властивостями мікроорганізму та системою захисту макроорганізму, оскільки, на думку Н.В. Шабашової та Е.Ю. Данилової, T.J. Rast із співавт., як механічне ушкодження цілісності СО, так і надмірна колонізація є фактором, що може призвести до розвитку вісцерального або системного кандидозу [3, 4].
Щодо орофарингеальної локалізації кандидозу, то даних про частоту його виявлення у хворих чимало, оскільки відомо, що наявність кандид у незначній кількості у ротовій порожнині є фізіологічною, частота їх виявлення становить, за даними різних авторів, від 24,0 до 73,0 %, із превалюванням виду C. albicans [5, 6]. Ретроспективне обстеження 2785 пацієнтів з урахуванням усіх випадків кандидозу, проведене аргентинськими вченими, показало частоту ОФК 4,4 %, що підтверджено мікробіологічними або гістологічними дослідженнями [7]. Дещо вищі показники отримані в дослідженні бразильських учених, які виявили кандидоз порожнини рота в 10,3 % пацієнтів [8]. Дослідження, проведені серед 150 дітей віком від 6 до 18 років, показали, що у слині виявлено значний ступінь росту Candida spp. (> 103 КУО/мл) у 24,7 % випадків [9]. Очевидно, що такі відмінності зумовлюють необхідність пояснення причин їх виникнення, що, на наш погляд, виникають унаслідок відсутності єдиних критеріїв трактування понять «носійство кандидної інфекції» і «кандидоз», тобто стану, що можна визнати патологічним. Подальший аналіз результатів досліджень показує, що переважним збудником кандидної інфекції в ротовій порожнині є С. albicans, частота виявлення якого від 73,4 до 95,0 % ізолятів [6, 10–12].
Поширення інфекції в дистальні відділи ШКТ також широко вивчається дослідниками. Так, за даними обстеження 80 219 хворих японськими вченими за період із 2002 по 2014 рік, відзначена тенденція до збільшення частоти виявлення кандидозу СХ у неінфікованих вірусом імунодефіциту людини (ВІЛ) хворих від 0,6 до 2,5 % (р < 0,01) [13]. А за даними N. Asajama зі співавт., які ендоскопічно обстежили 1855 не інфікованих ВІЛ пацієнтів із 2009 по 2010 рік, виявлено кандидозний езофагіт у 71 особи, тобто поширеність кандидозу становила в цілому 3,8 % [14]. Іранські дослідники зробили висновок про частоту кандидозу СХ 5,2 % на підставі ендоскопічного обстеження 398 хворих із 2012 по 2014 рік. Обстеження також включало не інфікованих ВІЛ хворих [15]. Інші результати 2496 ендоскопій, проведених в осіб похилого та старечого віку, свідчать про поширеність кандидозу СХ у 1,8 % [16]. Корейськими дослідниками на підставі ретроспективних даних 88 125 обстежених хворих установлена поширеність кандидозу СХ у 0,32 % (n = 281) [17]. За результатами індійських учених, які провели обстеження 1868 пацієнтів без визнаних імунокомпрометуючих захворювань, кандидозний езофагіт виявлений у 8,7 % випадків (n = 163) [18]. Частота виявлення C. аlbicans, як і при ОФК, посідала провідне місце у випадках кандидозу СХ і становила від 52,1 до 90,5 % [15, 18].
На сьогодні кандидозне ураження ШКТ найчастіше пов’язують з імунодефіцитними станами, такими як ВІЛ, у межах опортуністичної інфекції, що розвивається лише за умов вираженого імунодефіциту. Поширеність кандидозного ураження у таких хворих значна, проте актуальною є ця проблема і для хворих, не інфікованих ВІЛ. За результатами японських дослідників, останніми десятиріччями спостерігаються протилежні тенденції щодо частоти виявлення цього захворювання: у ВІЛ-інфікованих з 2002 до 2014 року частота кандидозного езофагіту знижувалася з 13,6 до 9,0 % (р = 0,097), тоді як у не інфікованих ВІЛ, навпаки, зростала з 0,6 до 2,5 % (р < 0,01) [13]. Окрім ВІЛ-інфекції серед факторів ризику розвитку кандидозного ураження СО ВВТТ розглядають і цілу низку інших (табл. 1).
Так, наведені дані результатів досліджень за останні роки дозволяють виділити серед факторів ризику кандидозу два види факторів макроорганізму: які можливо модифікувати (низький рівень оральної гігієни порожнини рота, низький рівень харчування, такі шкідливі звички, як паління, зловживання алкоголем) і які не піддаються модифікації (похилий вік хворого, ксеростомія). Привертає увагу ціла низка ятрогенних факторів ризику: попереднє хірургічне лікування, гемодіаліз, прийом пероральних гіпоглікемічних, психотропних засобів та інгаляційних стероїдів, тривале перебування у стаціонарі, застосування антибіотиків та інгібіторів протонної помпи. Причому щодо як антибіотиків, так і інгібіторів протонної помпи до цього часу немає єдиної чіткої думки як до фактора ризику. Так, на противагу результатам досліджень, викладеним вище, з розвитком кандидозу ВВТТ не виявлено асоціації прийому антибіотиків, за даними J.N. Gheno зі співавт. [25], та прийому інгібіторів протонної помпи, за даними Y. Takahashi зі співавт. [13].
Отже, кандидоз СО ВВТТ є патологією, з якою стикається у своїй практиці значна частина лікарів, проте сьогодні відсутні загальноприйняті стандарти курації цих хворих. Зрозуміло, що основним способом лікування інфекційного процесу є, безумовно, ліквідація збудника, але за умов, коли цей процес викликається умовно-патогенною флорою, не завжди вдається елімінувати патоген повністю, а певну увагу слід приділяти умовам, за яких цей інфектант набуває патогенних властивостей. Щодо етіотропного лікування орофарингеального та езофагеального кандидозу, то тактика його застосування найбільш повно відображена у XVI та XVII розділах рекомендацій Американської асоціації з вивчення інфекційних захворювань (Infectious Diseases Society of America — IDSA) 2009 та 2015 рр. із високим рівнем доказовості [30]. У рекомендаціях повністю відображені можливі засоби лікування різних форм кандидозного ураження з визначенням груп препаратів та способів дозування, терміну застосування. Окремо слід зауважити, що для лікування кандидозу СО ВВТТ практично неможливо застосовувати антифунгальні засоби, що не всмоктуються у ШКТ та не мають системної дії через їх низьку ефективність при даній формі ураження. Також важливим аспектом є відсутність в Україні ефективних засобів для лікування оральних форм кандидозу, таких як ністатин, амфотерицин В у формі для розсмоктування у ротовій порожнині, що значно обмежує можливості лікування такої патології.
Значна увага приділяється резистентності грибів до антифунгальних засобів, що зростає, зокрема, і до азольної групи препаратів. Механізми азолрезистентності пов’язані як із властивостями Candida spp. накопичувати геномні зміни, що дозволяють краще пристосовуватися до зовнішнього середовища, з подальшими змінами синтезу транскрипційних факторів та генів біосинтезу ергостерину, який є мішенню для дії азолових препаратів, так і з властивостями утворювати біоплівку [18, 31, 32]. На біоплівку C. albicans ефективно діють амфотерицин В та ехінокандини, а дія флуконазолу має дозозалежний ефект, тому при визначенні чутливості до антимікотичних препаратів дуже важливо застосовувати міжнародні стандарти з використанням еталонних методів із визначенням мінімальної інгібуючої концентрації (МІК) препарату, а в клінічній практиці здійснювати дозування з урахуванням маси тіла пацієнта та дотриманням оптимальних термінів лікування [2, 33]. Особливої значимості набуває необхідність верифікації виду Candida при мікробіологічному обстеженні пацієнтів із кандидозом для призначення ефективного лікування.
Одним із найважливіших питань профілактики кандидозу СО верхнього відділу травного тракту є корекція фактора прийому антибіотиків протягом року. Так, відомо, що у клінічній практиці для усунення ризику розвитку кандидозу при прийомі антибіотиків обов’язково призначають антифунгальні препарати у відділеннях інтенсивної терапії, проте у терапевтичній практиці алгоритм запобігання розвитку кандидозу після прийому антибіотиків не визначений.
Отже, ціла низка питань щодо факторів розвитку, можливостей профілактики та тактики лікування кандидозного ураження СО ВВТТ у клінічній практиці залишається досі остаточно не визначеною.
Матеріали та методи
Виявлення факторів ризику розвитку кандидозу здійснювали шляхом анкетування 638 пацієнтів, обстежених у ДУ «Інститут гастроентерології НАМН України» з 2009 по 2012 рік. Після отримання результатів зшкрібка з язика пацієнти були поділені на 3 клінічні групи: 1 групу становив 151 пацієнт з ОФК, тобто ІV ступенем масивності обсіменіння (СМО); 2 групу — 327 пацієнтів із незначним та помірним ростом грибів роду Candida (I, II та III СМО); до складу 3 групи ввійшли 160 пацієнтів із негативним результатом посіву на гриби роду Candida (0 СМО). Співвідношення чоловіків та жінок становило 2,3 : 1,8 : 1,9 у трьох групах відповідно та не мало вірогідної різниці. Також три групи були порівнянними за середнім віком пацієнтів, який становив (48,73 ± 12,71) року в 1 групі, (47,55 ± 14,15) року — у 2, (48,98 ± 12,78) — у 3. Визначені групи пацієнтів також не мали розбіжностей у морфометричному показнику індексу маси тіла, що становив у 1 групі обстежених (24,74 ± 4,95) кг/м2, у 2 — (24,95 ± 4,91) кг/м2, у хворих 3 групи — (25,38 ± 5,30) кг/м2.
Для визначення ролі антибіотикотерапії у розвитку кандидозу ВВТТ проведено опитування та вивчення анамнестичних даних 638 пацієнтів із подальшим порівняльним аналізом частоти виявлення ОФК, у том числі залежно від проведення антифунгальної терапії при призначенні антибіотиків. При опитуванні враховувалося призначення антибіотиків протягом року до проведення обстеження. Статистична обробка даних здійснювалася з використанням статистичного пакета EZR v. 1.35 (Saitama Medical Center, Jichi Medical University, Saitama, Японія) та ліцензійної версії Statistica 12. Для статистичного аналізу даних використовували дескриптивну статистику; порівняння середніх значень змінних здійснювали за допомогою параметричних методів (t-критерію Стьюдента) за нормального розподілу даних ознак. Відповідність виду розподілу ознак закону нормального розподілення перевіряли за допомогою методу Шапіро — Уїлка. В інших випадках застосовували непараметричний метод (U-критерій Манна — Уїтні). Оцінку вірогідності відмінностей якісних ознак у групах проводили з використанням критерію χ2. Статистична значимість різниці оцінювалась на рівні значущості — р = 0,05. При оцінці трьох та більше груп використано дисперсійний аналіз, множинні порівняння проводили з урахуванням поправки Бонферроні або t-критерію Даннета, критерію Краскела — Уолліса та критерію Данна — для непараметричних. Для якісних ознак порівняння трьох груп проводили з використанням поправки Бонферроні.
Результати та обговорення
Для проведення дослідження в анкету хворих включено найбільш часті фактори ризику, з якими пов’язують розвиток ОФК у літературних джерелах. Результати наведені в табл. 2.
Аналіз отриманих даних вказує на наявність певних факторів ризику розвитку ОФК в обстежених хворих, серед яких найбільш істотним є прийом антибіотиків протягом року, на який пацієнти 1 групи вказували частіше в 1,4 раза порівняно з пацієнтами 2 групи (р < 0,01). При цьому частота прийому антибіотиків між пацієнтами 2 та 3 групи вірогідно не відрізнялася. Майже удвічі частіше палили пацієнти з IV СМО порівняно з пацієнтами без виявлення грибів у ротовій порожнині (р < 0,05). Від анемії страждали близько п’ятої частини пацієнтів 1 групи, що майже удвічі більше порівняно з пацієнтами 3 групи (р < 0,05). Привертає увагу тенденція до збільшення частоти патології щитоподібної залози у хворих 1 групи порівняно з пацієнтами 2 групи (χ2 = 0,055; p > 0,05), при цьому частота її серед пацієнтів 2 і 3 груп майже не розрізнялась — 20,13 і 20,37 %. Усупереч очікуванням такий фактор ризику, як носіння зубних протезів, лише мав тенденцію до збільшення в пацієнтів з ОФК в 1,5 раза (χ2 = 0,092; p > 0,05).
В обстежених пацієнтів не було вірогідних відмінностей щодо впливу цукрового діабету та прийому глюкокортикостероїдів на виявлення грибкової флори на СО ротової порожнини, але це не дозволяє стверджувати про його відсутність, оскільки такий факт може бути пов’язаний із надто малою кількістю пацієнтів із такою патологією.
Прийом антисекреторних препаратів у хворих не став одним із факторів, що впливає на розвиток кандидозу, оскільки пацієнти всіх трьох груп застосовували їх з однаковою частотою. Аналіз проводився з урахуванням групи антисекреторних засобів — Н2-блокатори або інгібітори протонної помпи, проте частота їх вживання також не мала вірогідних відмінностей по групах і становила для Н2-блокаторів 20,5; 23,7 і 22,5 % відповідно, а для інгібіторів протонної помпи — 39,1; 40,9 і 45,6 % відповідно.
Прогностична оцінка ймовірності виявлення незначного/помірного росту грибів роду Candida порівняно з групою без виявлення грибів за оцінкою відношення шансів (ВШ) виявила лише тенденцію щодо такого фактора ризику, як паління (рис. 1).
Аналіз щодо виявлення ОФК встановив більш істотні відмінності між групами 1 і 3 (рис. 2). За наведеними даними, прогностично значимими факторами розвитку ОФК є прийом антибіотиків протягом року, паління, носіння зубних протезів, наявність кандидозного вульвовагініту у жінок, а також супутня патологія щитоподібної залози (ЩЗ) та анемія.
Оцінка шансів розвитку ОФК за наявності визначених прогностичних ознак при порівнянні з групою із незначним/помірним СМО показала відмінності щодо таких прогностичних факторів, як прийом антибіотиків протягом року (відношення шансів 2,06; 95% ДІ 1,39–3,06) та патологія ЩЗ (ВШ 1,57; 95% ДІ 1,01–2,45) (рис. 3).
Отже, шляхом проведення аналізу за оцінкою відношення шансів визначено основні прогностичні критерії щодо розвитку ОФК в обстежених хворих, серед яких провідним є прийом антибіотиків протягом року, роль якого не зменшується як при порівнянні 1 групи із групою пацієнтів без виявлення грибів на СО, так і з групою із незначним/помірним кандидозом. Такі фактори, як паління, носіння зубних протезів, наявність кандидозного вульвовагініту у жінок, також збільшують шанси його виявлення. Привертає увагу істотний внесок анемії та патології щитоподібної залози у формування ОФК.
На підставі отриманих даних та після їх статистичної обробки сформовано анкету для визначення ризику виявлення орофарингеального кандидозу, що може бути застосована на різних етапах лікування пацієнта (табл. 3).
Для визначення групи високого ризику розвитку ОФК сума досліджуваних клінічних та прогностичних критеріїв повинна перевищувати 12 (ΣПК > 12). Пацієнти, в яких сума наявності клінічних і прогностичних критеріїв ОФК буде у межах 6 < ΣПК < 12, матимуть помірний ризик його виявлення, а з рівнем ΣПК < 6 — низький.
Дана модель апробована на масиві хворих, діагноcтична чутливість становила 83,3 %, ДІ 75,9–88,8 %, специфічність — 75,1 %, ДІ 70,7–79,0 %. Ефективність моделі — інтегральна оцінка запропонованого скринінгового тесту — становила 77,0 %, ДІ 73,3–80,4 %.
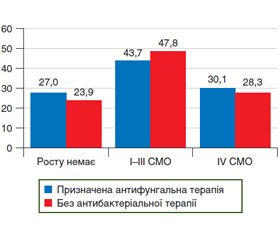
Нами проведено опитування та вивчення анамнестичних даних 638 пацієнтів із подальшим порівняльним аналізом частоти виявлення ОФК у пацієнтів залежно від проведення антифунгальної терапії при призначенні антибіотиків. Згідно з отриманими даними, усього прийом антибіотиків протягом року в анамнезі відмітили 332 пацієнти. Розподіл ступенів масивності кандидного обсіменіння залежно від проведення антибіотикотерапії в анамнезі поданий на рис. 4.
Отримані дані свідчать, що прийом антибіотиків навіть протягом року вірогідно збільшує частоту виявлення ОФК.
У 291 особи з тих, кому призначалися антибіотики, вивчені дані щодо проведення антифунгальної терапії. Як з’ясувалося, у 199 осіб (68,4 %) при проведенні антибіотикотерапії призначалися антифунгальні засоби. Розподіл частоти різних СМО у хворих цієї групи залежно від призначення антифунгального лікування поданий на рис. 5.
Згідно з наведеними даними, призначена супутня антифунгальна терапія у пацієнтів не впливала на частоту виявлення ОФК, як і не збільшувала частоту реєстрації відсутності росту грибів. Проте аналіз якості антимікотичної терапії показав, що дози та термін призначення системних антимікотиків не відповідали міжнародним рекомендаціям. Часто призначалися препарати, що не всмоктуються у ШКТ, діють лише у просвіті кишки та не здатні накопичуватися у СО (наприклад, натаміцин, ністатин), що не є доцільним у лікуванні кандидозу СО ВВТТ. Дози та тривалість призначених системних антимікотиків також не відповідали рекомендованим. Такі дані додатково свідчать про відсутність єдиного підходу до тактики ведення хворих із кандидозним ураженням СО ВВТТ.
Зважаючи на вищевикладені дані, на наш погляд, оптимальної тактики ведення хворого можливо досягти через застосування розробленої діагностичної анкети з визначенням пацієнтів із високим ризиком розвитку ОФК (табл. 3) для їх подальшого ретельного нагляду. Слід брати до уваги те, що одночасне призначення флуконазолу і кларитроміцину, що застосовується у схемах ерадикаційної терапії, призводить до подовження QT-інтервалу, що потребує застосування альтернативних схем лікування, а застосування флуконазолу та інгібіторів протонної помпи (омепразолу, пантопразолу) зумовлює підвищення рівня ефекту та збільшує ризик розвитку небажаних побічних явищ останніх внаслідок впливу на метаболізм печінкового ензиму CYP2C19.
Отже, з огляду на ризик розвитку небажаних фармакологічних реакцій при одночасному застосуванні деяких антибіотиків та антифунгальних засобів для уникнення поліпрагмазії слід призначати антифунгальну терапію лише пацієнтам із верифікованим відповідно до мікробіологічного дослідження діагнозом з призначенням адекватних доз системних антигрибкових засобів.
Висновки
1. При встановленні діагнозу кандидозу верхнього відділу травного тракту слід брати до уваги наявність факторів ризику та коморбідної патології, за наявності яких ризик виявлення даної нозології значно збільшується.
2. Застосування розробленої діагностичної анкети дозволяє визначити групу пацієнтів високого, помірного та низького ризику наявності орофарингеального кандидозу.
3. Антибіотикотерапія є додатковим фактором ризику розвитку орофарингеального кандидозу, що потребує клінічного нагляду та мікробіологічної верифікації діагнозу після її проведення у пацієнтів групи середнього та високого ризику розвитку кандидозу для подальшого проведення антигрибкового лікування.
4. Оптимальною терапевтичною тактикою є застосування системних антигрибкових засобів згідно з міжнародними рекомендаціями при одночасній корекції факторів ризику, що піддаються модифікації.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Wüthrich M. Adaptive Immunity to Fungi / M. Wüthrich, G.S. Deepe, B. Klein // Annu. Rev. Immunol. — 2012. — 30. — Р. 115-148. doi: 10.1146/annurev-immunol-020711-074958.
2. Adaptation, adhesion and invasion during interaction of Candida albicans with the host — Focus on the function of cell wall proteins / E. Hiller [et al.] // International Journal of Medical Microbiology. — 2011. — Vol. 301. — Р. 384-389. doi: 10.1016/j.ijmm.2011.04.004.
3. Шабашова Н.В. Местный иммунитет и микробиота ротовой полости (обзор) / Н.В. Шабашова, Е.Ю. Данилова // Проблемы медицинской микологии. — 2015. — Т. 17, № 4. — С. 4-13.
4. Human epithelial Cells Discriminate between Commensal and Pathogenic Interactions with Candida albicans / T.J. Rast, A.L. Kullas, P.J. Southern, D.A. Davis // PLoS One. — 2016. — April 18. doi: 10.1371/journal.pone.0153165.
5. Interactions of Candida albicans with host epithelial surfaces / D.W. Williams [et al.] // Journal of Oral Microbiology. — 2013. — № 5. — 22434. doi: 10.3402/jom.v5i0.22434.
6. Mayer F.L. Candida albicans pathogenicity mechanisms / F.L. Mayer, D. Wilson, B. Hube // Virulence. — February 15, 2013. — Vol. 4(2). — Р. 119–128. doi: 10.4161/viru.22913.
7. Prevalence of chronic hyperplasic candidiasis. Its association to risk factors in an Oral Medicine Service in Rosario, Argentina / C. López [et al.] // J. Mycol. Med. — 2012 Mar. — Vol. 22(1). — Р. 35-41. doi: 10.1016/j.mycmed.2011.12.072.
8. Oral mucosal lesions and their association with sociodemographic, behavioral, and health status factors / J.N. Gheno [et al.] // Brazilian Oral Research. — 2015. — Vol. 29, N 1. doi: 10.1590/1807-3107BOR-2015.vol29.0093.
9. Naidu B.V. Quantification and Correlation of Oral Candida with Caries Index Among Different Age Groups of School Children: A Case-Control Study / B.V. Naidu, B.A. Reginald // Ann. Med. Health Sci. Res. — 2016 Mar-Apr. — Vol. 6(2). — Р. 80-84. doi: 10.4103/2141-9248.181843.
10. Frequency of clinically isolated strains of oral Candida species at Kagoshima University Hospital, Japan, and their susceptibility to antifungal drugs in 2006–2007 and 2012–2013 / Y. Kamikawa [et al.] // BMC Oral Health. — 2014. — Vol. 14, 14. — Р. 9. doi: 10.1186/1472-6831-14-14.
11. Hertel M. Local, systemic, demographic, and health-related factors influencing pathogenic yeast spectrum and antifungal drug administration frequency in oral candidiasis: a retrospective study / M. Hertel, A.M. Schmidt-Westhausen, F.-P. Strietzel // Clin. Oral Investig. — 2016 Sep. — Vol. 20(7). — 1477-86. doi: 10.1007/s00784-015-1631-0.
12. The Prevalence of Nosocomial and Community Acquired Infections in a University Hospital / E. Ott [et al.] // Deutsches Ärzteblatt International. — 2013. — Vol. 110(31–32). — Р. 533-40. doi: 10.3238/arztebl.2013.0533.
13. Long-Term Trends in Esophageal Candidiasis Prevalence and Associated Risk Factors with or without HIV Infection: Lessons from an Endoscopic Study of 80,210 Patients / Y. Takahashi [et al.] // PLoS One. — 2015 July 24. — Р. 1-13. doi: 10.1371/journal.pone.0133589.
14. Relationship between clinical factors and severity of esophageal candidiasis according to Kodi’s classification / N. Asajama [et al.] // Diseases of the Esophagus. — 2014. — Vol. 27(3). — Р. 214–219. doi: 10.1111/dote.12102.
15. Mohammadi R. Molecular identification of Candida species isolated from gastroesophageal candidiasis in Tehran, Iran / R. Mohammadi, S. Abdi // Gastroenterology and Gepatology. — 2015. — Vol. 8(4). — Р. 288-293. PMCID: PMC4600519.
16. Албегова Д.М. Особенности кандидоза пищевода у больных пожилого и старческого возраста / Д.М. Албегова // Проблемы медицинской микологии. — 2012. — Т. 14, № 3. — С. 49-52.
17. Prevalence and Risk Factors of Esophageal Candidiasis in Healthy Individuals: A Single Center Experience in Korea / J.H. Choi [et al.] // Yonsei Med. Journal. — 2013. — Vol. 54(1). — Р. 160-165. doi: 10.3349/ymj.2013.54.1.160.
18. Fluconazole Resistant Candida Oesophagitis in Immunocompetent Patients: Is Empirical Therapy Justifiable? / B. Kakati [et al.] // Journal of Clinical and Diagnostic Research. — 2015 Dec. — Vol. 9(12). — Р. DC16–DC18. doi: 10.3349/ymj.2013.54.1.160.
19. Kragelund C. Oral Candidiasis and the Medically Compromased Patient. Chapter 8 / C. Kragelund, J. Reibel, A.M. Pedersen // Oral Infection and General Health: From Molecule to Chairside / Ed. by A.M.L. Pedersen. — Springer International Publishing Switzerland, 2016. — Р. 65-74.
20. Oral mucosal lesions in older people: relation to salivary secretion, systemic diseases and medications / L. Pedersen [et al.] // Oral Dis. — 2015. — № 21(6). — P. 721-729. doi: 10.1111/odi.12337.
21. Prevalence of oral Candida carriage and Candida species among cigarette and maras powder users / H.S. Keten [et al.] // Int. J. Clin. Exp. Med. — 2015. — Vol. 8(6). — Р. 9847-9854. PMCID: PMC4538155.
22. Krishnan P.A. Fungal infections of the oral mucosa / P.A. Krishnan // Indian J. Dent. Res. — 2012 Sep. — Vol. 23(5). — Р. 650-9. doi: 10.4103/0970-9290.107384.
23. Risk factors of Candida colonization in the oropharynx of patients admitted to an intensive care unit / H.M. Amiri [et al.] // J. Mycol. Med. — 2012 Dec. — Vol. 22(4). — Р. 301-307. doi: 10.1016/j.mycmed.2012.08.001.
24. Factors related to oral candidiasis in elderly users and non-users of removable dental prostheses / C.M. Bianchi [et al.] // Rev. Inst. Med. Trop. Sao Paulo. — 2016. — Vol 58, № 17. — Режим доступу: http://www.scielo.br/scielo.php?pid=S0036-46652016005000215 &script=sci_arttext.
25. Oral mucosal lesions and their association with sociodemographic, behavioral, and health status factors / J.N. Gheno [et al.] // Brazilian Oral Research. — 2015. — Vol. 29, № 1. — Режим доступу: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1806-83242015000100289.
26. Oral colonisation and infection by Candida sp. in diabetic and non-diabetic patients with chronic kidney disease on dialysis / E. de la Rosa-García [et al.] // Nefrologia. — 2013 Nov 13. — Vol. 33(6). — Р. 764-70. doi: 10.3265/Nefrologia.pre2013.
27. Fratto G. Use of psychotropic drugs and associated dental diseases / G. Fratto, L. Manzon // Int’l. J. Psychiatry In Medicine. — 2014. — Vol. 48(3). — Р. 185-197. doi: 10.2190/PM.48.3.d.
28. Relationships between oral health, dysphagia and undernutrition in hospitalised elderly patients / P. Poisson [et al.] // Gerodontology. — 2016. — Vol. 33, Issue 2. — P. 161-168. doi: 10.1111/ger.12123.
29. The Effect of Helicobacter pylori Infection, Aging, and Consumption of Proton Pump Inhibitor on Fungal Colonization in the Stomach of Dyspeptic Patients / S. Massarrat [et al.] // // Frontiers in Microbiology. — 2016. — Vol. 7. — Article 801. — 7 p. doi: 10.3389/fsimb.2016.00801.
30. Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America / P.G. Pappas [et al.] // Clin. Infect. Dis. — 2015. — Рublished online: December 16, 2015.
31. Morschhäuser J. The development of fluconazole resistance in Candida albicans — an example of microevolution of a fungal pathogen / J. Morschhäuser // J. Microbiol. — 2016. — 54(3). — Р. 192-201. doi: 10.1007/s12275-016-5628-4.
32. Press E.G. Candida Biofilm: Clinical Implications of Recent Advances in Research / E.G. Press, R.K. Shields, C.J. Clancy // Curr. Fungal Infect. Rep. — 2014. — Vol. 8. — Р. 72-80. doi: 10.1007/s12281-014-0176-z.
33. Wang H. Epidemiology of candidemia and antifungal susceptibility in invasive Candida species in the Asia-Pacific region / H. Wang, Y.C. Xu, P.R. Hsueh // Future Microbiol. — 2016. — 11. — Р. 1461-1477. doi: 10.2217/fmb-2016-0099.

/11-1.jpg)
/12-1.jpg)
/13-1.jpg)
/14-1.jpg)
/15-1.jpg)
/15-2.jpg)