Журнал «Здоровье ребенка» Том 14, №4, 2019
Вернуться к номеру
Метаболічна нефропатія в дітей: гендерні особливості екскреції оксалатів, зв’язок із вираженістю оксидативного стресу й системою антиоксидантного захисту
Авторы: Айб Н.Р.
Івано-Франківський національний медичний університет, м. Івано-Франківськ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Мета: дослідити гендерну залежність рівня екскреції оксалату при метаболічній нефропатії в дітей, стан оксидативного стресу й системи перекисного окиснення залежно від вираженості його екскреції. Матеріали та методи. У дослідження включено 176 дітей з оксалатною нефропатією та 84 практично здорових дітей. Проведене клінічне, інструментальне й лабораторне обстеження. Визначався рівень продуктів перекисного окиснення ліпідів (дієнових кон’югатів, малонового діальдегіду) та активність ферментів антиоксидантного захисту (глутатіону відновленого, глутатіон-пероксидази й каталази сироватки), проводився аналіз перекисного окиснення білків (альдегідо- й кетонопохідних динітрофенілгідразонів нейтрального й основного характеру). Результати. Рівень екскреції оксалатів і співвідношення оксалату/креатиніну в ранішній сечі в пацієнтів із метаболічною нефропатією є вірогідно вищим, ніж у групі контролю (р < 0,05). Абсолютний ризик виявлення високої й помірної секреції оксалатів у дівчаток на 62,0 % вищий, ніж у хлопчиків (p < 0,05). Помірне й високе співвідношення оксалату/креатиніну встановлено у 57,0 % дівчаток порівняно з 27,0 % хлопчиків. Низькі значення екскреції креатиніну й співвідношення оксалату/креатиніну частіше виявлялись у хлопчиків (p < 0,05). В усіх пацієнтів із метаболічною нефропатією спостерігалося вірогідне підвищення рівня альдегідо- й кетонопохідних нейтрального характеру (р < 0,05) порівняно з практично здоровими особами; встановлено вірогідне підвищення рівня альдегідо- й кетонопохідних основного характеру порівняно з контролем при помірній і високій екскреції оксалатів (р < 0,05). Помірна й виражена оксалатурія в дітей із метаболічною нефропатією супроводжувалась зниженням рівня плазмового й еритроцитарного малонового діальдегіду порівняно з відповідним показником у групі хворих із незначною оксалатурією (p < 0,05). У пацієнтів із метаболічною нефропатією активація процесів перекисного окиснення ліпідів супроводжувалась вірогідним зниженням концентрації супероксиддисмутази й підвищенням активності каталази й глутатіонпероксидази порівняно з контрольною групою (p < 0,05). Більш виражене підвищення рівня перекисного окиснення ліпідів встановлено в дітей із більш високим рівнем оксалурії (p < 0,05). Висновки. Існує гендерна залежність рівня екскреції оксалату при метаболічній нефропатії, стан оксидативного стресу й системи перекисного окиснення залежить від вираженості ранкової екскреції оксалатів.
Цель: исследовать гендерную зависимость уровня экскреции оксалата при метаболической нефропатии у детей, состояние оксидативного стресса и системы перекисного окисления в зависимости от выраженности его экскреции. Материалы и методы. В исследование включено 176 детей с оксалатной нефропатией и 84 практически здоровых детей. Проведены клиническое, инструментальное и лабораторное обследования. Определялся уровень продуктов перекисного окисления липидов (диеновых конъюгатов, малонового диальдегида) и активность ферментов антиоксидантной защиты (глутатиона восстановленного, глутатион-пероксидазы и каталазы сыворотки), проводился анализ перекисного окисления белков (альдегидо- и кетонопроизводных динитрофенилгидразонов нейтрального и основного характера). Результаты. Уровень экскреции оксалатов и соотношение оксалата/креатинина в утренней моче у пациентов с метаболической нефропатией были достоверно выше, чем в группе контроля (р < 0,05). Абсолютный риск высокого и умеренного уровня экскреции оксалатов у девочек на 62,0 % выше, чем у мальчиков (p < 0,05). Умеренное и высокое соотношение показателя оксалата/креатинина установлено у 57,0 % девочек по сравнению с 27,0 % мальчиков. Низкие значения экскреции креатинина и соотношение оксалата/креатинина чаще выявлялись у пациентов мужского пола (p < 0,05). У всех пациентов с метаболической нефропатией наблюдалось достоверное повышение уровня альдегидо- и кетонопроизводных нейтрального характера (р < 0,05) по сравнению с практически здоровыми лицами; установлено достоверное повышение уровня альдегидо- и кетонопроизводных основного характера при умеренной и высокой экскреции оксалатов (р < 0,05). Умеренная и выраженная оксалатурия у детей с метаболической нефропатией сопровождалась снижением уровня плазменного и эритроцитарного малонового диальдегида по сравнению с соответствующим показателем в группе больных с незначительной оксалатурией (p < 0,05). У пациентов с метаболической нефропатией активация процессов перекисного окисления липидов сопровождалась достоверным снижением концентрации супероксиддисмутазы и повышением активности каталазы и глутатионпероксидазы по сравнению с контрольной группой (p < 0,05). Более выраженное повышение уровня перекисного окисления липидов установлено у детей с более высоким уровнем оксалурии (p < 0,05). Выводы. Существует гендерная зависимость уровня экскреции оксалата при метаболической нефропатии, состояние оксидативного стресса и системы перекисного окисления зависит от выраженности утренней экскреции оксалатов.
Background. The purpose was to investigate gender features of oxalate excretion in metabolic nephropathy, the state of oxidative stress and antioxidant system, depending on oxalate excretion. Material and methods. One hundred seventy-six children with oxalate nephropathy and 84 healthy children were included in the study. Clinical, instrumental and laboratory methods were used. The level of lipid peroxidation (diene conjugates, malondialdehyde) and antioxidant protection enzyme (redox glutathione, glutathione peroxidase and serum catalase), and peroxidation of proteins (neutral and basic aldehyde and ketone derivatives of dinitrophenylhydrazone) were evaluated. Results. The level of oxalate excretion and oxalate/creatinine ratio in the first void urine of patients with metabolic nephropathy was significantly higher vs. control group (p < 0.05). The absolute risk of high and moderate oxalate excretion in girls was 62.0 % higher than that of boys (p < 0.05). The moderate and high oxalate/creatinine ratio was found in 57.0 % of girls and in 27.0 % of boys. Low levels of creatinine excretion and oxalate/creatinine ratio were detected in male patients (p < 0.05). All patients with metabolic nephropathy had significantly increased level of neutral aldehyde and ketone derivatives (p < 0.05) compared to control group. The level of basic aldehyde and ketone derivatives was significantly increased compared to controls in moderate and high oxalate excretion (p < 0.05). Moderate and severe oxalaturia in children with metabolic nephropathy was associated with a decreased plasma and erythrocytic malondialdehyde level compared to control group with mild oxalaturia (p1 < 0.05). In patients with metabolic nephropathy, the activation of the lipid peroxidation was accompanied by a significant decrease in superoxide dismutase, increased activity of catalase and glutathione peroxidase vs. control group (p < 0.05). Conclusions. There is gender dependence between the level of oxalate excretion in metabolic nephropathy; the state of oxidative stress and the system of peroxide oxidation depends on the intensity of first void urinary excretion of oxalates.
метаболічна нефропатія; оксалурія; оксидативний стрес; антиоксидантний захист
метаболическая нефропатия; оксалурия; оксидативный стресс; антиоксидантная защита
metabolic nephropathy; oxaluria; oxidative stress; antioxidant system
Вступ
Проблема дисметаболічних нефропатій є актуальною в педіатрії й дитячій нефрології. Це обумовлено високою частотою патології в популяції, а також її прогресуванням, навіть до розвитку сечокам’яної хвороби та/або інтерстиційного нефриту. Ефективне вирішення цієї проблеми можливе при комплексному аналізі досягнень нормальної й патологічної фізіології, клінічної медицини, патологічної анатомії, біохімії, фармакології, імунології й нефрології [1].
На думку багатьох авторів, виділяються ендогенні й екзогенні причини дисметаболічних нефропатій. До ендогенних відносять: підвищення біосинтезу оксалатів, гіперурикемію, порушення обміну цистину, фосфатурію, цукровий діабет, порушення обміну вітамінів, ішемічні нефропатії, електролітні порушення, гіперпаратиреоз. Екзогенні причини включають особливості харчування, питного режиму, екопатогени (кадмій, свинець, уран, органічні розчинники тощо), лікарські речовини, кліматичні особливості регіону [2, 3].
Також термін «дисметаболічна нефропатія» може використовуватися в більш вузькому сенсі — на позначення полігенної спадкової нефропатії, що підтверджується даними J.C. Taylor і співавт. [4], а також у багатьох інших дослідженнях [5, 6].
У літературі є численні вказівки на роль в розвитку оксалурії як зовнішніх, так і внутрішніх чинників [7]. Згідно з джерелами, підвищення екскреції щавлевої кислоти є наслідком споживання продуктів, багатих на оксалат [8].
У різних дослідженнях неодноразово вивчалась роль перекисного окиснення при діабетичній нефропатії [9], при нефропатії, індукованій хімічними агентами (алкоголем [10], важкими металами [11, 12], гліцеролом [13], лікарськими препаратами [14]).
Незважаючи на поодинокі дослідження ролі перекисного окиснення при оксалатній нефропатії в експерименті [15], ми не знайшли робіт про роль перекисного окиснення білків і ліпідів при метаболічній нефропатії в дитячому віці, зокрема, залежно від ступеня тяжкості оксалатної нефропатії й рівня екскреції оксалатів.
Мета роботи: дослідити гендерну залежність рівня екскреції оксалату при метаболічній нефропатії в дітей, стан оксидативного стресу й системи перекисного окиснення залежно від вираженості екскреції.
Матеріали та методи
У дослідження було включено 176 дітей з оксалатною нефропатією. Усі хворі проходили стаціонарне обстеження й лікування в Обласній дитячій клінічній лікарні (м. Івано-Франківськ). Контрольну групу становили 84 дитини без патології органів сечової системи.
Критеріями встановлення діагнозу дисметаболічної нефропатії в проведеному дослідженні були: 1) порушення обміну з оксалурією в анамнезі; 2) ехопозитивні включення в сечоводах і/або мисках; 3) сечовий синдром; 4) наявність інформованої згоди пацієнта на участь в дослідженні, обстеження й лікування відповідно до складеного протоколу дослідження.
Критеріями виключення були:
1) запальні, інфекційні й автоімунні захворювання нирок;
2) ниркова недостатність;
3) нефросклероз;
4) наявність соматичних захворювань у стадії декомпенсації;
5) психічні й неврологічні захворювання;
6) гострі інфекційні захворювання.
Серед пацієнтів згідно зі статевим розподілом було 37 хлопчиків (21,0 %) і 139 дівчаток (79,0 %). Середній вік обстежених становив 11,2 ± 5,4 року, з невірогідною різницею (р = 0,12) відносно контрольної групи — 12,1 ± 4,5 року, а також (р = 0,19) між дівчатками (12,5 ± 5,8 року) і хлопчиками (11,7 ± 5,9 року). У цілому тривалість захворювання становила 3,64 ± 1,30 року й коливалася від 2,0 міс. до 6 років.
Пацієнтам було проведене обстеження, що включало клінічні, інструментальні, лабораторні, а також спеціальні біохімічні, імунологічні й гормональні дослідження.
Для оцінки парціальних функцій нирок у дітей проводився забір ранкової або добової сечі, а наступного ранку — забір крові для біохімічних досліджень.
Інформовану згоду на участь у дослідженні підписали усі пацієнти клінічних груп та особи контрольної групи. Протокол обстеження хворих був складений відповідно до основних принципів Гельсінської декларації з біомедичних досліджень і затверджений на спільному засіданні адміністрації Івано-Франківської обласної дитячої клінічної лікарні й комісії з біоетичної експертизи Івано-Франківського національного медичного університету.
Забір крові проводився з ліктьової вени в період між 08:00 і 10:00 год після відпочинку в положенні сидячи й не менше ніж через 14 годин після останнього прийому їжі. В отриманих пробах визначали рівень продуктів перекисного окиснення ліпідів: дієнових кон’югатів (ДК) (спектрофотометрія гептанової фази екстракту ліпідів (Гаврилов В.Б. и др., 1983)), малонового діальдегіду (МДА; тест із тіобарбітуровою кислотою (Андреева Л.И. и др., 1988)), активність ферментів антиоксидантного захисту: глутатіону відновленого, глутатіон-пероксидази й каталази сироватки (за швидкістю розкладання перекису водню (Королюк М.А. и др., 1988)). Рівень малонового діальдегіду в сироватці крові визначали за реакцією з 2-тіобарбітуровою кислотою.
Парціальні функції нирок оцінювалися за величиною клубочкової фільтрації за формулою, запропонованою G.J. Schwartz.
Характер дисметаболічних порушень встановлювали за характером кристалурії, добової екскреції оксалатів [16].
Аналіз перекисного окиснення білків проводили методом О.Є. Дубініної та співавт. в одиницях оптичної щільності/г білка. Кількісне вимірювання проводили спектрофотометричним методом за допомогою напівавтоматичного спектрофотометра СФ 2000.
Для статистичного аналізу отриманих результатів використовували пакет програм обробки даних загального призначення Statistica for Windows версії 6.0 (StatSoft Іnc., США). Кількісні показники, що мали нормальний розподіл, подані у вигляді середнє ± стандартне відхилення. При р < 0,05 розбіжності вважали статистично вірогідними [17].
Результати
Першим кроком нашої роботи було визначення середньогрупових значень екскреції оксалату й показників оксалату/креатиніну в ранковій пробі сечі в дітей із метаболічною нефропатією порівняно з результатами досліджень контрольної групи. Отримані результати наведено на рис. 1, 2. Було встановлено, що середньогрупові значення метаболізму оксалату в пацієнтів із метаболічною нефропатією й у групі контролю вірогідно відрізнялись — 0,38 ± 0,04 ммоль/л проти 0,27 ± 0,03 ммоль/л (р < 0,05). Подібну закономірність отримано також при дослідженні співвідношення оксалату/креатиніну в ранішній сечі — 0,042 ± 0,005 проти 0,027 ± 0,004.
Доведено вищі показники екскреції оксалату порівняно з практично здоровими особами — як загальногрупові (рис. 1, 2), так і при гендерному розподілі (табл. 1).
Продемонстровано підвищення середньогрупових концентрацій оксалату в сечі як хлопчиків (р < 0,05), так і дівчаток (р < 0,05).
На наступному етапі дослідження було проведено розподіл хворих із метаболічною нефропатією на групи з незначним (підвищення рівня екскреції до 25 % відносно референтних значень), помірним (підвищення до 25–50 % відносно референтних значень) і високим (підвищення більше ніж на 50 % від референтних значень) рівнем екскреції оксалату, а також за співвідношенням оксалату/креатиніну.
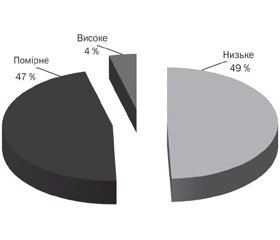
Розподіл хворих за рівнем екскреції оксалату в ранішній сечі наведено на рис. 3. Більшість пацієнтів були віднесені до групи з помірним підвищенням екскреції оксалатів (68,2 %, 120 пацієнтів, критерій — 0,33–0,42 ммоль/л). Незначне підвищення рівня екскреції (критерій — до 0,33 ммоль/л) мали 44 хворі (25 % обстежених). Високий вміст оксалатів (критерій — понад 0,42 ммоль/л) у ранішній сечі верифіковано в 6,8 % пацієнтів (12 хворих) серед усіх обстежених.
Дані, отримані відносно розподілу пацієнтів з метаболічною нефропатією за співвідношенням оксалату/креатиніну, наведені на рис. 4.
У більшого числа хворих (87 пацієнтів, 49,4 %) встановлено незначне підвищення рівня співвідношення (критерій — 0,033), у 82 пацієнтів (46,6 %) — помірне підвищення (критерій — 0,033–0,042), у невеликої кількості обстежених — 4,0 % (7 пацієнтів, критерій — понад 0,042) — значне підвищення співвідношення оксалату/креатиніну (рис. 4).
Виявлено, що абсолютний ризик виявлення високої й помірної секреції оксалатів у дівчаток на 62,0 % вищий, ніж у хлопчиків, із вірогідними показниками відносного ризику (3,1 [1,88–5,1]) і відношення шансів (27,5 [10,8–70,3]), p < 0,05.
Аналогічно розподілялися результати показника оксалату/креатиніну — помірне й високе співвідношення встановлено в 57,0 % дівчаток порівняно з 27,0 % хлопчиків (відносний ризик 2,1 [1,21–3,64], відношення шансів 3,56 [1,59–7,98]). Низькі значення екскреції креатиніну й співвідношення оксалату/креатиніну частіше виявлялись у хлопчиків (табл. 2).
З метою оцінки ролі вільнорадикальних реакцій для даної патології досліджувалось перекисне окиснення білків за вмістом у крові альдегідо- й кетонопохідних динітрофенілгідразонів нейтрального характеру та вмістом альдегідо- й кетонопохідних динітрофенілгідразонів основного характеру.
Вільнорадикальні реакції відіграють важливу регуляторну роль у багатьох метаболічних процесах, пов’язаних з обміном ліпідів, білків, нуклеїнових кислот, синтезом простагландинів, простациклінів, лейкотрієнів, тромбоксанів, катехоламінів, цитокінів тощо. Активні форми кисню (АФК) беруть участь в онтогенезі й клітинній проліферації, модуляції апоптозу, метаболізмі ксенобіотиків в організмі людини, регуляції тонусу судин, запаленні, канцерогенезі, старінні, впливають на транскрипцію певних генів.
Відомо, що АФК викликають окислювальну модифікацію білків за умов норми й патології. При цьому утворюються карбонільні похідні амінокислотних залишків, які є раннім індикатором опосередкованого активними кисневими метаболітами пошкодження органів і тканин і дають можливість кількісно оцінити ступінь такого пошкодження при різних патологічних станах.
При визначенні змін рівня окислювальної модифікації білків спостерігалося підвищення рівня альдегідо- й кетонопохідних нейтрального характеру в усіх досліджуваних пацієнтів, з вірогідними змінами (р < 0,05) у хворих з оксалурією порівняно з практично здоровими особами. У хворих із низькою екскрецією оксалатів цей показник перевищував норму на 8,2 %. При зіставленні груп з різним ступенем екскреції оксалатів відмічалося вірогідне (р < 0,05) підвищення рівня альдегідо- й кетонопохідних нейтрального характеру при високій і помірній екскреції.
Майже аналогічні зміни виявлені щодо рівня альдегідо- й кетонопохідних основного характеру з вірогідними змінами щодо контролю при помірній і високій екскреції оксалатів (р < 0,05).
Для оцінки ступеня оксидативного стресу й окиснення ліпідів у хворих із метаболічною нефропатією були визначені такі показники: вміст малонового діальдегіду в еритроцитах і плазмі крові, а також вміст дієнових кон’югатів в еритроцитах. В усіх групах (як при низькій, так і при високій і помірній екскреції) рівень еритроцитарного й плазмового МДА, а також вміст ДК були підвищеними порівняно з контрольними величинами (p < 0,05). За вмістом еритроцитарного МДА і ДК відмінностей між групами не виявлено.
Помірна й виражена оксалатурія в дітей із метаболічною нефропатією супроводжувалась зниженням рівня плазмового й еритроцитарного МДА порівняно з відповідним показником у групі хворих із незначною оксалатурією. В усіх групах показник МДА залишався вище від контрольного значення (p < 0,05).
Активність антиоксидантних ферментів в еритроцитах і загальний антиоксидантний статус сироватки крові дітей з метаболічною нефропатією наведені в табл. 5. Сталість антирадикального й антиперекисного потенціалів клітин в організмі забезпечує антиоксидантна система захисту. У пацієнтів із метаболічною нефропатією активація процесів перекисного окиснення ліпідів (ПОЛ) супроводжується вірогідним зниженням концентрації супероксиддисмутази (СОД) і підвищенням активності каталази й глутатіонпероксидази порівняно з контрольною групою (p < 0,05).
Обговорення
Отже, за результатами наших досліджень виявлено, що в дівчаток гіпероксалурія зустрічається частіше, ніж у хлопчиків. Виявлено високу інформативність дослідження концентрації оксалату й показника оксалату/ креатиніну.
За сучасними уявленнями, гомеостаз щавлевої кислоти в організмі підтримується за рахунок двох екзогенних джерел (їжа й аскорбінова кислота) й ендогенного метаболізму амінокислот гліцину й серину [18].
Перенасичення сечі оксалатами в кінцевому підсумку призводить до їх преципітації у вигляді кристалів. У нормі сеча являє собою перенасичений сольовий розчин, що перебуває в стані динамічної рівноваги за рахунок речовин (інгібіторів), які сприяють розчиненню або дисперсії її складових частин [18].
При порушенні цього дисбалансу, зокрема при запальному процесі або при спадкових особливостях метаболізму, цей дисбаланс порушується. Зазвичай важливим аспектом в розвитку кристалурії є співвідношення між процесами перекисного окиснення та станом оксидантного статусу. Відповідно до сучасних уявлень, при перекисному окисненні білків модифікації можуть піддаватися всі амінокислоти, але найбільш чутливими є залишки триптофану, тирозину, гістидину й цистеїну. АФК атакують функціональні групи амінокислот у складі білків, що призводить до утворення первинних амінокислотних радикалів, які можуть вступати у вторинні взаємодії із сусідніми амінокислотними залишками. У цілому створюється складна картина шкідливої дії АФК на білкові макромолекули [19]. Зниження активності ферментів антиоксидантного захисту, згідно з результатами досліджень, підвищує ризик гіпероксалурії [20].
Виходячи з того, що основним субстратом перекисного окиснення є поліненасичені жирні кислоти, можна очікувати збільшення жорсткості мембран, а отже, порушення проникності й функцій даної клітини. Особливо важливим при метаболічній нефропатії є посилення ПОЛ у паренхімі нирок, що може впливати на розвиток ускладнень і подальший прогноз при даній патології.
Висновки
1. Рівень екскреції оксалатів і співвідношення оксалату/креатиніну в пацієнтів із метаболічною нефропатією є вірогідно вищим, ніж у групі контролю, як у хлопчиків (р < 0,05), так і в дівчаток (р < 0,05).
2. Більшість мають помірний рівень ранішньої екскреції оксалатів (68,2 %, критерій — 0,33–0,42 ммоль/л); високий вміст оксалатів (критерій — понад 0,42 ммоль/л) верифіковано в 6,8 % обстежених.
3. Абсолютний ризик високої й помірної секреції оксалатів у дівчаток на 62,0 % вищий, ніж у хлопчиків, із вірогідними показниками відносного ризику (3,1 [1,88–5,1]) і відношення шансів (27,5 [10,8–70,3]), p < 0,05.
4. При метаболічній нефропатії спостерігається вірогідне підвищення рівня альдегідо- й кетонопохідних нейтрального характеру (р < 0,05) порівняно з конт–ролем; при помірній і високій екскреції оксалатів — вірогідне підвищення альдегідо- й кетонопохідних основ–ного характеру (р < 0,05).
5. В усіх групах (як при низькій, так і при високій і помірній екскреції) рівень еритроцитарного і плазмового МДА, а також уміст ДК були підвищеними порівняно з контрольними величинами (p < 0,05).
6. У пацієнтів із метаболічною нефропатією активація процесів ПОЛ супроводжувалась вірогідним зниженням концентрації СОД і підвищенням активності каталази й глутатіонпероксидази порівняно з конт–рольною групою (p < 0,05), особливо при більш високому рівні оксалурії (p1 < 0,05).
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
1. Harambat J., Kunzmann К., Azukaitis К. et al.; 4C Study Consortium. Metabolic acidosis is common and associates with disease progression in children with chronic kidney disease. Kidney Int. 2017. Vol. 17. P. 30330-30337.
2. Bevill M., Kattula А., Cooper C.S. et al. The Modern Metabolic Stone Evaluation in Children. Urology. 2017. Vol. 101. P. 15-20.
3. Lumlertgul N., Siribamrungwong M., Jaber B.L., Susantitaphong Р. Secondary Oxalate Nephropathy: A Systematic Review. Kidney Int. Rep. 2018. Vol. 3. № 6. P. 1363-1372.
4. Taylor J.C., Martin H.C., Lise S. et al. Factors influencing success of clinical genome sequencing across a broad spectrum of disorders. Nat. Genet. 2015. Vol. 47. № 7. P. 717-726.
5. Ma C.M., Lin L.H., Chang H.Y. et al. Association of congenital anomalies with fracture of spine, trunk, and upper and lower limbs among young people: A population-based matched cohort study in Taiwan. Medicine (Baltimore). 2017. Vol. 96. № 36. P. 7980.
6. Konkoľová J., Chandoga J., Kováčik J. et al. Severe child form of primary hyperoxaluria type 2 — a case report revealing consequence of GRHPR deficiency on metabolism. BMC Med. Genet. 2017. Vol. 18. № 1. P. 59.
7. Шестаев А.Ю., Паронников М.В., Протощак В.В. и др. Метаболизм оксалата и роль oxalobacter formigenes в развитии мочекаменной болезни. Экспериментальная и клиническая урология. 2013. № 2. С. 68-73.
8. Neuhaus T.J., Belzer Т., Blau N. et al. Urinary oxalate excretion in urolithiasis and nephrocal cinosis. Arch. Dis. Child. 2000. Vol. 82. P. 322-326.
9. Papadopoulou-Marketou N., Chrousos G.P., Kanaka-Gantenbein С. Diabetic nephropathy in type 1 diabetes: a review of early natural history, pathogenesis, and diagnosis. Diabetes Metab. Res Rev. 2017. Vol. 33. № 2. doi: 10.1002/dmrr.2841.
10. Latchoumycandane C., Nagy L.E., McIntyre T.M. Chronic ethanol ingestion induces oxidative kidney injury through taurine-inhibitable inflammation. Free Radic. Biol. Med. 2014. Vol. 69. P. 403-16.
11. Wongmekiat O., Peerapanyasut W., Kobroob А. Catechin supplementation prevents kidney damage in rats repeatedly exposed to cadmium through mitochondrial protection. Naunyn Schmiedebergs Arch. Pharmacol. 2018. Vol. 391. № 4. P. 385-394.
12. Abdelhalim M.A., Qaid H.A., Al-Mohy Y. et al. Effects of quercetin and arginine on the nephrotoxicity and lipid peroxidation induced by gold nanoparticles in vivo. Int. J. Nanomedicine. 2018. Vol. 13. P. 7765-7770.
13. Nara А., Yajima D., Nagasawa S. et al. Evaluations of lipid peroxidation and inflammation in short-term glycerol-induced acute kidney injury in rats. Clin. Exp. Pharmacol. Physiol. 2016. Vol. 43. № 11. P. 1080-1086.
14. Alhusaini A.M., Faddah L.M., Orabi El. et al. Role of Some Natural Antioxidants in the Modulation of Some Proteins Expressions against Sodium Fluoride-Induced Renal Injury. Biomed. Res Int. 2018. Vol. 28. P. 803.
15. Albert А., Tiwari V., Paul Е. et al. Oral administration of oxalate-enriched spinach extract as an improved methodology for the induction of dietary hyperoxaluric nephrocalcinosis in experimental rats. Toxicol. Mech. Methods. 2018. Vol. 28. № 3. P. 195-204.
16. Игнатова М.С. Детская нефрология. Руководство для врачей. 3-е изд., перераб. и доп. Москва: Мед. информ. агентство, 2011. 696 с.
17. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. Москва: Медиа-сфера, 2004. 312 с.
18. Борисова Т.П. Гипероксалурия и оксалатно-кальциевая кристаллурия: механизмы развития и возможности коррекции. Міжнародний журнал педіатрії, акушерства та гінекології. 2016. Т. 9. № 3. С. 53-37.
19. Шахристова Е.В., Степовая Е.А., Иванов В.В. и др. Окислительная модификация белков и система глутатиона в адипоцитах при сахарном диабете. Бюллетень сибирской медицины. 2014. Т. 13. № 3. С. 84-90.
20. Зверев Я.Ф., Жариков А.Ю., Брюханов В.М. и др. Модуляторы оксалатного нефролитиаза. Ингибиторы кристаллизации. Нефрология. 2010. 1(14). С. 29-49.

/54-1.jpg)
/55-1.jpg)
/56-1.jpg)
/57-1.jpg)