Журнал «Медицина неотложных состояний» №4(99), 2019
Вернуться к номеру
Відлучення від штучної вентиляції легень у пацієнта з постгіпоксичною енцефалопатією та центральною гіпертермією
Авторы: Філик О.В.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Актуальність. Постгіпоксичне ушкодження центральної нервової системи часто супроводжується поліорганною дисфункцією, персистуючим неврологічним дефіцитом та може ускладнитися центральною гіпертермією. Метою даного дослідження було проаналізувати літературні дані про методи лікування гіпертермії центрального генезу та запропонувати стратегію відлучення від респіраторної терапії в такого пацієнта. Матеріали та методи. Пошук літературних джерел проводився в базах даних PubMed та MedLine за останні 13 років. Пошуковими словами були «гіпертермія центрального генезу» та «відлучення від штучної вентиляції легень у дітей із постгіпоксичною енцефалопатією». Спостереження та лікування пацієнта здійснювалися на клінічній базі кафедри анестезіології та інтенсивної терапії Львівського національного медичного університету імені Данила Галицького у відділенні анестезіології з ліжками інтенсивної терапії КНП «Львівська обласна клінічна лікарня «ОХМАТДИТ» у вересні — жовтні 2018 року. Результати. У дитини віком 7 міс. після перенесеної клінічної смерті та успішного відновлення спонтанного кровообігу розвинулися постгіпоксична енцефалопатія, синдром поліорганної дисфункції та гіпертермія центрального генезу. Це призвело до зростання хвилинної вентиляції легень, тахікардії та, відповідно, труднощів із відлученням від респіраторної підтримки. Крім того, у пацієнта був клінічно значимий гіпертонус м’язів нижніх кінцівок з їх постійним спонтанним розведенням у кульшових суглобах понад 180°. В лікування був доданий баклофен у дозі 0,3 мг/кг/добу per os, яка через 7 днів була збільшена до 0,6 мг/кг/добу. На 3-тю добу від моменту призначення баклофену температура тіла стала стабільно нижчою за 38 °C, на 5-ту добу не перевищувала 37,5 °C. Відлучення від штучної вентиляції легень проводилося поетапно — від примусово-допоміжного режиму штучної вентиляції легень із поступовим зниженням параметрів підтримки до допоміжного режиму з щоденним збільшенням інтервалу спонтанного дихання пацієнта без респіраторної підтримки, починаючи від 2–4 год у денний період часу впродовж 2–3 днів та переходу до планової допоміжної вентиляції лише в нічний час і повного відлучення від допоміжної вентиляції. Повне відлучення від штучної вентиляції легень відбулося на 7-му добу з моменту призначення баклофену. Висновки. Контроль над гарячкою в пацієнтів, які перенесли ушкодження центральної нервової системи, може покращити результати лікування, особливо якщо буде розроблено більш ефективні стратегії моніторингу та лікування гіпертермії.
Актуальность. Постгипоксическое повреждение центральной нервной системы часто сопровождается полиорганной дисфункцией, персистирующим неврологическим дефицитом и может осложниться центральной гипертермией. Целью данного исследования было проанализировать литературные данные о методах лечения гипертермии центрального генеза и предложить стратегию отлучения от респираторной терапии у такого пациента. Материалы и методы. Поиск литературных источников проводился в базах данных PubMed и MedLine за последние 13 лет. Поисковыми словами были «гипертермия центрального генеза» и «отлучение от искусственной вентиляции легких у детей с постгипоксической энцефалопатией». Наблюдение и лечение пациента осуществлялись на клинической базе кафедры анестезиологии и интенсивной терапии Львовского национального медицинского университета имени Данила Галицкого в отделении анестезиологии с койками интенсивной терапии КНП «Львовская областная клиническая больница «ОХМАТДЕТ» в сентябре — октябре 2018 года. Результаты. У ребенка в возрасте 7 мес. после перенесенной клинической смерти и успешного восстановления спонтанного кровообращения развились постгипоксическая энцефалопатия, синдром полиорганной дисфункции и гипертермия центрального генеза. Это привело к росту минутной вентиляции легких, тахикардии и, соответственно, проблеме с отлучением от респираторной поддержки. Кроме того, у пациента был клинически значимый гипертонус мышц нижних конечностей с постоянным спонтанным разведением в тазобедренных суставах более 180°. В лечение был добавлен баклофен в дозе 0,3 мг/кг/сут per os, которая через 7 дней была увеличена до 0,6 мг/кг/сут. На 3-и сутки с момента назначения баклофена температура тела стала стабильно ниже 38 °C, на 5-е сутки не превышала 37,5 °C. Отлучение от искусственной вентиляции легких проводилось поэтапно — от принудительно-вспомогательного режима искусственной вентиляции легких с постепенным снижением параметров поддержки до вспомогательного режима с ежедневным увеличением интервала спонтанного дыхания пациента без респираторной поддержки, начиная от 2–4 ч в дневной период времени в течение 2–3 дней и перехода к плановой вспомогательной вентиляции только в ночное время и полному отлучению от вспомогательной вентиляции. Полное отлучение от искусственной вентиляции легких произошло на 7-е сутки с момента назначения баклофена. Выводы. Контроль над лихорадкой у пациентов, перенесших повреждения центральной нервной системы, может улучшить результаты лечения, особенно если будут разработаны более эффективные стратегии мониторинга и лечения гипертермии.
Background. Post-hypoxic injury of the central nervous system might lead to multiple organ dysfunction syndrome, persistent neurological impairment and be complicated by central hyperthermia. The aim of this study was to analyze the published data on central hyperthermia and present the clinical case of successful treatment of central hyperthermia and weaning from mechanical ventilation in the patient with post-hypoxic encephalopathy. Materials and methods. We analyzed the data from PubMed and MedLine databases (using the key words “central hyperthermia” and “weaning from mechanical ventilation in children with post-hypoxic encephalopathy”) for the last 13 years. In September 2018, our patient was admitted to Lviv Regional Clinical Hospital “OHMATDYT”, which is the clinical base of the Department of Anesthesiology and Intensive Care of Danylo Halytsky Lviv National Medical University. Results. We present a clinical case of post-hypoxic encephalopathy, multiple organ dysfunction syndrome and central hyperthermia (above 39 C) in a 7-month-old child survived after clinical death. In this case, central hyperthermia led to increased spontaneous minute volume ventilation, oxygen consumption and tachycardia and, as a result, to difficult weaning from mechanical ventilation. Moreover, this patient had clinically significantly increased muscle tone in lower extremities with hyperextension in hip joints (more than 180°). We started with baclofen administration at a dose of 0.3 mg/kg/day and raised the dose to 0.6 mg/kg/day at day 7. On day 3, the patient’s body temperature dropped to 38 °C and on day 5 it was no more than 37.5 °C. We weaned our patient from mechanical ventilation step by step: start from synchronized intermittent mandatory ventilation mode with decreasing the parameters every day, then continue with pressure support ventilation and start from 2–4 ventilator-free hours at day time during 2–3 days, then from day to day increase this ventilator-free time and provide mechanical ventilation only at night. Complete weaning was performed on day 7 from the baclofen treatment initiation. Conclusions. Hyperthermia control in patients with central nervous system injury might improve the treatment outcome, especially if more effective strategies for monitoring and treating hyperthermia will be developed and introduced in daily routine clinical practice.
відлучення від штучної вентиляції легень; гіпертермія центрального генезу; діти
отлучение от искусственной вентиляции легких; гипертермия центрального генеза; дети
weaning from mechanical ventilation; central hyperthermia; children
Вступ
Відлучення від штучної вентиляції легень (ШВЛ) включає процес поступового зниження параметрів підтримки та власне екстубацію пацієнта. Проте не всі пацієнти можуть бути екстубованими. У хворих із постгіпоксичним ушкодженням центральної нервової системи часто спостерігаються персистуючий неврологічний дефіцит та втрата захисних рефлексів (кашльового та ковтального). Така клінічна ситуація вимагає забезпечення захисту нижніх дихальних шляхів (наявності трахеостомічної трубки з манжеткою) як під час проведення ШВЛ, так і вже після відлучення від ШВЛ. З іншого боку, наявність трахеостомічної трубки полегшує процес відлучення, адже є можливість швидко відновити респіраторну підтримку пацієнта без інтубації трахеї.
У пацієнтів із постгіпоксичним ушкодженням центральної нервової системи (ЦНС) та лейкомаляцією часто відмічаються тахіпное та зростання хвилинної вентиляції легень під час гіпертонусу кінцівок та судомного синдрому. Це утруднює оцінювання готовності пацієнта до відлучення від ШВЛ та пролонгує респіраторну підтримку. Окрім того, при ушкодженні стовбура мозку та, зокрема, середнього мозку можливий розвиток центральної гіпертермії, що підвищує потребу організму в кисні та призводить до маніфестації дихальної недостатності і тахікардії.
Загальновідомо, що підвищення температури тіла є поліетіологічною проблемою, може бути як інфекційного, так і неінфекційного походження [6]. Висока температура тіла (понад 39 °C) в поєднанні з тахікардією (понад 110 уд/хв у дорослих пацієнтів), що розвиваються внаслідок ушкодження центральної нервової системи, корелюють з високим ризиком смерті [1]. Та навіть якщо пацієнти виживають в такій ситуації, то здебільшого залишаються в тяжкому недієздатному стані. Саме тому рання діагностика та лікування центральної гіпертермії є вкрай актуальним питанням. Вчасна верифікація та патогенетична терапія центральної гіпертермії створять передумови до швидшого відлучення від ШВЛ у таких пацієнтів.
Нами проведено аналіз літературних джерел (бази даних PubMed та MedLine за пошуковими словами «відлучення від ШВЛ» та «лікування гіпертермії центрального генезу») та клінічне спостереження і лікування пацієнта з постгіпоксичним ушкодженням ЦНС та гіпертермією центрального генезу у відділенні інтенсивної терапії.
Спостереження та лікування пацієнта відбувалися у вересні — жовтні 2018 року на клінічній базі кафедри анестезіології та інтенсивної терапії Львівського національного медичного університету імені Данила Галицького (відділення анестезіології з ліжками інтенсивної терапії КНП «Львівська обласна дитяча клінічна лікарня «ОХМАТДИТ»). Протокол висновку біоетичної комісії Львівського національного медичного університету імені Данила Галицького № 1 від 30.01.2018 року.
Клінічний випадок
Пацієнт К., 7 міс., маса тіла — 6,7 кг, надійшов у відділення анестезіології з ліжками інтенсивної терапії КНП ЛОДКЛ «ОХМАТДИТ» із центральної районної лікарні з діагнозом «постреанімаційна хвороба, постгіпоксичне ушкодження центральної нервової системи, синдром поліорганної недостатності: кома ІІІ, гостра дихальна недостатність, серцево-судинна дисфункція, гостра ниркова дисфункція». З анамнезу захворювання відомо, що 2 дні напередодні вранці він помер вдома, проводилася серцево-легенева реанімація працівниками швидкої медичної допомоги, які прибули на виклик через 15 хв після виявлення дитини батьками, спонтанний кровообіг було відновлено після 35 хв реанімації, пацієнт доставлений в центральну районну лікарню. В наступні дні дитина отримувала посиндромне лікування, її стан був стабілізований, але утримувалася поліорганна дисфункція, і для подальшого лікування пацієнта переведено в КНП ЛОДКЛ «ОХМАТДИТ».
Впродовж лікування у відділенні анестезіології з ліжками інтенсивної терапії КНП ЛОДКЛ «ОХМАТДИТ» дитина потребувала ШВЛ у зв’язку з тяжкою пневмонією та неврологічним дефіцитом (еквівалентно 3–4 балам за шкалою коми Глазго для інтубованих пацієнтів), з другого тижня лікування утримувалася гіпертермія понад 39 °C, що тяжко піддавалася терапії парацетамолом та нурофеном. Антибіотикотерапія проводилася з врахуванням даних про мікробіологічний пейзаж відділення, результатів посівів із нижніх дихальних шляхів пацієнта, рівня прокальцитоніну в крові та загального аналізу крові. Впродовж наступних трьох тижнів був досягнений регрес рентгенологічних ознак пневмонії. Дитині була проведена трахеостомія на 15-ту добу з моменту надходження на лікування (передбачалася довготривала ШВЛ, та був наявний тяжкий неврологічний дефіцит).
Впродовж лікування стан дитини покращився (з’явилися спонтанне відкривання очей, реакція на біль), за шкалою коми Глазго для інтубованиих пацієнтів хворого було оцінено в 6–8 балів, спонтанний кашльовий та ковтальний рефлекси були відсутніми, але утримувалася гіпертермія понад 38,5–39 °C. Посіви крові (неоднократно) були негативними, заміна центрального венозного катетера не призводила до покращання ситуації стосовно персистуючої гіпертермії. Факторів ризику інвазивного кандидозу та ймовірних вогнищ його розвитку при детальному клінічному та інструментальному обстеженні не знайдено. Рівень прокальцитоніну сироватки крові, а також показники загального аналізу крові (кількість лейкоцитів та частка незрілих форм лейкоцитів) та посівів із нижніх дихальних шляхів (табл. 1) свідчили про відсутність бактеріального генезу підвищення температури тіла.
Необхідно звернути увагу на те, що ліквор та кров пацієнта також були обстежені на наявність ДНК вірусів герпесу 1, 2, 6-го типів та вірусу вітряної віспи (Varicella zoster), отримано негативні результати. Хворому було виконано комп’ютерну томографію голови та шиї на другу добу з моменту надходження на лікування (верифікований набряк головного мозку) та двічі проведена магнітно-резонансна томографія голови: в динаміці наростала лейкомаляція та зменшувався об’єм паренхіми головного мозку із заміщенням її ліквором.
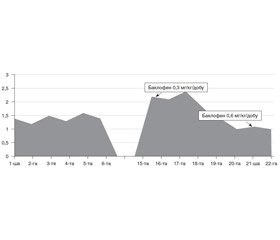
З третього тижня перебування на лікуванні в дитини розвинувся виражений гіпертонус ніг, спонтанне постійне розведення ніг у кульшових суглобах інколи перевищувало 180 градусів, періодично в пацієнта були тонічні судоми. В лікування була додана вальпроєва кислота в/в, дозу препарату було підібрано так, щоб рівень вальпроєвої кислоти в сироватці крові був у терапевтичному діапазоні 50–100 мкг/мл. Судом надалі не спостерігалося, проте, незважаючи на цю терапію, гіпертонус ніг утримувався, дитина реагувала на нього вираженим неспокоєм із тахікардією, утримувалися гіпертермія понад 39 °C та тахіпное з високою хвилинною вентиляцією легень, що не піддавалася корекції параметрами ШВЛ. Дитині було призначено баклофен у вигляді порошків, що вводились через назогастральний зонд, терапію розпочато з найменшої рекомендованої дози. Вже на 3-тю добу від моменту призначення баклофену (рис. 1) температура тіла дитини була стабільно нижчою за 38 °C, на 5-ту добу з моменту початку лікування вона не перевищувала 37,5 °C. Дитина була відлучена від ШВЛ на 7-му добу після того, як регресувала тахікардія (внаслідок постійної гіпертермії) та нормалізувалася хвилинна вентиляція легень до рівня, що був прийнятний для початку відлучення (рис. 2).
Стратегію відлучення від ШВЛ наведено на рис. 3. Вона проводилася поетапно: від примусово-допоміжного режиму ШВЛ із поступовим зниженням параметрів підтримки (кількості апаратних вдихів, пікового та допоміжного тиску на вдиху) до допоміжного режиму ШВЛ із поступовим зменшенням тиску підтримки на вдиху до досягнення його на рівні 12–13 см вод.ст. та фракції вдихуваного кисню 30–35 %.
На кожному з етапів цільовими точками ефективності респіраторної терапії були: спонтанна хвилинна вентиляція легень не нижче 75 % від норми для даного віку та маси тіла, об’єм видиху не менше 5–6 мл/кг маси тіла, спонтанний піковий інспіраторний тиск не менше 15–16 см вод.ст., частота дихання не вище 10–15 % від верхньої межі вікової норми, стан компенсації за показниками кислотно-лужної рівноваги артеріальної та центральної венозної крові, відсутність неспокою та ажитації пацієнта. Відлучення на етапі проведення допоміжної ШВЛ проводили зі щоденним збільшенням інтервалу спонтанного дихання пацієнта без респіраторної підтримки, починаючи від 2–4 год у денний період часу впродовж 2–3 днів до поступового збільшення цього часу до 4–8 год у денний період часу впродовж наступних 2 днів, із переходом до планової допоміжної вентиляції лише в нічний час (із 24-ї до 6–8-ї год ранку) впродовж наступних 2 днів та повним відлученням від допоміжної вентиляції та подачі зволоженого кисню через вологообмінний фільтр ТСТ упродовж 2–3 наступних днів.
На 7-му добу від моменту регресу гіпертермії пацієнта було переведено в соматичне відділення для подальшого лікування.
Обговорення
Даний клінічний випадок демонструє нечасту проблему інтенсивної терапії, а саме гостру дихальну недостатність із потребою в респіраторній терапії внаслідок високої хвилинної вентиляції легень та підвищення потреби організму в кисні на фоні персистуючої гіпертермії центрального генезу. Відомо, що потреба організму в кисні залежить від віку та може коливатися від 6–8 мл/кг/хв у новонароджених дітей до 4 мл/кг/хв у дорослих осіб. Підвищення хвилинної вентиляції легень призводить до надмірної роботи дихальних м’язів та не вирішує проблеми кисневого дефіциту в пацієнта.
Ушкодження головного мозку внаслідок зупинки кровообігу, що і спостерігалося в нашого пацієнта, є добре вивченою, проте комплексною проблемою, яка включає множинні механізми, зокрема загибель клітин, ексайтотоксичність, зміни сигналінгу між клітинами, ішемію, реперфузію та порушення клітинного метаболізму. Це все дуже подібно до тих механізмів, які описані для інших причин ушкодження центральної нервової системи, тому механізми порушення термогенезу, ймовірно, є подібними для більшості гострих ушкоджень ЦНС [6]. За літературними даними, пролонгована центральна гіпертермія після ушкодження середнього мозку є достатньо рідкісним захворюванням, що зумовлене втратою можливості до терморегуляції в стовбурі мозку. Незважаючи на те, що ця патологія відома давно, знання про її лікування залишаються незначними [1]. Гіпертермія центрального генезу після ушкодження ЦНС корелює з високим рівнем летальності та потребує численних обстежень, щоб виключити її інфекційне походження [1, 3–5]. У разі, коли центральна гіпертермія супроводжується судомним синдромом та гіпертонусом м’язів, не виключеною причиною її виникнення є і рабдоміоліз, що, ймовірно, і спостерігався в нашого пацієнта.
Гарячка потенційно може бути вторинним пошкоджуючим механізмом для ЦНС [4]. Одиничний епізод гіпертермії може спричинити короткочасну неврологічну чи когнітивну дисфункції, що можуть бути довготривалими або постійними. Тоді як мозочок є практично нечутливим до ефектів тепла. Гіпертермія, що наявна при гострому ушкодженні мозку, погіршує прогноз перебігу захворювання [6].
У літературі описані випадки порушення терморегуляції, що виникають переважно в перші 24–48 год після геморагічного інсульту в осіб похилого віку [3, 6], а причиною гіпертермії, що розвивається без жодних ознак інфекції та її джерела, є порушення роботи центру терморегуляції. Вона не піддається медикаментозній терапії та потребує використання спеціальних девайсів (охолоджуючої ковдри з циркулюючою холодною водою в ній), при цьому температура тіла пацієнтів залишається нестабільною. Так, температура тіла пацієнтки коливалася від 35 до 40 °C, що також суттєво не покращує результатів лікування [3]. Тому використання фізичних методів охолодження при такій клінічній ситуації лише маскує проблему та не вирішує її.
Відомо, що сепсис спричиняє до 74 % всіх епізодів гарячки в госпіталізованих пацієнтів, у решти пацієнтів найчастішими причинами є злоякісні новоутворення, ішемія тканин, реакція на медикаменти [3, 5]. У нашому клінічному випадку наявна бактеріальна інфекція (пневмонія) тривалий час цілком обгрунтовано вважалася основною причиною підвищення температури тіла в пацієнта, і верифікація гіпертермії центрального генезу була несвоєчасною. Ретроспективно очевидним є і те, що висока робота дихання теж могла мати підгрунтя не тільки порушення механіки дихання внаслідок пневмонії, але й постійно високої температури тіла. Однозначною причиною високої хвилинної вентиляції легень у пацієнта вже після регресу ознак пневмонії можна вважати виражений гіпертонус нижніх кінцівок із больовим синдромом та центральну гіпертермію.
На сьогодні в літературі описано лише клінічні випадки корекції центральної гіпертермії в дорослих пацієнтів після ушкодження головного мозку та відсутні рандомізовані дослідження. Найбільш цитованими є статті, що описують застосування баклофену з цією метою (також поодиноко зустрічаються повідомлення про використання бромокриптину) [2, 3].
Баклофен — це єдиний селективний GABA-B-агоніст, доступний до використання на фармацевтичному ринку. GABA-B-рецептори відіграють центральну роль у контролі вивільнення нейротрансмітерів, а з доклінічних досліджень добре відомо, що модуляція цих рецепторів модифікує процеси в головному мозку та вивільнення допаміну в мезолімбічній зоні. Баклофен дозволено використовувати для лікування спастичних проявів при неврологічних захворюваннях. Проте його офлейбл застосування включає лікування алкогольної залежності та гіпертермії центрального генезу [2]. У педіатричній практиці, коли йдеться про лікування загрозливих для життя та клінічно рідкісних захворювань, приблизно 70 % всіх медикаментів використовуються за офлейбл-показаннями.
Лихоманка, що виникає в ранньому періоді захворювання головного мозку в дітей, пов’язана з гіршим результатом лікування. Таким чином, прицільний моніторинг температури в гострому періоді лікування та впровадження цільового температурного менеджменту для запобігання лихоманці у тяжкохворих дітей можуть бути важливими компонентами інтенсивної терапії в неврологічних хворих, проте це ще не перевірено в рандомізованих контрольованих дослідженнях [5, 7]. Тому контроль над гарячкою в пацієнтів, які перенесли ушкодження ЦНС, може покращити результати лікування, особливо якщо будуть розроблені більш ефективні стратегії моніторингу та лікування гіпертермії.
Висновки
Респіраторна терапія завжди покликана досягнути «респіраторного комфорту» для пацієнта, тому основними показниками адекватності її проведення є адекватна спонтанна хвилинна вентиляція легень пацієнта, частота спонтанного дихання та стан кислотно-лужної рівноваги. Така супутня клінічна проблема, як «вперта» гіпертермія, підвищує хвилинну вентиляцію легень та віддаляє від пацієнта час його відлучення від ШВЛ. Тому контроль над гарячкою в пацієнтів, які перенесли ушкодження ЦНС, може покращити результати лікування, особливо якщо будуть розроблені більш ефективні стратегії моніторингу та лікування гіпертермії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Lee H.C., Lim J.K., Kim S.K., Kim J.M., Jo Y.S. Central Hyperthermia Treated With Baclofen for Patient With Pontine Hemorrhage. Ann. Rehabil. Med. 2014. Vol. 38(2). P. 269-272. Published online 2014 Apr 29. doi: 10.5535/arm.2014.38.2.269.
2. Durant C.F., Louise M.L., Turton S., Wilson S.J., Myers James F.M., Muthukumaraswamy S. [et al.]. Using Baclofen to Explore GABA-B Receptor Function in Alcohol Dependence: Insights From Pharmacokinetic and Pharmacodynamic Measures. Front. Psychiatry. 2018. Vol. 9. P. 664. Published online 2018 Dec 14. doi: 10.3389/fpsyt.2018.00664.
3. Huang Y.S., Hsiao M.C., Lee M., Huang Y.C., Lee J.D. Baclofen successfully abolished prolonged central hyperthermia in a patient with basilar artery occlusion. Acta Neurol. Taiwan. 2009. Vol. 18(2). P. 118-22.
4. Dietrich W.D., Bramlett H.M. Hyperthermia and central nervous system injury. Prog. Brain Res. 2007. Vol. 162. P. 201-17.
5. Newmyer R., Mendelson J., Pang D., Fink E.L. Targeted Temperature Management in Pediatric Central Nervous System Disease. Curr. Treat Options Pediatr. 2015. Vol. 1(1). P. 38-47. doi: 10.1007/s40746-014-0008-y.
6. Walter E.J., Carraretto M. The neurological and cognitive consequences of hyperthermia. Crit. Care. 2016. Vol. 20. P. 199. doi: 10.1186/s13054-016-1376-4.
7. Walter E.J., Hanna-Jumma S., Carraretto M., Forni L. The pathophysiological basis and consequences of fever. Crit. Care. 2016. Vol. 20. P. 200. doi: 10.1186/s13054-016-1375-5.

/150-1.jpg)
/151-1.jpg)
/152-1.jpg)