Международный эндокринологический журнал Том 15, №4, 2019
Вернуться к номеру
До питання оцінки серцево-судинного ризику у хворих на первинну хронічну подагру в поєднанні з метаболічним синдромом
Авторы: Черняєва А.О. (1, 2), Микитюк М.Р. (1, 2), Караченцев Ю.І. (1), Кравчун Н.О. (1)
1 - Харківська медична академія післядипломної освіти МОЗ України, м. Харків, Україна
2 - ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета дослідження: з’ясувати частоту метаболічного синдрому (МС) і оцінити сумарний серцево-судинний ризик у хворих на первинну хронічну подагру залежно від наявності МС. Матеріали та методи. Обстежено 82 хворих на первинну хронічну подагру. Захворювання діагностовано на підставі кваліфікаційних критеріїв S.І. Wallаsе і співавт. В основну групу ввійшли хворі на подагру з МС (n = 52), які становили 63,4 % від усіх обстежених. Метаболічний синдром діагностували за критеріями IDF. Групу порівняння становили хворі на МС репрезентативного віку і статі (n = 46). Проведено клінічне (антропометричні параметри, рівень артеріального тиску) і лабораторне обстеження (рівень глікемії натще, сечової кислоти, ліпідограма, пероральний тест толерантності до глюкози), оцінено дані про наявність в анамнезі серцево-судинних захворювань та їх ускладнень, серцево-судинний ризик за шкалами SCORE і PROCAM. Результати. Частота ожиріння в досліджуваних групах становила 65,4 і 63,0 % відповідно. Частота додаткових критеріїв МС була високою в обох досліджуваних групах. Артеріальна гіпертензія (АГ) і гіпертригліцеридемія виявлялися у хворих на МС незалежно від наявності подагричного артриту (р < 0,001). Принаймні один додатковий критерій МС виявлено в усіх обстежених. У 28,8 % хворих основної групи і у 4,3 % хворих групи порівняння було виявлено усі п’ять додаткових критеріїв МС (р < 0,01). У хворих основної групи частіше, ніж у групі порівняння, виявляли більше трьох додаткових критеріїв МС — 51,9 і 30,4 % відповідно (р < 0,01). Сумарний серцево-судинний ризик за шкалами SCORE і PROCAM у хворих основної групи був значуще вищим, ніж у групі порівняння (р < 0,05 і р < 0,01 відповідно). Висновки. У 63,4 % хворих на первинну хронічну подагру діагностовано МС. Хворі на первинну хронічну подагру з МС мають більш високий сумарний серцево-судинний ризик за шкалами SCORE і PROCAM порівняно з хворими на МС. Оцінка критеріїв МС поряд з оцінкою серцево-судинного ризику може використовуватися в рутинній клінічній практиці для стратифікації хворих на первинну хронічну подагру, які потребують модифікації способу життя і/або диференційованих підходів до медикаментозного лікування.
Цель исследования: изучить частоту метаболического синдрома (МС) и оценить суммарный сердечно-сосудистый риск у больных с первичной хронической подагрой в зависимости от наличия МС. Материалы и методы. Обследованы 82 больных с первичной хронической подагрой, диагностированной с учетом квалификационных критериев S.І. Wallаsе и соавт. В основную группу вошли больные подагрой с МС (n = 52), которые составили 63,4 % всех обследованных. МС диагностировали по критериям IDF. Группу сравнения составили больные МС, репрезентативные по полу и возрасту (n = 46). Проведено клиническое (антропометрические параметры, артериальное давление) и лабораторное обследование (уровень гликемии натощак, мочевой кислоты, липидограмма, пероральный тест толерантности к глюкозе), учтено наличие в анамнезе сердечно-сосудистых заболеваний и их осложнений, оценен сердечно-сосудистый риск по шкалам SCORE и PROCAM. Результаты. Частота ожирения в исследуемых группах составила 65,4 и 63,0 % соответственно. Частота дополнительных критериев МС была высокой в обеих исследуемых группах. Артериальная гипертензия и гипертриглицеридемия одинаково часто диагностировались у больных с МС независимо от наличия подагрического артрита (р < 0,001). Как минимум один дополнительный критерий МС выявлялся у всех обследуемых. У 28,8 % больных основной группы и у 4,3 % пациентов группы сравнения диагностированы все пять дополнительных критериев МС (р < 0,01). У больных основной группы чаще, чем в группе сравнения, выявляли более трех дополнительных критериев МС — 51,9 и 30,4% соответственно (р < 0,01). Суммарный сердечно-сосудистый риск по шкалам SCORE и PROCAM у больных основной группы был значимо выше, чем в группе сравнения (р < 0,05 и р < 0,01 соответственно). Выводы. МС диагностировали у 63,4 % больных с первичной хронической подагрой. Больные с первичной хронической подагрой в сочетании с МС имеют более высокий суммарный сердечно-сосудистый риск по шкалам SCORE и PROCAM в сравнении с больными с МС. Оценка критериев МС наряду с оценкой сердечно-сосудистого риска может быть использована в рутинной клинической практике для стратификации больных с первичной хронической подагрой, нуждающихся в модификации образа жизни и/или дифференцированных подходах к медикаментозному лечению.
Background. The purpose of the study is to ivestigate the frequency of metabolic syndrome (MS) and to assess the total cardiovascular risk in patients with primary chronic gout, depending on the presence of MS. Materials and methods. Eighty-two patients with primary chronic gout, diagnosed with the qualification criteria of S.J. Wallase et al., were examined. The basic group included patients with primary chronic gout with MS (n = 52), which accounted for 63.4 % of all surveyed persons. The MS was diagnosed by IDF criteria. The comparison group involved patients with MS, matched by sex and age (n = 46). Clinical (anthropometric parameters, blood pressure) and laboratory examination (level of fasting glycaemia, uric acid, lipid, oral glucose tolerance test) took into account the presence of cardiovascular disease in medical history and its complications, evaluated cardiovascular risk on SCORE and PROCAM scales. Results. The incidence of obesity in the study groups was 65.4 and 63.0 %, respectively. The frequency of additional MS criteria was high in both groups studied. Hypertension and hypertriglyceridemia were equally often diagnosed in patients with MS regardless of the presence of gouty arthritis (p < 0.01). At least one additional MS criterion was detected in all those patients surveyed. 28.8 % of patients in the basic group and 4.3% patients in the comparison group were diagnosed with all five additional MS criteria (p < 0.01). In the patients of the basic group more than three additional MS criteria were identified compared to the comparison group — 51.9 and 30.4 %, respectively. The total cardiovascular risk on SCORE and PROCAM scales in patients in the basic group was significantly higher than in the comparison group (p < 0.05 and p < 0.01, respectively). Conclusions. MS was diagnosed in 63.4 % of patients with primary chronic gout. The patients with primary chronic gout combined with MS have a higher total cardiovascular risk on SCORE and PROCAM scales compared to patients with MS only. Evaluation of MS criteria, together with the assessment of cardiovascular risk, can be used in routine clinical practice to stratify patients with primary chronic gout who need lifestyle modifications and/or differentiated approaches to medical treatment.
первинна хронічна подагра; метаболічний синдром; сечова кислота; серцево-судинний ризик
первичная хроническая подагра; метаболический синдром; мочевая кислота; сердечно-сосудистый риск
primary chronic gout; metabolic syndrome; uric acid; cardiovascular risk
Вступ
Гіперурикемія, подагра, артеріальна гіпертензія (АГ) і метаболічний синдром (МС) — дуже поширені патологічні стани, що можуть поєднуватися в одного хворого. Результати досліджень дають все більше доказів, що порушення балансу сечової кислоти (СК) є важливим етіологічним фактором такої актуальної для сьогодення патології, як серцево-судинні захворювання (ССЗ), хронічна хвороба нирок, цукровий діабет 2-го типу, дисфункція щитоподібної залози, псоріаз тощо. Доведено, що гіперурикемія і подагра асоційовані з кардіоваскулярною коморбідністю і високим серцево-судинним ризиком [1–3].
Незважаючи на когерентність цих патофізіологічних термінів, потребують уточнення деталі встановленого асоціативного зв’язку, який може бути незалежним або причинно-наслідковим. У рутинній клінічній практиці фактори ризику серцево-судинної патології повинні бути ретельно оцінені та модифіковані, а хворі з порушеннями балансу СК мають отримувати адекватне лікування [4]. Показано, що профілактичне лікування антигіперурикемічними засобами безсимптомної гіперурикемії знижує ризик ССЗ [5].
Відомо, що більшість клінічних випадків подагри супроводжуються ознаками МС [6]. МС — це поєднання різних порушень обміну речовин, кожне з яких є незалежним фактором ризику ССЗ [7, 8]. Доведено зв’язок між інсулінорезистентністю (ІР) і окремими компонентами МС і їх внесок у ризик смертності від ССЗ [9, 10]. Ідентифікація МС у хворих на первинну хронічну подагру в поєднанні з оцінкою 10-річного серцево-судинного ризику може використовуватися для стратифікації груп ризику, які потребують не тільки модифікації способу життя, але й диференційованих підходів до лікування.
З урахуванням основних пріоритетів сучасної медицині загострюється інтерес до вивчення зв’язку між подагрою і кардіоваскулярною патологією. Показано, що МС відзначається у 62,8 % хворих на подагру і тільки у 25,4 % без цього захворювання. Доведено, що частота ІР у хворих на подагру на 35 % вища, ніж у групі хворих без подагричного артриту [11].
Показано, що від АГ страждають 20–50 % хворих на подагру і 20–40 % хворих на АГ мають подагричний артрит [12]. Серед можливих впливів гіперурикемії на розвиток АГ обговорюється безпосередня стимуляція ренін-ангіотензинової системи, гальмування судинного синтезу оксиду азоту, стимуляція проліферації гладком’язових клітин судинної стінки та розвиток інтерстиціального нефриту й ураження ниркових канальців [13–15]. Окрім впливу гіперурикемії на формування коронарного атеросклерозу, показано наявність зв’язку її з розвитком атеросклеротичного ураження сонних артерій, інсультом, прееклампсією і судинною деменцією [16–18]. Отже, проблема вивчення ролі гіперурикемії і МС у розвитку і прогресуванні ССЗ є досить актуальною.
Мета дослідження: з’ясувати частоту МС і оцінити сумарний серцево-судинний ризик у хворих на первинну хронічну подагру залежно від наявності МС.
Матеріали та методи
Обстежено 82 хворих на первинну хронічну подагру, які перебували на стаціонарному лікуванні в ревматологічному відділенні Комунального некомерційного підприємства «Міська лікарня № 28» Харківської міської ради. Захворювання діагностовано на підставі кваліфікаційних критеріїв S.І. Wallаsе і співавт. [19]. В основну групу ввійшли хворі на подагру з МС (n = 52), які становили 63,4 % від усіх обстежених. МС діагностували за критеріями IDF [6, 20]. Групу порівняння становили хворі на МС репрезентативного віку і статі (n = 46).
Наявність та ступінь ожиріння визначали за індексом маси тіла (ІМТ), згідно з критеріями ВООЗ (2000) [21]. ІМТ від 25,0 до 29,9 кг/м2 оцінювали як надлишок маси тіла, від 30,0 до 34,9 кг/м2 — як ожиріння I ступеня, від 35,0 до 39,9 кг/м2 — як ожиріння II ступеня, 40,0 та вище — як ожиріння III ступеня. Обвід талії (ОТ) (см) вимірювали у вертикальному положенні хворого на середині відстані між нижнім краєм грудної клітки і гребенем здухвинної кістки по середньопахвинній лінії.
Рівень глікемії натще (ммоль/л) і впродовж перорального тесту толерантності до глюкози визначали в плазмі капілярної крові глюкозооксидазним методом на аналізаторі Biosen C-line (EKF, Німеччина).
Зразки венозної крові отримували з кубітальної вени натще. Рівень загального холестерину (ЗХС) (ммоль/л) визначали колориметричним методом за допомогою комерційного набору («СпайнЛаб», Україна), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) (ммоль/л) — методом осадження в сироватці за допомогою комерційного набору «Холестерин ЛПВЩ ФС» («СпайнЛаб», Україна) і тригліцеридів (ТГ) (ммоль/л) — колориметричним методом за допомогою наборів «Діаліпон ДС» (ЗАО «Діакон-ДС», Росія) на апараті «Флюорат-02-АБЛФ-Т». Рівень холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) (ммоль/л) і холестерину ліпопротеїнів дуже низької щільності (ммоль/л) визначали розрахунковим методом за формулами Фридвальда [22].
Рівень СК у сироватці крові досліджувався колориметричним методом за допомогою набору реагентів «СпайнЛаб, Uricase-POD» (Україна).
Рівень артеріального тиску (АТ) вимірювали на плечовій частині лівої верхньої кінцівки на рівні серця за допомогою класичного механічного сфігмоманометра CS-110 Premium з манжетою відповідного розміру. Вимірювання АТ проводили після 5–10 хвилин перебування хворого в стані спокою у положенні сидячи. Рівень АТ розраховували як середнє трьох послідовних вимірювань. АГ діагностували за рівня АТ > 140/90 мм рт.ст. [23].
Оцінювали дані про наявність ССЗ та їх ускладнень в анамнезі. Серцево-судинний ризик оцінювали за шкалами SCORE за допомогою on-line калькулятора для вільного користування [24] і PROCAM [25].
Статистичний аналіз отриманих даних проведено за програмним комплексом Statgraphics Plus for Windows 3.0 (Manugistic Inc., США). Нормальність розподілу змінних визначали за допомогою тесту Шапіро — Уїлка. Для статистичної оцінки розбіжностей між емпіричними і теоретичними частотами варіаційного ряду застосовували критерій хі-квадрат (χ2) з поправкою Yates. Зв’язок між змінними встановлювали за допомогою кореляційного аналізу (r). Отримані результати подано в таблицях у вигляді /300-2.jpg) ± s; Ме; Min-Max, де
± s; Ме; Min-Max, де /300-2.jpg) — середнє арифметичне, s — стандартне відхилення, Ме — медіана, Min — мінімальне значення показника у вибірці, Max — максимальне значення показника у вибірці.
— середнє арифметичне, s — стандартне відхилення, Ме — медіана, Min — мінімальне значення показника у вибірці, Max — максимальне значення показника у вибірці.
Результати
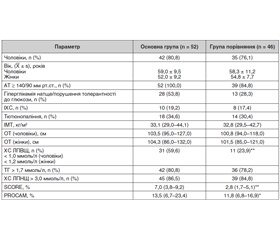
Результати обстеження хворих досліджуваних груп подано в табл. 1.
За даними табл. 1, у досліджуваних групах переважали чоловіки (80,8 і 76,1 % відповідно), медіана тривалості захворювання на момент звернення до лікаря в основній групі становила 5,8 (2,8–9,0) року.
Ожиріння в основній групі спостерігалося у 34 (65,4 %) хворих. Розподіл хворих у цій групі за ступенем ожиріння був такий: I ступеня — у 23 (44,2 %) хворих, II ступеня — у 8 (15,4 %), III ступеня — у 3 (5,8 %). В групі порівняння ожиріння виявлено у 29 (63,0 %) хворих: у 24 (52,2 %) хворих — I ступеня, у 3 (6,5 %) — II ступеня, у 2 (4,3 %) — III ступеня. В інших хворих досліджуваних груп значення ІМТ відповідало надмірній масі тіла. Абдомінальний тип ожиріння однаково часто мали хворі досліджуваних груп. Ожиріння II і III ступеня частіше виявлялося в основній групі (15,4 і 5,8 % відповідно), ніж у хворих групи порівняння (6,5 і 4,3 % відповідно) (р < 0,01).
Частота додаткових критеріїв МС була високою в обох досліджуваних групах (табл. 1). АГ і гіпертригліцеридемія виявлялися у хворих на МС незалежно від наявності подагричного артриту (р < 0,001). Лише за кількістю хворих із гіпо-α-холестеринемією групи значуще відрізнялися (табл. 1). Принаймні один додатковий критерій МС було виявлено в усіх обстежених. У 15 (28,8 %) хворих основної групи і у 2 (4,3 %) хворих групи порівняння було виявлено усі п’ять додаткових критеріїв МС (р < 0,01). У хворих основної групи частіше, ніж у групі порівняння, виявляли більше трьох додаткових критеріїв МС — 27 (51,9 %) і 14 (30,4 %) відповідно (р < 0,01).
Сумарний серцево-судинний ризик за шкалами SCORE і PROCAM був значуще вищим у хворих основної групи, ніж у групі порівняння (табл. 1). Отже, у хворих на первинну хронічну подагру в поєднанні з МС високий серцево-судинний ризик може бути обумовлений дисліпідемією, що тісно корелює з вираженістю гіперурикемії [26].
Ішемічну хворобу серця (ІХС) діагностовано у 19,2 % хворих основної групи, у 4 з них (7,7 %) в анамнезі був інфаркт міокарда. Гостре порушення мозкового кровообігу (ГПМК) в анамнезі було у 3 (5,8 %) хворих. У групі порівняння від ІХС страждало 17,4 % хворих; хворих на ГПМК в анамнезі не було.
Обговорення
З огляду на вищевикладене подагру слід розглядати як мультидисциплінарну патологію, якій притаманний високий серцево-судинний ризик. За даними 2007–2008 років, близько 8,3 мільйона дорослого населення Сполучених Штатів Америки страждає від подагри, а за останні 20 років поширеність цієї патології зросла на 1,2 % [27, 28].
Значне підвищення серцево-судинного ризику за шкалами SCORE і PROCAM викликають ЗХС, ХС ЛПНЩ і ТГ, рівні яких значуще вище за більш високі сумарні значення ризику ССЗ, розраховані за шкалами.
Отримана при проведенні дослідження висока частота МС (30,1–82,0 %) у хворих на первинну хронічну подагру збігається з даними інших авторів [29–31]. Серед додаткових компонентів МС у хворих на подагру АГ і гіпертригліцеридемія виявлялися у 100 і 80,8 % випадків відповідно. Про таку частоту АГ і гіпертригліцеридемії серед загалу хворих на подагру повідомляють Y. Rho і співавт. [32] та J. Vazguez-Mellado і співавт. [26].
Отримані дані стосовно частоти ССЗ у хворих на подагру дещо нижчі, ніж ті, про які повідомляє H.J. Janssens і співавт. [33]. Цікаво, що частота ССЗ у досліджуваних групах значуще не відрізнялася, що, можливо, пов’язано з недостатньою чисельністю групи порівняння (табл. 1). Що стосується додаткових критеріїв МС і загальноприйнятих факторів ризику ССЗ, то отримані дані дещо відрізняються від вищезгаданого дослідження [28]. АГ виявлено у 100 % хворих основної групи і у 84,8 % хворих групи порівняння; ожиріння — у 65,4 і 63,0 % відповідно (табл. 1). Отримані результати значно вищі, ніж у відомих епідеміологічних дослідженнях, що пояснюється дизайном дослідження — вивчалися хворі на МС без подагри.
Розраховані сумарні ризики ССЗ за шкалами SCORE і PROCAM для хворих на первинну хронічну подагру в поєднанні з МС відповідають результатам дослідження, проведеного E. Krishnan і співавт. [34].
Висновки
1. У 63,4 % хворих на первинну хронічну подагру діагностовано метаболічний синдром.
2. Хворі на первинну хронічну подагру з метаболічним синдромом мають більш високий сумарний серцево-судинний ризик за шкалами SCORE і PROCAM порівняно з хворими на метаболічний синдром.
3. Оцінка критеріїв метаболічного синдрому поряд з оцінкою серцево-судинного ризику може використовуватися в рутинній клінічній практиці для стратифікації хворих на первинну хронічну подагру, які потребують модифікації способу життя і/або диференційованих підходів до медикаментозного лікування.
Конфлікт інтересів: Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Внесок авторів у підготовку статті: Черняєва А.О. — збір та обробка матеріалів статті, її написання та редагування; Караченцев Ю.І., Кравчун Н.О., Микитюк М.Р. — концепція та дизайн дослідження, написання тексту.
- Sidiropoulos PI, Karvounaris SA, Boumpas DT. Metabolic syndrome in rheumatic diseases: epidemiology, pathophysiology and clinical implications. Arthritis Res Ther. 2008;10(3):207. doi: 10.1186/ar2397.
- Majdan M, Borys O. Gout and comorbidities associated with hyperuricemia. Ann Acad Med Stetin. 2010;56 Suppl 1:34-39. (in Polish).
- Cherniaieva AA, Karachentsev YI, Kravchun NA, Tykhonova TM. Clinical and pathogenetic aspects of the purine metabolism state in diabetes mellitus (review of literature and own obser vations). Problemi endokrinnoi patologii. 2018;(4):75-84. (in Ukrainian).
- Murray K, Burkard T. Hyperuricemia, gout and cardiovascular diseases. Ther Umsch. 2016;73(3):141-6. doi: 10.1024/0040-5930/a000770. (in German).
- Yu KH, Chen DY, Chen JH, et al. Management of gout and hyperuricemia: Multidisciplinary consensus in Taiwan. Int J Rheum Dis. 2018 Apr;21(4):772-787. doi: 10.1111/1756-185X.13266.
- Polskaya II, Marusenko IM, Kulagina TI, Vezikova NN. Occurrence of the metabolic syndrome and its effect on cardiovascular risk in patients with gout. Rational Pharmacotherapy in Cardiology. 2017;13(4):476-481. doi: 10.20996/1819-6446- 2017-13-4-476-481. (in Russian).
- Alberti KG, Zimmet P, Shaw J; IDF Epidemiology Task Force Consensus Group.The metabolic syndrome: a new worldwide definition. Lancet. 2005 Sep 24-30;366(9491):1059-62. doi: 10.1016/S0140-6736(05) 67402-8.
- Chmyr NV. Role of thyroid gland in metabolic syndrome and in combination with chronic coronary heart disease and type 2 diabetes mellitus. Mìžnarodnij endokrinologìčnij žurnal. 2018;14(8):740-743. doi: 10.22141/2224-0721.14.8.2018.154853. (in Ukrainian).
- Barskova VG, Eliseev MS, Nasonov EL, Yakunina IA, Zilov AV, Ilyinykh EV. Immunoresistance syndrome in gout patients and its influence on formation of clinical features of the disease. Terapevticheskiy arkhiv. 2004;76(5):51-56. (in Russian).
- Després JP, Lemieux I. Abdominal obesity and metabolic syndrome. Nature. 2006 Dec 14;444(7121):881-7. doi: 10.1038/nature05488.
- Yoo TW, Sung KC, Shin HS, et al. Relationship between serum uric acid concentration and insulin resistance and metabolic syndrome. Circ J. 2005 Aug;69(8):928-33.
- Edwards NL. The role of hyperuricemia and gout in kidney and cardiovascular disease. Cleve Clin J Med. 2008 Jul;75 Suppl 5:S13-6.
- Ouppatham S, Bancha S, Choovichian P. The relationship of hyperuricemia and blood pressure in the Thai army population. J Postgrad Med. 2008 Oct-Dec;54(4):259-62.
- Pillinger MH1, Goldfarb DS, Keenan RT. Gout and its comorbidities. Bull NYU Hosp Jt Dis. 2010;68(3):199-203.
- Redon J, Cífková R, Narkiewicz K. Hypertension in the metabolic syndrome: summary of the new position statement of the European Society of Hypertension. Pol Arch Med Wewn. 2009 Apr;119(4):255-60.
- Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Engl J Med. 2008 Oct 23;359(17):1811-21. doi: 10.1056/NEJMra0800885.
- Schretlen DJ, Inscore AB, Vannorsdall TD, et al. Serum uric acid and brain ischemia in normal elderly adults. Neurology. 2007 Oct 2;69(14):1418-23. doi: 10.1212/01.wnl.0000277468.10236.f1.
- Lu N, Dubreuil M, Zhang Y, et al. Gout and the risk of Alzheimer’s disease: a population-based, BMI-matched cohort study. Ann Rheum Dis. 2016 Mar;75(3):547-51. doi: 10.1136/annrheumdis-2014-206917.
- Wallace SL, Robinson H, Masi AT, Decker JL, McCarty DJ, Yü TF. Preliminary criteria for the classification of the acute arthritis of gout. Arthritis Rheum. 1977 Apr;20(3):895-900. doi: 10.1002/art.1780200320.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA. 2001 May 16;285(19):2486-97. doi: 10.1001/jama.285.19.2486.
- World Health Organization (WHO). Obesity: preventing and managing the global epidemic: WHO Technical Report Series 894. Geneva: WHO-pres; 2000. 23 р.
- Klimov AN, Nikul’cheva IuG. Obmen lipidov i lipoproteidov i ikh narusheniia [The exchange of lipids and lipoproteins and their violations]. SPb; 1999. 505 p. (in Russian).
- Chobanian AV, Bakris GL, Black HR, et al. The seventh report of the joint national commit tо on prevention, detection, evaluation, and treatment of high blood pressure: the JNC 7 report. et al. The seventh report of the joint national commit tо on prevention, detection, evaluation, and treatment of high blood pressure: the JNC 7 report. JAMA. 2003 May 21;289(19):2560-72. doi: 10.1001/jama.289.19.2560.
- Medsoftpro. SCORE calculator. Available from: https://medsoftpro.ru/kalkulyatory/kalkulyator-score.html.
- Assmann G, Cullen P, Schulte H. Simple scoring scheme for calculating the risk of acute coronary events based on the 10-year follow-up of the prospective cardiovascular Munster (PROCAM) study. Circulation. 2002 Jan 22;105(3):310-5.doi: 10.1161/hc0302.102575.
- Bardin T, Richette P. Impact of comorbidities on gout and hyperuricaemia: an update on prevalence and treatment options. BMC Med. 2017 Jul 3;15(1):123. doi: 10.1186/s12916-017-0890-9.
- Roddy E, Choi HK. Epidemiology of gout. Rheum Dis Clin North Am. 2014 May;40(2):155-75. doi: 10.1016/j.rdc.2014.01.001.
- Zhu Y, Pandya BJ, Choi HK. Prevalence of gout and hyperuricemia in the US general population: the National Health and Nutrition Examination Survey 2007-2008. Arthritis Rheum. 2011 Oct;63(10):3136-41. doi: 10.1002/art.30520.
- Yoo HG, Lee SI, Chae HJ, Park SJ, Lee YC, Yoo WH. Prevalence of insulin resistance and metabolic syndrome in patients with gouty arthritis. Rheumatol Int. 2011 Apr;31(4):485-91. doi: 10.1007/s00296-009-1304-x.
- Jung JH, Song GG, Ji JD, et al. Metabolic syndrome: prevalence and risk factors in Korean gout patients. Korean J Intern Med. 2018 Jul;33(4):815-822. doi: 10.3904/kjim.2016.062.
- Vázquez-Mellado J, García CG, Vázquez SG, et al. Metabolic syndrome and ischemic heart disease in gout. J Clin Rheumatol. 2004 Jun;10(3):105-9. doi: 10.1097/01.rhu.0000129082.42094.fc.
- Rho YH, Choi SJ, Lee YH, et al. The prevalence of metabolic syndrome in patients with gout: a multicenter study. J Korean Med Sci. 2005 Dec;20(6):1029-33. doi: 10.3346/jkms.2005.20.6.1029.
- Janssens HJ, van de Lisdonk EH, Bor H, van den Hoogen HJ, Janssen M. Gout, just a nasty event or a cardiovascular signal? A study from primary care. Fam Pract. 2003 Aug;20(4):413-6. doi: 10.1093/fampra/cmg413.
- Krishnan E, Svendsen K, Neaton JD, Grandits G, Kuller LH; MRFIT Research Group. Long-term cardiovascular mortality among middle-aged men with gout. Arch Intern Med. 2008 May 26;168(10):1104-10. doi: 10.1001/archinte.168.10.1104.

/300-1.jpg)