Газета «Новости медицины и фармации» №9 (696), 2019
Вернуться к номеру
Антибактериальные и антисептические свойства вагинального душа Дреагин Бакт™ в эксперименте (in vitro)
Авторы: Царева О.Н.(1), Романова М.В.(1), Ткачук Н.С.(1), Цибульская В.С.(1), Орлов Д.Ю.(1), Лаба О.В.(2), Куновский В.В.(2)
(1) — Александровская клиническая больница, г. Киев, Украина
(2) — Львовский национальный медицинский университет имени Данила Галицкого, г. Львов, Украина
Разделы: Клинические исследования
Версия для печати
В последние годы наметилась отчетливая тенденция к росту частоты хронической урогенитальной инфекции за счет рецидивирующих форм заболеваний [1–5]. Антимикробная резистентность (АМР) — не новое явление. Однако в настоящее время эта проблема приобрела критическое значение для здравоохранения [5–7]. Ежегодно по всему миру сообщается о новых случаях устойчивости бактерий [3, 4]. Это коснулось в том числе и акушерства и гинекологии [7, 8]. Появление АМР приводит к тому, что применение препаратов первого ряда становится проблематичным в рамках официальных программ лечения, даже если резистентность наблюдается лишь у небольшого числа патогенных бактерий.
Инфекции органов малого таза у женщин имеют полимикробную этиологию, и в течение последних 30–40 лет спектр возбудителей остается достаточно стабильным, включая, с незначительными расовыми и географическими вариациями, определенный спектр возбудителей инфекций, передаваемых половым путем (N.gonorrhoeae и C.trachomatis), аэробную и анаэробную эндогенную флору влагалища (например, Prevotella spp., Porphyromonas spp., Bacteroides fragilis, P.aeruginosa, Peptostreptococci spp., Gardnerella vaginalis, Escherichia coli, Haemophilus influenzae, S.aureus, C.albicans и аэробные стрептококки) [8–12].
Присутствие во влагалищном микробиоценозе условно-патогенных микроорганизмов, увеличение количества анаэробных бактерий повышает риск восходящего инфицирования эндометрия. К сожалению, большая часть инфекций органов малого таза (около 60 %) протекает бессимптомно или субклинически, что не мотивирует пациенток обращаться за медицинской помощью, затрудняет выявление заболеваний медицинскими специалистами и имеет тенденцию к хронизации процесса. Решение вопроса возможно путем проведения рутинного микробиологического исследования материала из верхних отделов женского репродуктивного тракта при подозрении на воспалительные заболевания гениталий. Несмотря на то что данное исследование требует значительных затрат средств и времени, оно является целесообразным и рациональным [7–9].
Среди различных лекарственных средств, используемых в комплексном лечении воспалительных заболеваний гениталий, ведущие позиции однозначно принадлежат антибиотикам [2, 4, 5, 7]. Однако длительное использование антибактериальных препаратов, особенно в отношении проблемных резистентных госпитальных штаммов микроорганизмов, сопровождается значительным развитием побочных эффектов и осложнений. Следует отметить, что в отличие от антибактериальных препаратов к противомикробным средствам с местным, топическим действием (местные антисептики) резистентность бактерий или не развивается совсем, или имеет частичную кратковременную адаптацию [4, 7, 12, 13].
Таким образом, локальные противомикробные средства имеют хорошие перспективы эффективного и длительного применения в клинической практике, особенно в условиях современной эскалации антибиотикорезистентности. Антисептические средства для местного применения имеют очевидный потенциал увеличения эффективности борьбы с патогенной и условно-патогенной гинекологической инфекцией и занимают все более доминирующее место в комплексной медикаментозной терапии воспалительных заболеваний гениталий.
Цель: изучить антисептические свойства препарата Дреагин™ Бакт (вагинальный душ) в отношении типичных современных возбудителей гинекологической инфекции в эксперименте (in vitro).
Материалы и методы
Свойства раствора Дреагин™ Бакт изучали in vitro путем оценки угнетения бактериального роста на плотных питательных средах типичных патогенных штаммов микроорганизмов, используя нативный раствор Дреагин™ Бакт и в разведениях 0,9% раствором NaCl до концентраций 1 : 2, 1 : 4, 1 : 8, 1 : 16. В качестве тест-культур использовали музейные (АТСС) штаммы S.aureus, E.coli, P.aeruginosa, C.albicans со следующими характеристиками.
Золотистый стафилококк (Staphylococcus aureus). Грамположительные кокки в виде кремовых колоний с зоной полного гемолиза на кровяном агаре; каталаза (+), плазмокоагулаза (+), лецитиназа (+), пигмент (+), окисление и ферментация маннита (+/+). Согласно рекомендациям Европейского комитета по определению чувствительности к антимикробным препаратам EUCAST, перечень антибактериальных препаратов для выявления резистентности штаммов S.aureus следующий: цефокситин или оксациллин (как скрининг-тест для цефалоспоринов и карбапенемов), амоксициллин/клавуланат, фторхинолоны, аминогликозиды, эритромицин (как скрининг-тест для макролидов), гликопептиды (ванкомицин, тейкопланин), тетрациклины, линезолид.
Кишечная палочка (Escherichia coli). Грамотрицательная палочка, оксидаза (–), подвижность (+), глюкоза (кг), лактоза (+), цитрат Симмонса (–), уреаза (–), малонат (–), H2S (–), индол (+), фенилаланин (–), лизиндекарбоксилаза (+), ацетат Na (+), орнитиндекарбоксилаза (+/–), аргининдегидролаза (–), b-галактозидаза (+). Перечень антибактериальных препаратов для исследования резистентности представлен в EUCAST по группам – пенициллины, цефалоспорины, карбапенемы, монобактамы, фторхинолоны, аминогликозиды и др.
Клебсиелла (Klebsiella pneumoniae) ассоциирована с инфекциями мочеполовой системы: грамотрицательные неспороносные палочки, оксидаза (–), капсула (+), подвижность (–), глюкоза (кг), лактоза (к), индол (–), H2S (–), уреаза (+), цитрат Симмонса (+), малонат (+), лизиндекарбоксилаза (+), орнитиндекарбоксилаза (–), аргининдекарбоксилаза (–), фенилаланин (–). Перечень антибактериальных препаратов, применяемых при изучении чувствительности K.pneumoniae, представлен в EUCAST по группам с учетом природной резистентности данного микроорганизма.
Синегнойная палочка (Pseudomonas aeruginosa). Грамотрицательная палочка, неспорообразующая, строгий аэроб, имеет фруктовый запах, растет на простых средах, на среде Клиглера — характерный металлический блеск, продуцирует пигмент различных оттенков зеленого цвета, подвижна, окисляет, но не ферментирует глюкозу (OF +/–), гемолиз (+), оксидаза (+), растет при 42 °С, желатиназа (+), мальтоза (–), не способна утилизировать углеводы путем брожения. Псевдомонада обладает природной резистентностью ко многим антимикробным препаратам: ампициллину, амоксициллину/клавуланату, ампициллину/сульбактаму, цефалоспоринам I поколения, цефотаксиму, цефтриаксону, эртапенему, тигециклину, тетрациклину, хлорамфениколу. Из цефалоспоринов определяют резистентность только к цефепиму и цефтазидиму. Из фторхинолонов – к ципрофлоксацину и левофлоксацину. А также ко всем аминогликозидам (амикацин, гентамицин, нетилмицин, тобрамицин).
Кандида альбиканс (Candida albicans) — форма дрожжеподобных грибов, имеющих округлые, овоидные или удлиненные клетки, размножающиеся многополюсным почкованием. Образует псевдомицелий и концевые хламидоспоры. Является наиболее частым возбудителем кандидозов. Возбудитель оппортунистических инфекций человека, которые передаются контактным и половым путем. Аэроб, 21–27 °С. Культивируются на среде Сабуро в течение 5 суток. Формирует круглые, блестящие, плоские или выпуклые, с ровными краями колонии. На жидкой среде — помутнение. Определяют чувствительность C.albicans к миконазолу, натамицину, флуконазолу, амоксициллину/клотримазолу, вориконазолу, итраконазолу, нистатину, амфотерицину-b, изоконазолу, циклопироксу, фентиконазолу, бутоконазолу, микафунгину.
Выбор тест-культур обусловлен высокой частотой колонизации последних при воспалительных заболеваниях половых органов у женщин [8–11, 13].
Для выделения вышеуказанных микроорганизмов используют кровяной агар, агар Сабуро и агар Эндо. С целью количественного определения микроорганизмов посев осуществляют по Голду, с последующим выделением и идентификацией этиологически значимых культур.
Подготовка культур
Для эксперимента использовались вышеперечисленные АТСС штаммы культур, выращенные на мясо-пептонном агаре, а культивирование грибов рода Candida осуществлялось агаре Сабуро.
Эксперимент предусматривал два этапа. На первом этапе эксперимента готовилась взвесь из суточных культур в физиологическом растворе, которая соответствовала стандарту мутности 0,5 МакФарланда (108 КОЕ/мл).
Далее приготовленную взвесь засевали на соответствующие чашки Петри с плотными питательными средами методом газона с помощью тампона. Чашки подсушивались, и затем в центр чашек наносилось 0,05 мл (1 капля) Дреагина™ Бакт. После культивирования 24–48 часов в термостате оценивали результаты: зона задержки роста — отсутствие колоний в месте нанесения Дреагина™ — свидетельствовала о проявлении антибактериальных свойств вагинального душа. Незначительный бактериальный рост (единичные колонии) расценивался как слабые антибактериальные свойства. Полноценный бактериальный рост (множественные колонии) — как отсутствие антибактериальных свойств. В качестве контроля использовали аналогичные суточные тест-культуры микроорганизмов (без внесения исследуемого раствора).
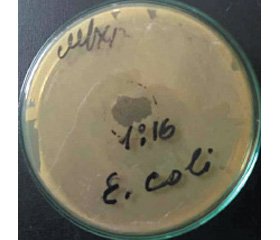
Второй этап эксперимента предвидел использование раствора Дреагин™ Бакт в разведениях 1 : 2, 1 : 4, 1 : 8, 1 : 16 для изучения его антибактериальных свойств на культуру E.coli.
Полученные результаты обработаны методами параметрической и непараметрической статистики (Excel 2010, Statistica 10). Анализ данных проводили с применением критериев Стьюдента и c2. Статистически достоверным считали значение p < 0,05.
Результаты и обсуждение
Первый этап исследований
После нанесения раствора Дреагин™ Бакт на культуры патогенов S.aureus, E.coli, P.aeruginosa, C.albicans и последующего культивирования в течение 24 часов на исследуемых средах наблюдалось полное отсутствие бактериального роста культуры P.aeruginosa и S.aureus (рис. 1).
Аналогичные результаты получены с культурой грибов Candida albicans (рис. 2).
После получения положительных результатов на первом этапе исследований (полное угнетение бактериального роста, т.е. отсутствие колоний в зоне нанесения раствора Дреагин™ Бакт) был проведен второй этап.
Второй этап исследований
Второй этап исследований предусматривал изучение активности раствора Дреагин™ Бакт по отношению к культуре E.coli в разведениях 1 : 2, 1 : 4, 1 : 8, 1 : 16. Для этого раствор готовился ex tempore путем разведения 0,9% физиологическим раствором NaCl. Объем нанесенного раствора был стандартным во всех исследованиях и соответствовал 1 капле (0,05 мл). Полученные результаты представлены на рис. 3, 4.
По итогам проведенного второго этапа было констатировано, что Дреагин™ Бакт даже в разбавленном виде проявляет выраженные антибактериальные свойства, но степень их выраженности зависит от концентрации. Достоверные (экспериментально подтвержденные) антибактериальные свойства по отношению к культивированной культуре E.coli вагинальный душ продемонстрировал в концентрации 1 : 1, 1 : 2 и 1 : 4, причем, несмотря на значительное разведение, даже до концентрации 1 : 8 и 1 : 16, остаточные антибактериальные свойства сохранялись (рис. 5), хотя и были выражены менее ярко.
Таким образом, Дреагин™ Бакт в виде растворов с концентрациями 100, 50 и 25 % при локальном, местном использовании обладает выраженными антибактериальными/антисептическими свойствами в отношении золотистого стафилококка, кишечной палочки, синегнойной палочки и грибов рода кандида, что позволяет его позиционировать как эффективное антибактериальное средство, рефрактерное к антибиотикорезистентности бактерий и обеспечивающее подавление роста большинства тестируемых патогенов.
Результаты первого и второго этапов эксперимента, которые, по сути, были демонстрацией качественной оценки антибактериальной активности вагинального душа Дреагин™ Бакт, позволили оценить его соответствие необходимым требованиям к гинекологическим противомикробным средствам с местным, топическим действием.
Многовекторность антибактериальной активности Дреагина™ Бакт обусловлена сочетанием растительных и синтетических компонентов, таких как масло чайного дерева (0,1 г); касторовое масло (0,5 г); лецитин (0,1 г); хлоргексидина диглюконат (0,29 %); бета-глициретиновая кислота (0,01 г), полученная из корня лакрицы; молочная кислота (рН 4,5); имидазолидинилмочевина (0,3 г); кетоглутаровая кислота (0,01 г), что обеспечивает бактерицидное, фунгицидное и вирулицидное действие. При этом ликвидируются такие симптомы, как зуд, жжение, раздражение слизистой, сухость влагалища или обильные выделения, неприятный запах. Благодаря молочной кислоте и касторовому маслу восстанавливается кислотно-щелочной баланс, регулируется рН, растет количество лактобактерий и нормализуется биоценоз влагалища, увлажняется слизистая оболочка, происходит отшелушивание мертвого эпителия и обновление клеток, регулируется обмен веществ.
Важно, что антибактериальная активность раствора сохраняется при разведении, т.е. в присутствии крови, гноя, слизи и других органических веществ.
Для обеспечения клинической эффективности и предотвращения развития рецидивов необходимо индивидуально подбирать дозу в зависимости от степени тяжести инфекционного процесса. Короткий курс терапии и хорошая переносимость душа позволяют назначать его так часто, как возникает необходимость. Удобство применения (флаконы по 140 мл с канюлями для одноразового вагинального применения) и доступность делают Дреагин™ Бакт препаратом выбора для проведения интимной гигиены, что позволяет рекомендовать его для широкого использования в лечении и для профилактики инфекций, передающихся половым путем.
Полученные in vitro данные позволили продолжить наши наблюдения in vivo, что будет изложено в следующей статье.
Выводы
1. Проведенные іn vitro исследования позволяют констатировать выраженные антибактериальные и антисептические свойства вагинального душа Дреагин™ Бакт в отношении типичных современных возбудителей гинекологической инфекции.
2. Дреагин™ Бакт обеспечивает подтвержденное іn vitro достоверное снижение микробного числа патогенных микроорганизмов.
3. Дреагин™ Бакт оказывает выраженное антисептическое действие даже при наличии обильных вагинальных выделений и гарантирует достижение желаемого клинического эффекта в комплексном лечении женщин с воспалительными заболеваниями гениталий.
1. Маковецкая М. Рациональная терапия урогенитальных микст-инфекций: в фокусе комбинация ципрофлоксацин/орнидазол. Здоров’я України ХХІ сторіччя. 2013. № 19. С. 57.
2. Антибиотики и противоинфекционный иммунитет / Под ред. Н.Д. Ющука, И.П. Балмасовой, В.Н. Царева. М.: Практическая медицина, 2012. С. 208-221.
3. Практическое руководство по антиинфекционной химиотерапии. Под ред. Страчунского Л.С., Белоусова Ю.Б., Козлова С.Н. М.: Боргес, 2002. 384 с.
4. Летяева О.И. Оптимизация подходов к терапии урогенитальных микст-инфекций у женщин репродуктивного возраста: Тезисы XXXII научно-практической конференции «Рахмановские чтения». Дерматология в России. 2015. Т. 4, вып. S1. С. 35.
5. Тихомиров А.Л. Современный алгоритм терапии воспалительных заболеваний половой сферы. Медицинская панорама. 2003. № 9. С. 40-44.
6. Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання. Наказ МОЗ України № 312 від 08.05.2009 р. [Электронный ресурс]: Режим доступа – www.document.ua
7. Европейские стандарты диагностики и лечения заболеваний, передаваемых половым путем. К.: Мед. література, 2003. 264 с.
8. Вдовиченко Ю.П. Бактериальный вагиноз: современные подходы к лечению и профилактике рецидивов. 2009. [Электронный ресурс]: Режим доступа –
www. organosyn. com. ua.
9. Майоров М.В., Жученко С.И., Жуперкова Е.А., Черняк О.Л. Профилактика послеабортных инфекционно-воспалительных осложнений. Медицинские аспекты здоровья женщины. 2015. № 4 (90). С. 37-42.
10. Kenyon C., Colebunders R., Crucitti T. The global epidemiology of bacterial vaginosis: a systematic review. Am. J. Obstet. Gynecol. 2013. 209 (6). 505-23.
11. Шалепо К.В., Назарова В.В., Менухова Ю.Н., Румянцева Т.А., Гущин А.Е., Савичева А.М. Оценка современных методов лабораторной диагностики бактериального вагиноза. Журнал акушерства и женских болезней. 2014. 63 (1). 26-32.
12. Бондаренко K.P., Хасанова Г.Ф., Аглямова Д.Р., Хасанова С.Г., Мавзютов А.Р. Микроэкология влагалища при дисбиозе. Мать и дитя: Мат-лы IX Всероссийского научного форума. М., 2007. С. 336-337.
13. Kusters J.G., Reuland E.A., Bouter S., Koenig P., Dorigo-Zetsma J.W. A multiplex real-time PCR assay for routine diagnosis of bacterial vaginosis. Eur. J. Clin. Microbiol. Infect. Dis. 2015. 34 (9). 1779-85.

/u/9-1.jpg)
/u/9-2.jpg)
/u/9-3.jpg)