Журнал «Медицина неотложных состояний» №6(101), 2019
Вернуться к номеру
Обґрунтування та клінічна ефективність корекції гомеостазу цинку в інтенсивній терапії гострої церебральної недостатності
Авторы: Терів П.С.(1, 2), Шкурупій Д.А.(1, 2)
(1) — Українська медична стоматологічна академія, м. Полтава, Україна
(2) — Відокремлений підрозділ Асоціації анестезіологів України в Полтавській області, м. Полтава, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
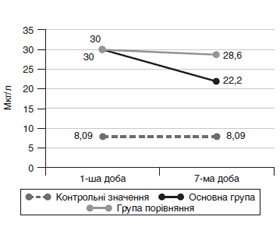
Актуальність. У хворих у критичному стані з гострою церебральною недостатністю наявні метаболічні особливості, у тому числі і порушення гомеостазу цинку. Мета дослідження — обґрунтування й оцінка клінічної ефективності корекції гомеостазу цинку в інтенсивній терапії пацієнтів із гострою церебральною недостатністю. Матеріали та методи. Проведене клінічне когортне рандомізоване дослідження за участю 94 дорослих пацієнтів із гострою церебральною недостатністю і гіпоцинкемією в умовах інтенсивної терапії. До основної групи (n = 47) увійшли пацієнти, яким додатково призначали сульфат цинку моногідрат та ацетилцистеїн терміном до 7 діб, до групи порівняння (n = 47) — пацієнти з традиційною лікувальною тактикою. Оцінювали вміст цинку, нейронспецифічної єнолази, активність супероксиддисмутази в крові, іх зв’язок із показниками летальності і тривалості госпіталізації. Результати. На початку спостереження констатовані зниження активності супероксиддисмутази до 0,02 (0,01; 0,03) Од/мл і підвищення нейронспецифічної єнолази до 30 (18,3; 44,9) мкг/л. Наприкінці спостереження в основній групі на відміну від групи порівняння констатовані значимі підвищення цинку до 12,4 (11,2; 15) мкмоль/л, активності супероксиддисмутази до 0,04 (0,03; 0,05) Од/мл, зменшення нейронспецифічної єнолази до 22,2 (16,5; 30,7) мкг/л. Серед пацієнтів, які вижили, був наявний зв’язок тривалості лікування, зокрема і в інтенсивній терапії, з оптимізованою тактикою лікування (R = –0,39; р = 0,008 та R = –0,34; р = 0,022 відповідно). Установлені зв’язки між зменшенням летальності, вмістом цинку (R = –0,29; р = 0,021), активністю супероксиддисмутази (R = –0,326; р = 0,013), вмістом нейронспецифічної єнолази крові (R = 0,74; р < 0,001); між зменшенням тривалості госпіталізації і рівнем цинку крові (R = –0,32; р = 0,011); між зменшенням перебування в умовах інтенсивної терапії і зниженням вмісту нейронспецифічної єнолази крові (R = –0,37; р = 0,004). Висновки. У пацієнтів із гострою церебральною недостатністю в умовах інтенсивної терапії гіпоцинкемія асоціюється з низькою активністю супероксиддисмутази і високим вмістом нейронспецифічної єнолази. Оптимізована лікувальна тактика відновлює рівень цинку, збільшує активність супероксиддисмутази, зменшує вміст нейронспецифічної єнолази, позитивно відбивається на показниках летальності і тривалості госпіталізації.
Актуальность. У больных в критическом состоянии с острой церебральной недостаточностью имеются метаболические особенности, в том числе и нарушения гомеостаза цинка. Цель исследования — обоснование и оценка клинической эффективности коррекции гомеостаза цинка в интенсивной терапии пациентов с острой церебральной недостаточностью. Материалы и методы. Проведено клиническое когортное рандомизированное исследование с участием 94 взрослых пациентов с острой церебральной недостаточностью и гипоцинкемией в условиях интенсивной терапии. В основную группу (n = 47) вошли пациенты, которым дополнительно назначали сульфат цинка моногидрат и ацетилцистеин сроком до 7 суток, в группу сравнения (n = 47) — пациенты с традиционной лечебной тактикой. Оценивали содержание цинка, нейронспецифической енолазы, активность супероксиддисмутазы в крови, их связь с показателями летальности и продолжительности госпитализации. Результаты. В начале наблюдения констатированы снижение активности супероксиддисмутазы до 0,02 (0,01; 0,03) Ед/мл и повышение нейронспецифической енолазы до 30 (18,3; 44,9) мкг/л. В конце наблюдения в основной группе в отличие от группы сравнения констатированы значимые повышения цинка до 12,4 (11,2; 15) мкмоль/л, активности супероксиддисмутазы до 0,04 (0,03; 0,05) Ед/мл, уменьшение нейронспецифической енолазы до 22,2 (16,5; 30,7) мкг/л. У выживших пациентов была связь продолжительности лечения, в том числе и в интенсивной терапии, с оптимизированной тактикой лечения (R = –0,39; р = 0,008 и R = –0,34; р = 0,022 соответственно). Установлены связи между уменьшением летальности, содержанием цинка (R = –0,29; р = 0,021), активностью супероксиддисмутазы (R = –0,326; р = 0,013), содержанием нейронспецифической енолазы крови (R = 0,74; р < 0,001), между уменьшением продолжительности госпитализации и уровнем цинка крови (R = –0,32; р = 0,011), между уменьшением пребывания в условиях интенсивной терапии и снижением содержания нейронспецифической енолазы крови (R = –0,37; р = 0,004). Выводы. У пациентов с острой церебральной недостаточностью в условиях интенсивной терапии гипоцинкемия ассоциируется с низкой активностью супероксиддисмутазы и высоким содержанием нейронспецифической енолазы. Оптимизированная лечебная тактика восстанавливает уровень цинка, увеличивает активность супероксиддисмутазы, уменьшает содержание нейронспецифической енолазы, положительно отражается на показателях летальности и продолжительности госпитализации.
Background. Critically ill patients with acute cerebral insufficiency present with metabolic features, including violations of zinc homeostasis. The purpose of the work is to substantiate and evaluate the clinical efficacy of the correction of zinc homeostasis in the intensive care of patients with acute cerebral insufficiency. Materials and methods. A clinical cohort randomized study involved 94 adult patients with acute cerebral insufficiency and hypozincaemia in intensive care. The main group (n = 47) included the patients who had additionally prescribed zinc sulfate monohydrate and acetylcysteine for up to 7 days; the comparison group (n = 47) included the patients undergone the traditional treatment management. The content of zinc, neuron-specific enolase, the activity of superoxide dismutase in the blood, depending on the treatment tactics, their relationship with mortality rates and duration of hospitalization were assessed. Results. At the beginning of the observation, a decrease in the activity of superoxide dismutase to 0.02 (0.01; 0.03) U/ml and an increase in the neuron-specific enolase to 30 (18.3; 44.9) μg/l were found. At the end of the observation in the main group, in contrast to the comparison group, a significant increase in zinc content to 12.4 (11.2; 15) μmol/l and superoxide dismutase activity to 0.04 (0.03; 0.05) U/ml was registered; neuron-specific enolase reduced to 22.2 (16.5; 30.7) µg/L. The surviving patients showed an association of the duration of treatment, including in intensive care unit, with optimized treatment management (R = –0.39; p = 0.008 and R = –0.34; p = 0.022, respectively). The relationship between reduced mortality, zinc content (R = –0.29; p = 0.021), superoxide dismutase activity (R = –0.326; p = 0.013), and the content of neuron-specific blood enolase (R = 0.74; p < 0.001); between a decreased duration of hospitalization and a blood zinc level (R = –0.32; p = 0.011); between a decrease staying in intensive care unit and a decrease in the blood content of neuron-specific enolase (R = –0.37; p = 0.004). Conclusions. In patients with acute cerebral insufficiency in intensive care, hypozincaemia is associated with low superoxide dismutase activity and high levels of neuron-specific enolase. Optimized treatment management restores zinc levels, increases the activity of superoxide dismutase, reduces the content of neuron-specific enolase, and has a positive effect on mortality rates and duration of hospitalization.
гостра церебральна недостатність; цинк; супероксиддисмутаза; нейронспецифічна єнолаза; інтенсивна терапія
острая церебральная недостаточность; цинк; супероксиддисмутаза; нейронспецифическая енолаза; интенсивная терапия
acute cerebral insufficiency; zinc; superoxide dismutase; neuron-specific enolase; intensive care
Вступ
Матеріали та методи
Результати
/78.jpg)
Обговорення
Висновки
1. Спирин А.В. Общая патология критических, терминальных и постреанимационных состояний (лекция). Медицинский вестник Башкортостана. 2015. № 5. С. 127-131.
2. Марочков А.В., Точило С.А., Шваренок В.В., Мигунова У.С. Применение витаминов и микроэлементов в комплексном лечении критических состояний и синдрома полиорганной дисфункции: методические рекомендации. Витебск: ВГМУ, 2019. 60 с.
3. Орлов Ю.П., Афанасьев В.В. Гипоксия и гипероксия в практике анестезиолога-реаниматолога. Роль сукцинатов при критических состояниях. Новости хирургии. 2018. № 2. Т. 26. С. 226-237. doi: 10.18484/2305-0047.2018.2.226.
4. Усенко Л.В., Царев А.В. Современные возможности энергопротекции при критических состояниях. Медицина неотложных состояний. 2016. № 4. С. 72-78. doi: 10.22141/2224-0586.4.75.2016.75820.
5. Поляков И.В., Золотухин К.Н., Лейдерман И.Н. Влияние искусственной вентиляции легких на реальную энергопотребность у пациентов хирургического отделения реанимации и интенсивной терапии. Креативная хирургия и онкология. 2017. № 2. Т. 7. С. 16-21. doi: 10.24060/2076-3093-2017-7-2-16-21.
6. Алексеева Е.В. Изменение содержания глутаминовой кислоты в плазме крови у больных в критическом состоянии при гипоксии. Вестник современной клинической медицины. 2016. Т. 9. Вып. 5. С. 14-25. doi: 10.20969/VSKM.2016.9(5).14-25.
7. Матолінець Н.В. Роль та місце ω-3 жирних кислот у регуляції синдрому системної відповіді на запалення в пацієнтів, які отримують інтенсивну терапію. Медицина неотложных состояний. 2016. № 6. С. 135-139. doi: 10.22141/2224-0586.8.79.2016.90370.
8. Моргунов Л.Ю. Гипергликемия критических состояний у пациентов без диабета. Эндокринология: новости, мнения, обучение. 2018. № 2, Т. 7. С. 14-25. doi: 10.24411/2304-9529-2018-12001.
9. Ломиворотов В.В., Дерягин М.Н., Абубакиров М.Н., Фоминский Е.В., Непомнящих В.А. Дефицит тиамина и его коррекция при критических состояниях. Вестник анестезиологии и реаниматологии. 2017. № 5. Т. 14. С. 73-81. doi: 10.21292/2078-5658-2017-14-5-73-81.
10. Никонов В.В., Курсов С.В., Яковцов И.З. и др. Проблемы недифференцированной терапии у больных с синдромом острой церебральной недостаточности (аналитический обзор). Часть 1. Медицина неотложных состояний. 2016. 1(72). С. 30-38.
11. Потапов А.А., Крылов В.В., Гаврилов Г.А. и др. Рекомендации по диагностике и лечению тяжелой черепно-мозговой травмы. Часть 2. Интенсивная терапия и нейромониторинг. Вопросы нейрохирургии» имени Н.Н. Бурденко. 2016. № 1. С. 98-106. doi:10.17116/neiro201680198-106.
12. Ярошецкий А.И., Конаныхин В.Д., Степанова С.О., Резепов Н.А. Гипофосфатемия и рефидинг-синдром при возобновлении питания у пациентов в критических состояниях (обзор литературы). Вестник интенсивной терапии имени А.И. Салтанова. 2019. № 2. С. 82-91. doi: 10.21320/1818-474X-2019-2-82-91.
13. Свиридов С.В., Веденина И.В., Кочергин В.Г. Вероятность развития гипомагниемии у хирургических больных. Российский медицинский журнал. 2017. № 23(3). С. 158-164. doі http:. dx.doi.org/10.18821/0869-2106-2017-23-3-158-164.
14. Cirino Ruocco M.A., Pacheco Cechinatti E.D., Barbosa F. Jr, Navarro A.M. Nutrition Zinc and selenium status in critically ill patients according to severity stratification. 2018. № 45. Р. 85-89. doi: 10.1016/j.nut.2017.07.009.
15. Терів П.С., Шкурупій Д.А. Цинк-залежні впливи при інтенсивній терапії у хворих з неврологічною патологією. Вісник проблем біології і медицини. 2014. Вип. 2, Т. 3(109). С. 48-52.
16. Алиева Т.У., Федоров С.В., Свиридов С.В. Концентрация цинка и меди в плазме крови у больных с гнойными ранами мягких тканей. Анестезиология и реаниматология. 2010. № 3. С. 8-12.
17. Полунина О.С., Филиппова М.О., Севостьянова И.В., Воронина Л.П. Активность супероксиддисмутазы при фибрилляции предсердий. Современные проблемы науки и образования. 2016. № 6. URL: http: www.science-education.ru/ru/article/view?id=25640.
18. Рахимбаева Г.С. Нейрон-специфическая энолаза в сыворотке крови как диагностический маркер эпилепсии. Міжнародний неврологічний журнал. 2011. № 2. С. 123-128.
19. Paz Matias J., Costa e Silva D.M., Clímaco Cruz K.J. et al. Effect of zinc supplementation on superoxide dismutase activity in patients with ulcerative rectocolitis. Nutr. Hosp. 2014. 17. 31(3). P. 1434-7. doi: 10.3305/nh.2015.31.3.8402.
20. Ruslin M., Wolff J., Yusuf H.Y., Arifin M. Z., Boffano P., Forouzanfar T. Use of neuron-specific enolase to predict mild brain injury in motorcycle crash patients with maxillofacial fractures: A pilot study. Chin. J. Traumatol. 2019. 22(1). Р. 47-50. doi: 10.1016/j.cjtee.2018.12.004. PubMed PMID:30837107; PubMed Central PMCID: PMC652957.
21. Sun Q., Zhong W., Zhang W. et al. Zinc deficiency mediates alcohol-induced apoptotic cell death in the liver of rats through activating ER and mitochondrial cell death pathways. Am. J. Physiol. Gastrointest. Liver Physiol. 2015. 1. 308(9). Р. 757-66. doi:10.1152/ajpgi.00442.2014. PubMed PMID: 25767260; PubMed Central PMCID: PMC4421018.
22. Mokhtari V., Afsharian P., Shahhoseini M., Kalantar S.M. Review on Various Uses of N-Acetyl Cysteine. A Cell. J. 2017. 19(1). P. 11-17. PubMed PMID: 28367412; PubMed Central PMCID: PMC5241507.
23. Tardiolo G., Bramanti P., Mazzon E. Overview on the Effects of N-Acetylcysteine in Neurodegenerative diseases. Molecules. 2018. 13. 23(12). pii: E3305. doi:10.3390/molecules23123305. PubMed PMID: 30551603; PMCID: PMC6320789.
24. Strapazzon G., Malacrida S., Vezzoli A. et al. Oxidative stress response to acute hypobaric hypoxia and its association with indirect measurement ofincreased intracranial pressure: a field study. Sci. Rep. 2016. 6. 32426. doi: 10.1038/srep32426. PubMed PMID: 27579527; PubMed Central PMCID: PMC5006564.
25. Ciancarelli I., De Amicis D., Di Massimo C. et al. Peripheral biomarkers of oxidative stress and their limited potential in evaluation of clinical features of Huntington's patients. Biomarkers. 2014. 19(6). Р. 452-6. doi: 10.3109/1354750X.2014.935955/
26. Lin P.H., Sermersheim M., Li H., Lee P.H.U., Steinberg S.M., Ma J. Zinc in Wound Healing Modulation. Nutrients. 2017. 10(1). pii: E16. doi: 10.3390/nu10010016. PubMed PMID: 29295546; PubMed Central PMCID: PMC5793244.
27. Hasanzadeh Kiabi F., Alipour A., Darvishi-Khezri H., Aliasgharian A., Emami Zeydi. Zinc Supplementation in Adult Mechanically Ventilated Trauma Patients is Associated with Decreased Occurrence of Ventilator-associated Pneumonia: A Secondary Analysis of a Prospective, Observational Study. Indian J. Crit. Care Med. 2017. 21(1). Р. 34-39. doi: 10.4103/0972-5229.198324. PubMed PMID: 28197049; PubMed Central PMCID: PMC5278588.
28. Lee Y.H., Bang E.S., Lee J.H. et al. Serum Concentrations of Trace Elements Zinc, Copper, Selenium, and Manganese in Critically Ill Patients. Biol. Trace Elem. Res. 2019. 188(2). P. 316-325. doi:10.1007/s12011-018-1429-4. PubMed PMID: 30047077; PubMed Central PMCID: PMC6424942.

/78_2.jpg)