Журнал «Медицина неотложных состояний» №6(101), 2019
Вернуться к номеру
Аналіз впливу нутритивної підтримки у хворих з тяжким панкреатитом на тлі використання комбінації раннього ентерального й парентерального харчування
Авторы: Сорокіна О.Ю., Бєлих Л.С.
ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
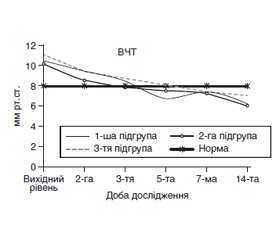
До групи дослідження ввійшли пацієнти (n = 45) з тяжким гострим панкреатитом (ГП), в яких з 2-ї доби в комплексі інтенсивної терапії (ІТ) починали проведення раннього ентерального харчування (ЕХ) через назогастроєюнальний зонд зі швидкістю 20 мл/год з поступовим збільшенням об’єму введення на фоні відновлення функції шлунково-кишкового тракту та комбінацією з парентеральним харчуванням (ПХ). Залежно від виду суміші для ПХ, що застосовували як нутритивну підтримку, хворі були розподілені на підгрупи. Підгрупа 1 (n = 11) — хворі, яким проводилось комбіноване раннє ЕХ і ПХ з використанням спеціальних трикамерних мішків з сумішами амінокислот, ліпідів і вуглеводів. Підгрупа 2 (n = 14) — пацієнтам проводилось комбіноване раннє ЕХ і ПХ з використанням трикамерних мішків з підвищеним вмістом ɷ-3 жирних кислот (ЖК). Підгрупа 3 (контрольна) — хворі (n = 20), яким проводилось комбіноване раннє ЕХ і ПХ з використанням окремих модулів з вуглеводів, амінокислот і ліпідів. Проведення комбінації ЕХ і ПХ сумішами в трикамерних мішках у хворих 1-ї і 2-ї підгруп сприяло більш швидкому відновленню загального білка й альбуміну крові (на 14-ту і 7-му добу відповідно). Додавання ɷ-3 ЖК в складі ПХ трикамерними мішками забезпечувало білковозберігаючий ефект у пацієнтів 2-ї підгрупи. На тлі проведення нутритивної підтримки комбінацією ЕХ та ПХ з використанням трикамерних мішків, збагачених ɷ-3 ЖК, реєстрували більш виражене зниження рівня С-реактивного білка на 5-ту добу ІТ (р1, 2 = 0,001 і р2, 3 = 0,001) за рахунок зниження лейкоцитозу та вірогідного збільшення рівня лімфоцитів крові у пацієнтів 2-ї підгрупи. У хворих 1-ї підгрупи, яким починали ЕХ з ПХ трикамерними мішками, реєстрували нормалізацію рівня лімфоцитів крові протягом 14–21 доби ІТ тяжкого ГП. До 5-ї доби перебігу ГП у хворих 1-ї і 2-ї підгруп комбінація ЕХ і ПХ трикамерними мішками, збалансованими за макронутрієнтами, забезпечила калораж 24,5 і 26,1 ккал/кг, що дозволило досягнути 100% цільового калоражу на 5-ту добу ІТ. На тлі використання модульного ПХ у пацієнтів 3-ї підгрупи загальний калораж становив 19,7 ккал/кг. У хворих 2-ї підгрупи на тлі використання трикамерних мішків, збагачених ɷ-3 ЖК, в комплексі ІТ вірогідно зменшився загальний ліжко-день у стаціонарі до 20,5 ± 1,8 дня порівняно з пацієнтами з тяжким ГП у 1-й і 3-й підгрупах (27,6 ± 4,5 дня і 30,5 ± 2,9 дня відповідно).
В группу исследования вошли пациенты (n = 45) с тяжелым острым панкреатитом (ОП), у которых со 2-х суток в комплексе интенсивной терапии (ИТ) начинали проведение раннего энтерального питания (ЭП) через назогастроеюнальный зонд со скоростью 20 мл/ч с постепенным увеличением объема введения смеси на фоне восстановления функции желудочно-кишечного тракта и комбинацией с парентеральным питанием (ПП). В зависимости от вида смеси для ПП, что применяли в качестве нутритивной поддержки, больные были разделены на подгруппы. Подгруппа 1 (n = 11) — больные, которым проводилось комбинированное раннее ЭП и ПП с использованием специальных трехкамерных мешков со смесями аминокислот, липидов и углеводов. Подгруппа 2 (n = 14) — пациентам проводилось комбинированное раннее ЭП и ПП с использованием трехкамерных мешков с повышенным содержанием ɷ-3 жирных кислот (ЖК). Подгруппа 3 (контрольная) — больные (n = 20), которым проводилось комбинированное раннее ЭП и ПП с использованием отдельных модулей из углеводов, аминокислот и липидов. Проведение комбинации ЭП и ПП смесями в трехкамерных мешках у больных 1-й и 2-й подгрупп способствовало более быстрому восстановлению общего белка и альбумина крови (на 14-е и 7-е сутки соответственно). Добавление ɷ-3 ЖК в составе ПП трехкамерными мешками обеспечивало белок-сберегающий эффект у пациентов 2-й подгруппы. На фоне проведения нутритивной поддержки комбинацией ЭП и ПП с использованием трехкамерных мешков, обогащенных ɷ-3 ЖК, регистрировали более выраженное снижение уровня С-реактивного белка на 5-е сутки ИТ (р1, 2 = 0,001 и р2, 3 = 0,001) за счет снижения лейкоцитоза и достоверного увеличения уровня лимфоцитов крови у пациентов 2-й подгруппы. У больных 1-й подгруппы, которым начинали ЭП с ПП трехкамерными мешками, регистрировали нормализацию уровня лимфоцитов крови в течение 14–21 суток ИТ тяжелого ОП. До 5-х суток течения ОП у больных 1-й и 2-й подгрупп комбинация ЭП и ПП трехкамерными мешками, сбалансированными по макронутриентам, обеспечила калораж 24,5 и 26,1 ккал/кг, что позволило достичь 100% целевого калоража на 5-е сутки ИТ. На фоне использования модульного ПП у пациентов 3-й подгруппы общий калораж составлял 19,7 ккал/кг. У больных 2-й подгруппы на фоне использования трехкамерных мешков, обогащенных ɷ-3 ЖК, в комплексе ИТ достоверно уменьшился общий койко-день в стационаре до 20,5 ± 1,8 дня по сравнению с пациентами с тяжелым ОП в 1-й и 3-й подгруппах (27,6 ± 4,5 дня и 30,5 ± 2,9 дня соответственно).
The article analyzes the data of patients with severe acute pancreatitis (AP) who were treated for the period 2014–2018 at the Department of Anesthesiology and Intensive Care of Dnipro Clinical Emergency Medical Services. The group study included the patients (n = 45), who were performed early enteral nutrition (EN) from the 2nd day in intensive care through nasogastrojejunal tube at a rate of 20 ml/h with a gradual increase in volume on the background of recovery of gastrointestinal functions and combination with parenteral nutrition (PN). Depending on the type of mixture for PN used as nutritional support, the group of patients was divided into subgroups. Subgroup 1 (n = 11) included the patients treated with combined early EN and PN using the special three-chamber bags with mixtures of amino acids, lipids and carbohydrates. Subgroup 2 (n = 14) involved the patients who had combined early EN and PN with the use of three-chambered bags with a high content of ѡ-3 fatty acids. Subgroup 3 (control) included the patients (n = 20) who underwent combined early EN and PN using separate modules with carbohydrates, amino acids, and lipids. Group of regional standards included 20 patients for comparison of laboratory and clinical parameters. Control points were as follows: at patient’s admission to the hospital and intensive care unit, 1st day (24 hours after the start of intensive care), 3rd, 5th, 7th, 14th, 21st days. The results of the analysis of patients demonstrated that the patients had severe AP under the APACHE score, the average values of which in patients of the subgroups 1, 2 and 3 were 18.3 ± 0.3, 18.6 ± 0.3 and 18.0 ± 0, 5 units, respectively. The development of severe AP was characterized by 4- and 5-fold increased levels of amylase blood and urine diastase, respectively, compared to normal parameters. From the 1st day of the disease, the course of severe AP in patients of subgroups 1, 2 and 3 was accompanied by the development of hypercatabolism, when the level of cortisol in blood exceeded the norms by 1.5, 1.9 and 1.5 times combined with stress-induced hyperglycemia and the tendency to hypoalbuminemia development. The blood level of C-reactive protein (CRP) increased to 125.4 ± 31.6, 106.6 ± 13.6 and 92.4 ± 14.5 mg/l, respectively. When hospitalized, the patients of subgroups 1, 2, and 3 presented with increased intra-abdominal pressure (IAP) by 31.3, 26.3 and 38.7 %, respectively. Against the background of the intensive care, within 5 days after admission in all patients blood levels of amylase decreased to the limits of normal (p = 0.001), diastase — within 7 days of intensive care. The appointment of an adequate volume of infusion therapy in the complex of intensive care in patients with AP allowed sounding the initial hemoconcentration for 3 days of intensive care. The average values of IAP significantly decreased 2 days after admission (р1 = 0.026, р2 = 0.005 and р3 = 0.001), that allowed early start and combination of EN and PN. The combination of EN with parenteral administration of mixtures with protein, fat and carbohydrate three-chamber bags in patients of subgroups 1 and 2 contributed to a faster recovery of a total blood protein (14 and 7 days, respectively). The addition of ω-3 fatty acids in the composition of the PN with three-chamber bags may have provided a protein-preserving effect in patients of two subgroups. Against the background of severe AP on day 3 of intensive care, blood albumin levels decreased in patients in subgroups 1 and 3 to 25.9 ± 1.3 and 26.3 ± 0.7 g/l (p < 0.001), mean values differed from those in 2 subgroup patients (p1, 2 = 0.013 and p2, 3 = 0.001). On day 5, in patients of subgroup 2, the average values of blood albumin probably increased to 33.2 ± 1.4 g/l. (p1, 2 = 0.022 and p2, 3 < 0.001). At day 14 of observation, in the patients of the subgroups 1 and 2 the mean albumin values were within the normal range of 31.8 ± 1.6 and 38.5 ± 2.2 g/l, respectively. In patients of the subgroup 3, blood albumin level was kept below normal (26.5 ± 1.2 g/l) and was probably lower in comparison with the patients in whom three-chamber bags for PN were used (p1, 3 = 0.068 and р2, 3 < 0.001). Against the background of nutritional support by a combination of EN and PN with the use of three-chambered bags enriched with ω-3 fatty acids, a more pronounced decrease in CRP was recorded on day 5 of IT (p1, 2 = 0.001 and p2, 3 = 0.001) manifesting with reduced leukocytosis and probable increase in blood lymphocyte level in patients of subgroup 2. In patients of subgroup 1 who started EN with PN with three-chambered bags, the blood lymphocyte level for 14–21 days of intensive care of severe AP normalized. Up to 5 days of AP course, in patients of subgroups 1 and 2 the combination of EN and PN with three-chambered bags, balanced by macronutrients, provided a calorie 24.5 kcal/kg and 26.1 kcal/kg, which allowed reach the target 100% calorie for 5 days of intensive care. Against the use of module PN in patients of the subgroup 3, the total calorific value was 19.7 kcal/kg. In the subgroup 2 patients, the using of three-chambered bags enriched with omega-3 fatty acids in the intensive care complex probably reduced the total hospital bedtime to 20.5 ± 1.8 days in comparison with the patients with severe AP in subgroups 1 (27.6 ± 4.5 days) and 3 (30.5 ± 2.9 days).
гострий панкреатит; інтенсивна терапія; парентеральне харчування; ентеральне харчування; ɷ-3 жирні кислоти
острый панкреатит; интенсивная терапия; парентеральное питание; энтеральное питание; ɷ-3 жирные кислоты
acute pancreatitis; intensive care; parenteral nutrition; enteral nutrition; omega-3 fatty acids
Вступ
Матеріали та методи
Результати та обговорення
/115_2.jpg)
/116.jpg)
Висновки
1. Leppäniemi A., Tolonen M., Tarasconi A. et al. 2019 WSES guidelines for the management of severe acute pancreatitis. World Journal of Emergency Surgery. 2019. 14. 27. doi: 10.1186/s13017-019-0247-0.
2. Bakker O.J., van Brunschot S., van Santvoort H.C. et al. Early versus on-demand nasoenteric tube feeding in acute pancreatitis. N. Emgl. J. Med. 2014. 371. 1983-93.
3. Jaipura J., Bhandary V., Singh Chawla A., Singh M. Intra-abdominal pressure: Time ripe to revise management guidelines of acute pancreatitis? World J. Gastrointest. Pathophysiol. 2016. 7. 186-198. Doi: 10.4291/wjgp.v7.i1.186.
4. Yi F., Ge L., Zhao J. et al. Meta-analysis: total parenteral nutrition versus total enteral nutrition in predicted severe acute pancreatitis. Intern. Med. 2012. 51. 523-530.
5. Villet S., Chiolero R.L., Bollmann M.D. et al. Negative impact of hypocaloric feeding and energy balance on clinical outcome in ICU patients. Clin. Nutr. 2005. 24(4). 502-509.
6. Heidegger C.P., Berger M.M., Graf S., Zingg W., Darmon P., Costanza M.C., Thibault R., Pichard C. Optimisation of energy provision with supplemental parenteral nutrition in critically ill patients: a randomised controlled clinical trial. Lancet. 2013. 381(9864). 385-393.

/115.jpg)
/117.jpg)