Международный эндокринологический журнал Том 15, №5, 2019
Вернуться к номеру
Оцінка ефективності лікування пацієнтів з ознаками затримки внутрішньоутробного розвитку при оптимізації дози препаратів рекомбінантного гормону росту
Авторы: Большова О.В., Музь Н.М.
ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
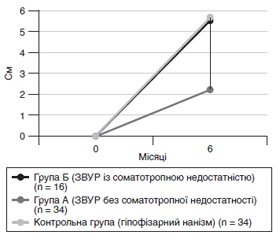
Актуальність. Згідно зі світовими статистичними даними, близько 5–10 % новонароджених мають затримку внутрішньоутробного розвитку (ЗВУР) — народжуються з малою масою та/або низькою довжиною тіла щодо свого гестаційного віку. Внаслідок неадекватних темпів постнатального росту у таких дітей до 2-річного віку відзначається відставання в рості. Цей дефіцит прискорення росту спостерігається протягом усього дитинства і підліткового періоду, що у кінцевому підсумку призводить до низькорослості у дорослому віці. Мета: проаналізувати ефективність терапії різних дозових рівнів препаратів рекомбінантного гормону росту (рГР) з метою корекції росту у дітей допубертатного віку з ознаками затримки внутрішньоутробного розвитку. Матеріали та методи. Обстежені 50 дітей (16 дівчаток і 34 хлопчики) з відставанням у рості (середній вік — 6,82 ± 0,36 року), які народилися з ознаками ЗВУР. За результатами тестів із клонідином та інсуліном, пацієнтів з ознаками ЗВУР було розподілено на дві групи: група А — діти без соматотропної недостатності (n = 34; 68 %), група Б — пацієнти з дефіцитом гормону росту (n = 16; 32 %). Група контролю включала 34 пацієнтів (середній вік — 6,58 ± 0,38 року) із соматотропною недостатністю — 13 дівчаток і 21 хлопчика. Усі пацієнти отримували лікування рекомбінантним гормоном росту, починаючи з дози 0,03 мг/кг/добу згідно з протоколом для гіпофізарного нанізму; у разі незадовільної швидкості росту дозу поступово збільшували до 0,05 мг/кг/добу у пацієнтів групи Б. Результати. Вірогідне сповільнення прискорення росту в перші 6 місяців лікування рГР у дозі 0,033 мг/кг/добу було виявлено у пацієнтів з ознаками ЗВУР без соматотропної недостатності (р < 0,05). При лікуванні рГР у дозі 0,05 мг/кг/добу протягом наступних 6 місяців відбулося статистично значуще збільшення коефіцієнта стандартного відхилення SDS (Standard Deviation Score) росту пацієнтів з ознаками ЗВУР без соматотропної недостатності (–2,0 ± 0,14 SDS проти –2,58 ± 0,15 SDS перших 6 місяців з дозою рГР 0,033 мг/кг/добу) (р < 0,05). Висновки. Оптимальною дозою рГР для лікування дітей з ознаками ЗВУР із соматотропною недостатністю є 0,033 мг/кг/добу, а у пацієнтів з ознаками ЗВУР без дефіциту гормону росту — 0,05 мг/кг/добу.
Актуальность. Согласно мировым статистическим данным, около 5–10 % новорожденных имеют задержку внутриутробного развития (ЗВУР) — рождаются с малой массой и/или низкой длиной тела относительно своего гестационного возраста. В результате неадекватных темпов постнатального роста у таких детей до 2-летнего возраста отмечается отставание в росте. Данный дефицит ускорения роста наблюдается в течение всего детства и подросткового периода, что в конечном итоге приводит к низкорослости во взрослом возрасте. Цель: проанализировать эффективность терапии различных дозовых уровней препаратов рекомбинантного гормона роста (рГР) с целью коррекции роста у детей допубертатного возраста с признаками задержки внутриутробного развития. Материалы и методы. Обследованы 50 детей (16 девочек и 34 мальчика) с отставанием в росте (средний возраст — 6,82 ± 0,36 года), которые родились с признаками ЗВУР. По результатам тестов с клонидином и инсулином, пациенты с признаками ЗВУР были распределены на две группы: группа А — дети без соматотропной недостаточности (n = 34; 68 %), группа Б — пациенты с дефицитом гормона роста (n = 16; 32 %). Группа контроля включала 34 пациента (средний возраст — 6,58 ± 0,38 года) с соматотропной недостаточностью — 13 девочек и 21 мальчика. Все пациенты получали лечение рГР, начиная с дозы 0,03 мг/кг/сут, согласно протоколу для гипофизарного нанизма; в случае неудовлетворительной скорости роста дозу постепенно увеличивали до 0,05 мг/кг/сут у пациентов группы Б. Результаты. Достоверное замедление ускорения роста в первые 6 месяцев лечения рГР в дозе 0,033 мг/кг/сут было выявлено у пациентов с признаками ЗВУР без соматотропной недостаточности (р < 0,05). При лечении рГР в дозе 0,05 мг/кг/сут в течение следующих 6 месяцев произошло статистически значимое увеличение коефициента стандартного отклонения SDS (Standard Deviation Score) роста пациентов с признаками ЗВУР без соматотропной недостаточности (–2,0 ± 0,14 SDS против –2,58 ± 0,15 SDS первых 6 месяцев с дозой РГР 0,033 мг/кг/сут) (р < 0,05). Выводы. Оптимальная доза рГР для лечения детей с признаками задержки внутриутробного роста с соматотропной недостаточностью — 0,033 мг/кг/сут, а у пациентов с признаками ЗВУР без дефицита гормона роста — 0,05 мг/кг/сут.
Background. According to world statistics, about 5–10 % of newborns are small for gestational age (SGA). They can have inadequate rates of postnatal growth during first two years of life. This growth deficiency is observed throughout childhood and adolescence, which ultimately leads to short stature in adulthood. The purpose was to analyze the efficacy of different doses of recombinant growth hormone (rGH) therapy in order to correct growth in pre-pubertal children born small for gestational age. Materials and methods. Fifty children born small for gestational age (16 girls and 34 boys with mean age of 6.82 ± 0.36 years) with growth failure were examined. According to the results of clonidine and insulin tests, SGA patients were divided into two groups: group A — children without grown hormone deficiency (n = 34; 68 %), group B — patients with growth hormone deficiency (n = 16; 32 %). The control group included 34 persons (13 girls and 21 boys with mean age of 6.58 ± 0.38 years) with growth hormone deficiency. All patients received rGH treatment starting with a dose of 0.03 mg/kg/day according to the pituitary hormone deficiency protocol, and in case of slow growth rate, the dose was gradually increased to 0.05 mg/kg/day in group B patients. Results. A significant slowdown in growth acceleration in the first 6 months of rGH treatment at dose of 0.033 mg/kg/day was found in SGA patients without grown hormone deficiency (p < 0.05). The rGH treatment at a dose of 0.05 mg/kg/day for the next 6 months showed a statistically significant increase in growth standard deviation score (SDS) of SGA patients without growth hormone deficiency (–2.00 ± 0.14 SDS vs. –2.58 ± 0.15 SDS in the first 6 months with rGH dose of 0.033 mg/kg/day) (p < 0.05). Conclusions. The optimal dose of rGH treatment in small for gestational age children with growth hormone deficiency is 0.033 mg/kg/day, and in SGA patients without growth hormone deficiency — 0.05 mg/kg/day.
внутрішньоутробна затримка росту; діти; соматотропний гормон; соматотропна недостатність; лікування
внутриутробная задержка роста; дети; соматотропный гормон; соматотропная недостаточность; лечение
small for gestational age; children; somatotropin; growth hormone deficiency; treatment
Вступ
Матеріали та методи
Результати
/29.jpg)
Oбговорення
Висновки
1. Albertsson-Wikland K. Children born small-for-gestational age: postnatal growth and hormonal status. J. Horm. Res. 1998. Vol. 49, № 2. P. 7-13.
2. Clayton P.E. Management of the child born small for gestational age through to adulthood: a consensus statement of the International Societies of Paediatric Endocrinology and the Growth Hormone Research Society. J. Clin. Endocrinol. Metab. 2007. Vol. 92, № 3. P. 804-810.
3. Peleg D. Intrauterine Growth Restriction: Identification and Management. Am. Fam. Physician. 1998. Vol. 58, № 2. P. 453-460.
4. Krishnamurthy M. Screening investigations in small-for-gestational-age near-term and term infants. Eur. J. Pediatr. 2017. Vol. 10. P. 3031-3038.
5. De Zegher F. Endocrinology of Small-for Gestation-Age Children: Recent Advances. Horm. Res. 2004. Vol. 62, № 3. P. 141-144.
6. Rosilio M. Adult height of prepubertal short children born small for gestational age treated with GH. Eur. J. Endocrinol. 2005. Vol. 152(6). Р. 835-843.
7. Большова Е.В. Особенности клинического и гормонального статуса детей и подростков с задержкой внутриутробного развития. Педиатрия. Восточная Европа. 2015. № 1(09). C. 79-87.
8. Van der Steen M. Growth and Metabolism in Children Born Small for Gestational Age. Endocrinol. Metab. Clin. North. Am. 2016. Vol. 45, № 2. P. 283-294.
9. Grunt J.A. Acute and long-term responses to hGH in children with idiopathic small-of-dates dwarfism. J. Clin. Endocrinol. Metab. 1972. Vol. 35. Р. 157-168.
10. Tanner J. Effect of human growth hormone treatment for 1 to 7 years on the growth of 100 children with growth hormone deficiency, low birth weight, inherited smallness, Turner’s syndrome, and other complaints. Arch. Dis. Child. 1971. Vol. 46. P. 745-782.
11. Ranke M.B. Diagnosis of growth hormone deficiency and growth hormone stimulation tests. Basel, Karger, 2011. P. 102-137.
12. Tanner J.M., Davies P.S. Clinical longitudinal standards for height and height velocity for north American children. J. Pediatr. 1985. Vol. 107. P. 317-329.
13. Наказ Міністерства охорони здоров’я України «Про затвердження протоколів надання медичної допомоги дітям за спеціальністю «Дитяча ендокринологія» № 254 від 27.04.2006 р.
14. Labarta J. Growth and growth hormone treatment in short stature children born small for gestational age. Pediatr. Endocrinol. Rev. 2009. Vol. 6, № 3. P. 350-357.
15. Bang P. Identification and management of poor response to growth-promoting therapy in children with short stature. Clin. Endocrinol. (Oxf). 2012. Vol. 77, № 2. P. 169-181.
16. Karlberg J. Analysis of linear growth using a mathematical model. II. From 3 to 21 years of age. Acta Paediatr. Scand. 1987. Vol. 337. P. 12-29.
17. Van Dijk M. High serum levels of growth hormone (GH) and insulin-like growth factor-I (IGF-I) during high-dose GH treatment in short children born small for gestational age. J. Clin. Endocrinol. Metab. 2016. Vol. 91. P. 1390-1396.
18. Rapaport R. Three years of growth hormone therapy in children born small for gestational age: results from the ANSWER Program. Endocrine Connections. 2018. Vol. 7. P. 1096-1104.
19. Cutfield W.S. Safety of growth hormone treatment in children born small for gestational age: the US trial and KIGS analysis. Horm. Res. 2006. Vol. 65, № 3. P. 153-159.

/29_2.jpg)