Газета «Новости медицины и фармации» №12 (700), 2019
Вернуться к номеру
Липопротеин-ассоциированная фосфолипаза А2 как независимый маркер риска сердечно-сосудистых заболеваний
Авторы: Мельник А.А., к.б.н.
Специализированный медицинский центр «Оптима-фарм», г. Киев, Украина
Разделы: Справочник специалиста
Версия для печати
Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смерти в мире. По оценкам экспертов, ССЗ уносят жизни 17,9 миллиона человек ежегодно, что составляет примерно 31 % всех смертей в мире, из которых 85 % связаны с ишемической болезнью сердца (ИБС), включая инфаркт миокарда и инсульт. Из-за их широкой распространенности и высокой смертности ССЗ стали основной проблемой общественного здравоохранения [1, 2]. Хотя традиционные факторы риска для этих патологических состояний, к которым относятся гипертензия, сахарный диабет, табакокурение и гиперхолестеринемия, позволили создать модель для прогнозирования риска, тем не менее до 20 % пациентов с ишемической болезнью сердца не имеют этих факторов, а 40 % имеют только один [3]. Более того, в 35 % случаев у больных с ИБС, которые умерли, уровень холестерина липопротеинов низкой плотности (ЛПНП) был в пределах нормальных значений [4]. Такая стратегия с использованием модели для прогнозирования риска ССЗ является экономически неэффективной и ограничена прогностической ценностью. Дальнейшие исследования, направленные на улучшение стратификации риска при ССЗ, привели к созданию и внедрению в практическую медицину новых биомаркеров, среди которых высокочувствительный С-реактивный белок (hs-CRP), мозговой натрийуретический пептид (NT-proBNP) и липопротеин-ассоциированная фосфолипаза А2 (Lр-PLA2). В клинических исследованиях было показано, что активность и масса Lp-PLA2 в плазме тесно связаны с атерогенными липидами и сосудистым риском, что послужило основанием для применения данного фермента в качестве биомаркера сердечно-сосудистых заболеваний, а ингибирование его активности может представлять привлекательную терапевтическую стратегию.
Биохимические свойства и механизм действия Lp-PLA2
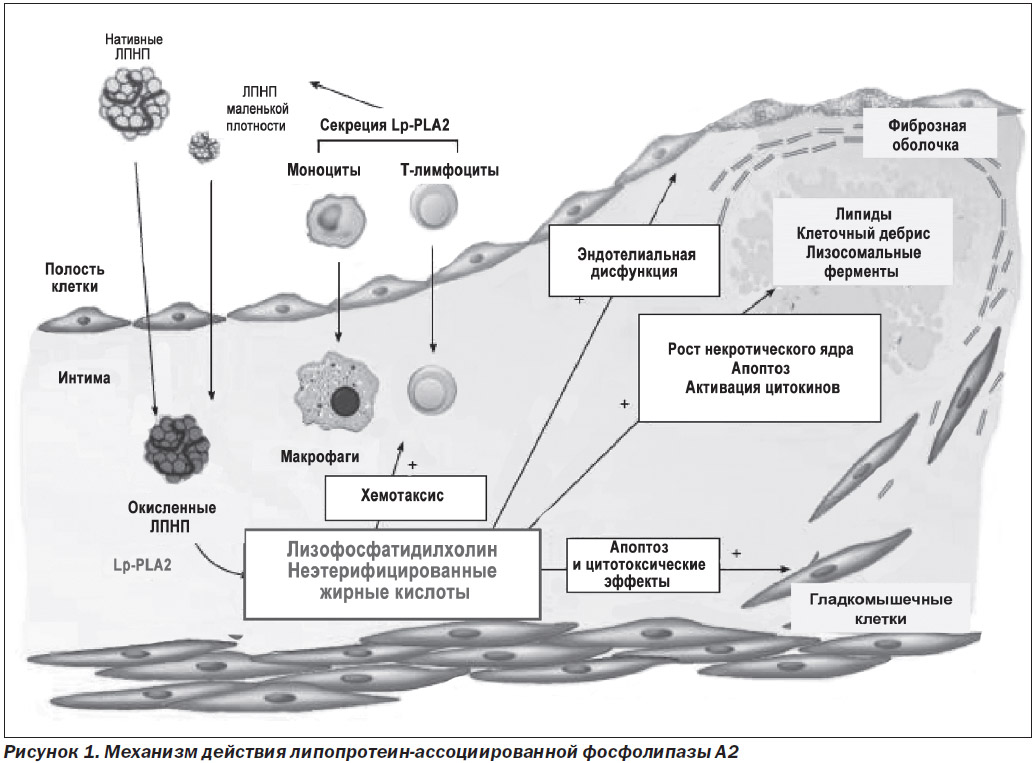
Липопротеин-ассоциированная фосфолипаза А2, также известная как ацетилгидролаза фактора активации тромбоцитов (PAF-AH), принадлежит к суперсемейству фосфолипаз А2 и является Са2+-независимой фосфолипазой, которая кодируется геном PLA2G7, состоящим из 12 экзонов и 11 интронов, локализованных на хромосоме 6р21.2-12 [5–7]. Lp-PLA2 представляет собой белок с м.в. ~ 45,4 кДа (величина переменная из-за высокой степени гликозилирования), имеющий 441 аминокислотный остаток. Этот фермент характеризуется своей способностью специфически гидролизовать фактор активации тромбоцитов (1-0-алкил-2-ацетил-СН-глицерил-3-фосфорилхолин, или PAF), а также глицерофосфолипиды, содержащие короткие и/или окисленные группы жирных кислот в положении sn-2 глицеринового остова. Lp-PLA2 имеет в своем активном центре каталитическую триаду из трех аминокислот серин/аспартат/гистидин, находящихся соответственно в положениях 273, 296 и 351, которая линейно ориентирована и соответствует конформации α/β-гидролазы для нейтральных липаз и эстераз, что было подтверждено ее кристаллической структурой в растворе [8, 9]. Основными источниками Lp-PLA2 в плазме являются Т-лимфоциты, моноциты/макрофаги, активированные тучные клетки и клетки печени [10]. В крови фермент циркулирует в виде активных форм и с образованием комплексов. Так, 70–80 % Lp-PLA2 связаны с ЛПНП в результате специфического взаимодействия «белок — белок» между N-терминальным остатком Lp-PLA2 и С-терминальным остатком аполипротеина АроВ. Остальные 20–30 % распределяются между липопротеинами высокой плотности (ЛПВП), липопротеинами очень низкой плотности (ЛПОНП) и липопротеином (а) (Lp(a)) [11]. После окисления ЛПНП короткая ацильная группа в положении sn-2 фосфолипидов становится восприимчивой к гидролитическому действию Lp-PLA2 и продуцирует мощный провоспалительный и проатерогенный медиатор лизофосфатидилхолин (лизо-ФХ), а также окисленные неэтерифицированные жирные кислоты. Лизофосфатидилхолин является мощным хемоаттрактантом для Т-лимфоцитов и моноцитов, индуцирует апоптоз гладкомышечных клеток, приводит к эндотелиальной дисфункции и стимулирует экспрессию молекул адгезии и цитокинов (рис. 1).
Связь липопротеин-ассоциированной фосфолипазы А2 с риском ССЗ
Интерес к Lp-PLA2 как к биомаркеру ССЗ возник после публикации отчета WOSCOPS (West of Scotland Coronary Prevention Study), в котором была показана положительная связь между увеличением концентрации Lp-PLA2 в крови и риском коронарных событий [12]. Один из важных выводов WOSCOPS заключался в том, что в отличие от таких воспалительных биомаркеров, как h-CRP, количество лейкоцитов и фибриногена, только ассоциация Lp-PLA2 с риском коронарных событий не зависела от действия других факторов. Это было подтверждено в других исследованиях, включая MONICA (MONItoring of trends and determinants in Cardiovascular disease) [13], Rotterdam Study [14], Rancho Bernardo [15] и Bruneck [16]. В метаанализе Collaboration [17] такая связь была изучена в 32 проспективных исследованиях, которые включали 79 000 участников (35 945 субъектов, не имеющих в анамнезе сосудистые заболевания в начале исследования, 32 453 пациента со стабильной ишемической болезнью сердца и 10 638 пациентов с диагнозом «острый коронарный синдром»). При анализе учитывалась корректировка по возрасту, полу и факторам липидного и нелипидного риска. У здоровых людей не обнаружена связь между активностью Lp-PLA2 и коронарными заболеваниями сердца или ишемическим инсультом.
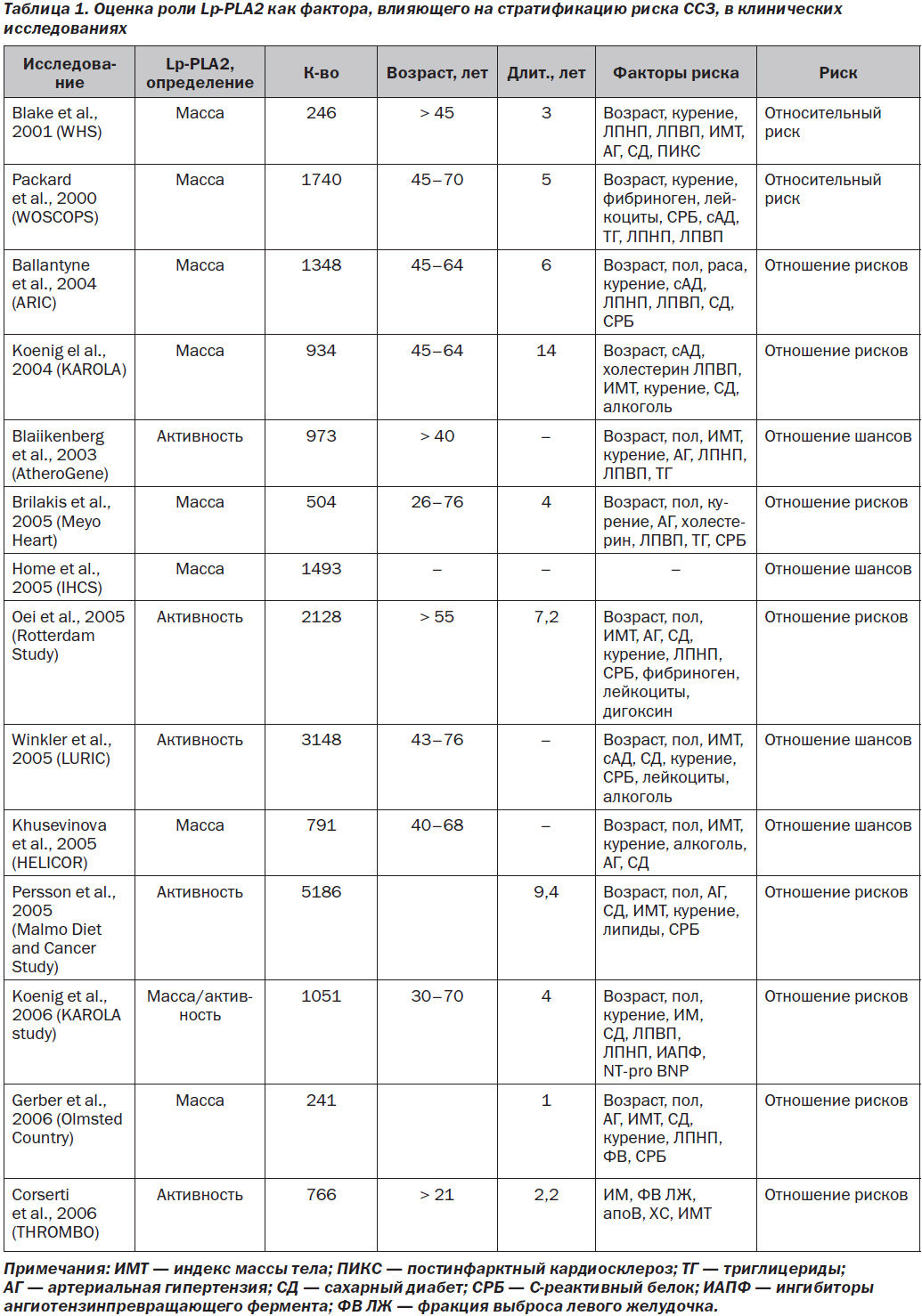
В многочисленных публикациях приводятся данные эпидемиологических исследований, наглядно подтверждающие наличие связи между уровнем Lp-PLA2 и риском возникновения ССЗ. Исследования, в которых оценивалась роль Lp-PLA2 как фактора, влияющего на стратификацию риска ССЗ, представлены в табл. 1 [18].
В настоящее время определение Lp-PLA2 включено в американские и европейские протоколы оценки сердечно-сосудистого риска для пациентов: ACCF/AHA Guideline for Assess-ment of Cardiovascular Risk in Asymptomatic Adults (2010), AHA/ASA Guidelines for the Primary Prevention of Stroke (2011), AACE Guidelines for Management of Dyslipidemia and Prevention of Atherosclerosis (2012), Euro-pean Guidelines on CVD Prevention in Clinical Practice — European Society of Cardiology (2012) [19, 20].
Методы определения Lp-PLA2
Для определения Lp-PLA2 используются два метода — определение концентрации фермента (по массе) и его ферментативной активности. Необходимо отметить, что еще в 2005 г. после многолетних проспективных исследований тест для измерения массы Lp-PLA2 был официально одобрен FDA (Food and Drug Administration, US) для оценки риска ССЗ и ишемического инсульта [21].
Измерение Lp-PLA2 (по массе)
Для определения Lp-PLA2 по массе используется коммерческий набор PLAC® Mass Test (diaDexus Inc., South San Francisco, CA). В 2016 г. компания Diazyme Laboratories приобрела все активы diaDexus Inc., по-этому наборы PLAC® для пользователей сейчас предлагает Diazyme Laboratories Inc., Poway, California, USA.
Тест основан на принципе иммуноферментного анализа (ELISA, сэндвич-метод) с использованием двух специфических моноклональных антител. Плазму добавляют в лунки микропланшета с анти-Lp-PLA2 моноклональными антителами (2С10) и инкубируют в течение 10 мин при комнатной температуре. Затем добавляют вторые моноклональные антитела (4В4), меченные ферментом пероксидазы хрена, и инкубируют в течение 180 мин. Лунки промывают и добавляют субстрат тетраметилбензидин. После 20 мин инкубации измеряют поглощение при 450 нм, которое прямо пропорционально концентрации Lp-PLA2 в плазме. Концентрация Lp-PLA2 выражается в единицах нг/мл (область измерения — 1,2–2000 нг/мл).
Измерение Lp-PLA2 (активность)
Набор PLAC® Тest Activity (Diazyme Laboratories Inc.) основан на определении ферментативной активности Lp-PLA2 в сыворотке или плазме. При определении активности Lp-PLA2 происходит гидролиз субстрата 1-миристоил-2-(4-нитрофенил-сукцинила) фосфатидилхолина в положении sn-2 с образованием окрашенного продукта реакции 4-нитрофенола. Скорость образования 4-нитрофенола измеряется спектрофотометрически, а активность Lp-PLA2 рассчитывается по скорости изменения абсорбции. Активность фермента выражается в единицах нмоль/мин/мл (область измерения — 10–382 нмоль/мин/мл).
Важно отметить, что измерения Lp-PLA2 по массе и активности представляют частично потенциально разные физиологически значимые виды Lp-PLA2. Метод определения Lp-PLA2 по массе заключается в том, что эпитопы фермента подвергаются воздействию антител в присутствии интактных липопротеинов, тогда как при анализе активности Lp-PLA2 это осуществляется после деструкции липопротеинов детергентом. Поэтому определение Lp-PLA2 по массе представляет собой так называемую экспозиционную Lp-PLA2, а Lp-PLA2-активность — это общие Lp-PLA2 в плазме [22].
Хотя в клинических исследованиях было показано, что с риском ССЗ связаны оба параметра, характеризующие Lp-PLA2 (масса и ферментативная активность), в настоящее время только тест для определения Lp-PLA2 (масса) разрешен для клинического применения. Этому тесту присвоен также знак CE, подтверждающий соответствие стандартам качества и безопасности Европейского союза.
Референтные значения Lp-PLA2
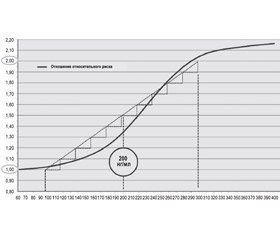
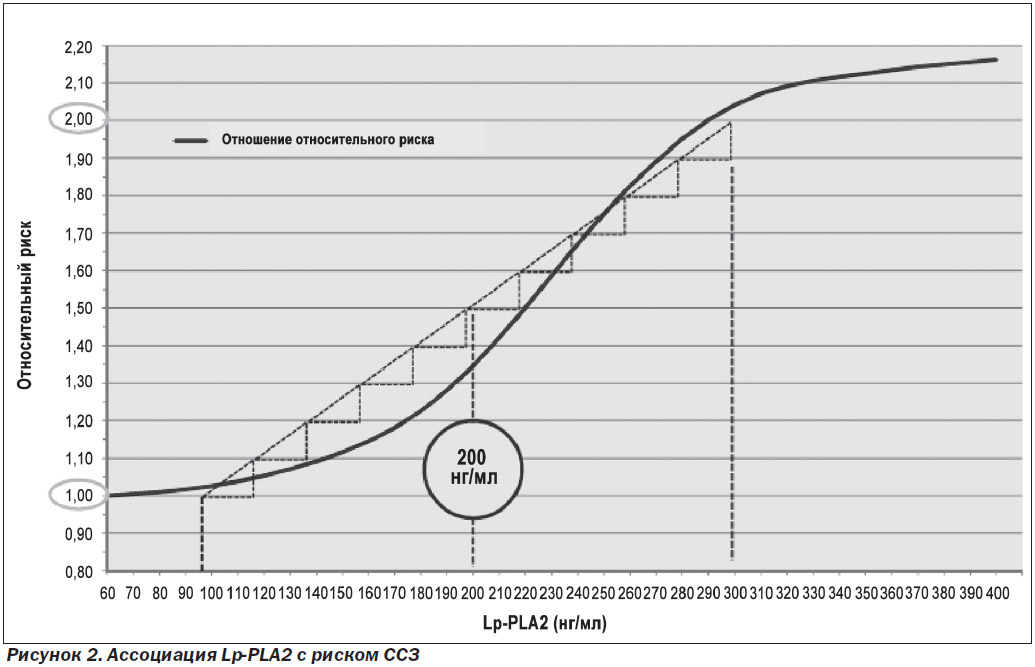
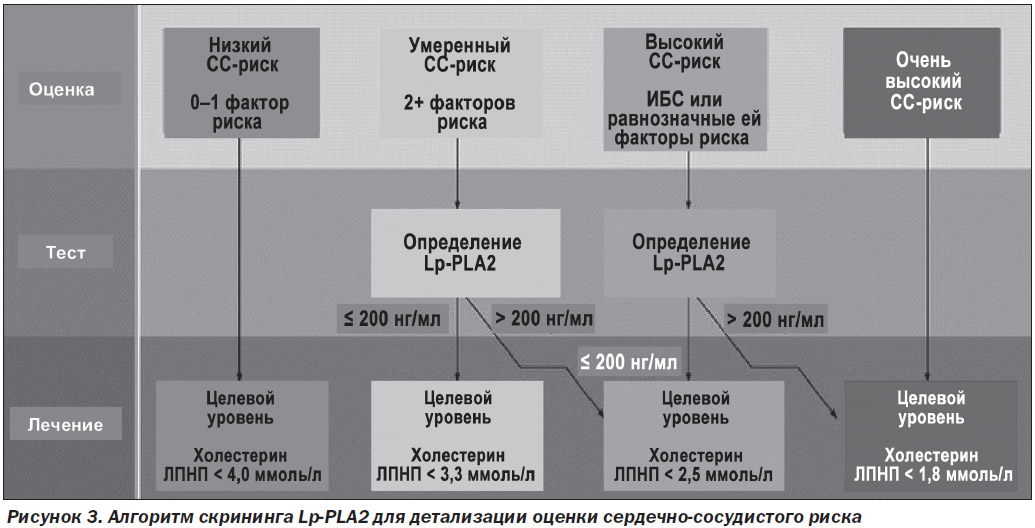
Повышение концентрации Lp-PLA2 имеет клинический пограничный уровень — 200 нг/мл, выше которого риски резко возрастают (рис. 2).
Во многих клинических лабораториях рекомендуются следующие референтные уровни Lp-PLA2 [23]:
— низкий риск < 200 нг/мл;
— пограничный диапазон 200–235 нг/мл;
— высокий риск > 235 нг/мл.
Клиническое использование Lp-PLA2: экспертные рекомендации
Для улучшения прогнозирования риска развития ССЗ следует измерять уровень Lp-PLA2 и использовать полученные данные в дополнение к традиционным факторам риска [24]. Измерение уровня Lp-PLA2 рекомендуется проводить у пациентов с умеренным риском (предположительно здоровые лица с двумя или более традиционными факторами риска, что по Фрамингемской шкале 10-летнего риска соответствует 10–20 %), а также у пациентов с высоким риском (установленный диагноз ИБС или факторами риска, равнозначными ИБС), нуждающихся в более радикальной коррекции стиля жизни и липид-модифицирующей терапии. Клиническим порогом, который предоставляет право на переклассификацию риска, является значение Lp-PLA2 ≥ 200 нг/мл. Эта величина получена на основе обзора исследований, в которых был показан заметный рост риска наступления сердечно-сосудистых событий у пациентов с превышением данного порога [25, 26]. Таким образом, лица из группы умеренного риска, у которых были определены значения Lp-PLA2 ≥ 200 нг/мл, реклассифицируются и получают статус пациентов с высоким риском развития ИБС, а пациенты с ИБС или факторами риска, равнозначными ИБС, и повышенным уровнем Lp-PLA2 переводятся в группу очень высокого риска (рис. 3).
Выводы
Сердечно-сосудистые заболевания являются одной из основных причин заболеваемости и смертности в мире. Частота ССЗ в значительной степени может быть предотвращена или сведена к минимуму, если на ранней стадии выявлены факторы риска. Одним из высокоспецифических биомаркеров является липопротеин-ассоциированная фосфолипаза А2, которая считается самостоятельным фактором риска ССЗ.
Преимущества и отличия Lp-PLA2 по сравнению с другими тестами:
1. Увеличение уровней Lp-PLA2 не зависит от традиционных сердечно-сосудистых факторов риска.
2. Lp-PLA2 является ферментом, продуцируемым макрофагами, инфильтрованными в атеросклеротических бляшках, поэтому его определение более специфично по сравнению с другими воспалительными маркерами.
3. Определение Lp-PLA2 помогает выявить скрытый риск сердечно-сосудистых событий, которые могут быть пропущены при использовании стандартных факторов риска (например, уровень холестерина, артериальное давление, семейный анамнез, табакокурение).
4. Уровни липидов не могут предоставить достаточно информации о состоянии стенки артерии, в то время как Lp-PLA2 отражает этот статус независимо от других сердечно-сосудистых маркеров.
5. Lp-PLA2 специфичен для сосудов и не продуцируется при других воспалительных процессах в отличие от прочих воспалительных маркеров (например, hs-СRP).
6. Мониторинг за снижением Lp-PLA2 и ЛПНП в ответ на терапию является лучшим индикатором эффективности лечения по сравнению только с определением ЛПНП.
7. Lp-PLA2 имеет минимальную биологическую вариабельность.
8. По результатам определения Lp-PLA2 возможно определить цель и дальнейшую стратегию лечения пациента.
1. Benjamin E.J., Virani S.S., Callaway C.W. et al. Heart Disease and Stroke Statistics 2018 update: a report from the American Heart Association. Circulation. 2018. 137(12). Р. e67-e492.
2. Forouzanfar M.H., Alexander L., Anderson H.R. et al. Global, regional, and national comparative risk assessment of 79 behavioural, environmental and occupational, and metabolic risks or clusters of risks in 188 countries, 1990–2013: a systematic analysis for the global burden of disease study 2013. Lancet. 2015. 386. Р. 2287-2323.
3. Hozawa A., Folsom A.R., Sharrett A.R. et al. Absolute and attributable risks of cardiovascular disease incidence in relation to optimal and borderline risk factors: comparison of African American with white subjects-atherosclerosis risk in communities study. Arch. Intern. Med. 2007. 167. Р. 573-579.
4. Khot U.N., Khot M.B., Bajzer C.T. et al. Prevalence of conventional risk factors in patients with coronary heart disease. JAMA. 2003. 290(7). Р. 898-904.
5. Schaloske R.H., Dennis E.A. The phospholipase A2 superfamily and its group numbering system. Biochim. Biophys. Acta. 2006. 1761(11). Р. 1246-1259.
6. Burke J.E., Dennis E.A. Phospholipase A2 biochemistry. Cardiovasc. Drugs. Ther. 2009. 23. Р. 49-59.
7. Zalewski A., Macphee C. Role of lipoprotein-associa–ted phospholipase A2 in atherosclerosis: biology, epidemio–logy, and possible therapeutic target. Arterioscler. Thromb. Vasc. Biol. 2005. 25(5). Р. 923-931.
8. Tjoelker L.W., Eberhardt C., Unger J., Trong H.L., Zimmerman G.A., McIntyre T.M., Stafforini D.M., Prescott S.M., Gray P.W. Plasma platelet-activating factor acetylhydrolase is a secreted phospholipase A2 with a catalytic triad. J. Biol. Chem. 1995. 270. Р. 25481-25487.
9. Samanta U., Bahnson B.J. Crystal structure of human plasma platelet-activating factor acetylhydrolase: structural implication to lipoprotein binding and catalysis. J. Biol. Chem. 2008. 283. Р. 31617-31624.
10. Asano K., Okamoto S., Fukunaga K., Shiomi T., Mori T., Iwata M., Ikeda Y., Yamaguchi K. Cellular source(s) of platelet-activating-factor acetylhydrolase activity in plasma. Biochem. Biophys. Res. Commun. 1999. 261(2). Р. 511-514.
11. Stafforini D.M., Tjoelker L.W., McCormick S.P. et al. Molecular basis of the interaction between plasma platelet-activating factor acetylhydrolase and low-density lipoprotein. J. Biol. Chem. 1999. 274. Р. 7018-7024.
12. Packard C.J., O’Reilly D.S., Caslake M.J., McMahon A.D., Ford I., Cooney J., Macphee C.H., Suckling K.E., Krishna M., Wilkinson F.E., Rumley A., Lowe G.D. Lipoprotein-associated phospholipase A2 as an independent predictor of coronary heart disease: West of Scotland Coronary Prevention Study Group. N. Engl. J. Med. 2000. 343. Р. 1148-1155.
13. Koenig W., Khuseyinova N., Lowel H., Trischler G., Meisinger C. Lipoprotein-associated phospholipase A2 adds to risk prediction of incident coronary events by C-reactive protein in apparently healthy middle-aged men from the general population: results from the 14-year follow-up of a large cohort from southern Germany. Circulation. 2004. 110. Р. 1903-1908.
14. Oei H.H., van der Meer I.M., Hofman A., Koudstaal P.J., Stijnen T., Breteler M.M., Witteman J.C. Lipoprotein-associated phospholipase A2 activity is associated with risk of coronary heart disease and ischemic stroke: the Rotterdam Study. Circulation. 2005. 111. Р. 570-575.
15. Daniels L.B., Laughlin G.A., Sarno M.J., Bettencourt R., Wolfert R.L., Barrett-Connor E. Lipoprotein-associated phospholipase A2 is an independent predictor of incident coronary heart disease in an apparently healthy older population: the Rancho Bernardo Study. J. Am. Coll. Cardiol. 2008. 51. Р. 913-919.
16. Kiechl S., Willeit J., Mayr M., Viehweider B., Oberhollenzer M., Kronenberg F., Wiedermann C.J., Obertha–ler S., Xu Q., Witztum J.L., Tsimikas S. Oxidized phospholipids, lipoprotein(a), lipoprotein-associated phospholipase A2 activity, and 10-year cardiovascular outcomes: prospectiveresults from the Bruneck study. Arterioscler. Thromb. Vasc. Biol. 2007. 27. Р. 1788-1795.
17. Thompson A., Gao P., Orfei L., Watson S., Di Angelantonio E., Kaptoge S., Ballantyne C., Cannon C.P., Criqui M., Cushman M., Hofman A., Packard C., Thompson S.G., Collins R., Danesh J. Lipoprotein-associated phospholipase A(2) and risk of coronary disease, stroke, and mortality: collaborative analysis of 32 prospective studies. Lancet. 2010. 375. Р. 1536-1544.
18. Garza C.A., Montori V.M., Mcconnell J.P. Association Between Lipoprotein-Associated Phospholipase A2 and Cardiovascular Disease: A Systematic Review. Mayo Clin Proc. February 2007. 82(2). Р. 159-165.
19. Jellinger P.S., Smith D.A., Mehta A.E., Ganda O., Handelsman Y., Rodbard H.W., Shepherd M.D., Seibel J.A. AACE task force for management of dyslipidemia and prevention of atherosclerosis: American Association of Clinical Endocrinologists’ Guidelines for Management of Dyslipidemia and Prevention of Atherosclerosis: Executive summary. Endocr. Pract. 2012. 18. Р. 269-293.
20. Perk J., De Backer G., Gohlke H., Graham I., Reiner Z., Verschuren W.M., Albus C., Benlian P., Boysen G., Cifkova R. et al; European Association for Cardiovascular Prevention & Rehabilitation (EACPR): European guidelines on cardiovascular disease prevention in clinical practice (version 2012): The fifth joint task force of the European society of cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of nine societies and by invited experts). Int. J. Behav. Med. 2012. 19. Р. 403-488.
21. US Food and Drug Administration. 510(k) Summary: diaDexus PLAC™ test. http://www.accessdata.fda.gov/cdrh_docs/pdf5/K050523.pdf.
22. Gazi I., Lourida E.S., Filippatos T., Tsimihodimos V., Elisaf M., Tselepis A.D. Lipoprotein-associated phospholipase A2 activity is a marker of small, dense LDL particles in human plasma. Clin. Chem. 2005. 51. Р. 2264-2273.
23. Corson M.A. et al. Review of the evidence for the clinical utility of lipoprotein-associated phospholipase A2 as a cardiovascular risk marker. Am. J. Cardiol. 2008. 101(12A). Р. 41F-50F.
24. Davidson M.H., Alberts M.J., Anderson J.L. et al. Consensus panel recommendation for incorporating
Lp-PLA2 testing into cardiovascular disease risk assessment guidelines. Am. J. Cardiol. 2008. 101. Р. 51F-7F.
25. Winkler K., Hoffmann M.M., Winkelmann B.R. et al. Lipoproteinassociated phospholipase A2 predicts 5-year cardiac mortality independently of established risk factors and adds prognostic information in patients with low and medium high-sensitivity Creactive protein (the Ludwigshafen risk and cardiovascular health study). Clin. Chem. 2007. 53. Р. 1440-7.
26. Gerber Y., McConnell J.P., Jaffe A.S., Weston S.A., Killian J.M., Roger V.L. Lipoprotein-associated phospholipase A2 and prognosis after myocardial infarction in the community. Arterioscler. Thromb. Vasc. Biol. 2006. 26. Р. 2517-22.