Журнал «Здоровье ребенка» Том 14, №6, 2019
Вернуться к номеру
Оцінка ефективності застосування пробіотиків при атопічному дерматиті на фоні харчової алергії в дітей
Авторы: Няньковський С.Л.(1), Няньковська О.С.(1), Городиловська М.І.(1), Томків Я.В.(2), Вівчарівська Г.З.(2), Шайдич В.Д.(2), Горайська О.М.(2), Заставна Л.В.(2), Возняк А.В.(1), Троцький Г.М.(1), Лісний А.Є.(1), Томків З.В.(1)
(1) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) — Комунальне некомерційне підприємство «Міська дитяча клінічна лікарня м. Львова», м. Львів, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. За даними European Academy of Allergy and Clinical Immunology, у середньому в європейських країнах 17,3 % населення мають прояви харчової алергії протягом життя. При цьому підвищена концентрація специфічних IgE до харчових продуктів визначається у 12,2 % дітей і підлітків і 4,1 % дорослих. Атопічний дерматит — це поширене хронічне запальне захворювання шкіри, що вражає до 20 % дітей і 10 % дорослих в індустріально розвинених країнах світу. Метою роботи було вивчити ефективність пробіотичного препарату Лактіалє для дітей і Лактіалє малюк у дітей з атопічним дерматитом на фоні харчової алергії. Матеріали та методи. Під нашим спостереженням перебували 97 дітей віком від 6 міс. до 9 років з діагнозом харчової алергії і атопічного дерматиту. Діти були розподілені на 2 групи. Основна група — 59 дітей, які отримували пробіотичний препарат Лактіалє для дітей або Лактіалє малюк протягом 3 місяців. Група контролю — 38 дітей, які не отримували пробіотичний препарат. Їм надавалися лише загальні рекомендації. Результати. Харчова алергія та атопічний дерматит на сьогодні залишаються однією з актуальних проблем сучасної педіатрії, оскільки посідають одну з домінуючих позицій у структурі захворюваності дітей раннього віку. Встановлено, що в дітей основної групи перебіг атопічного дерматиту на фоні харчової алергії був тяжчим, симптоматика порушення загального стану й показники копрологічного й бактеріологічного аналізів калу були вірогідно гіршими, ніж у дітей групи контролю, проте наприкінці дослідження спостерігалася вірогідно краща позитивна динаміка саме в дітей основної групи, які додатково отримували пробіотичний препарат Лактіалє для дітей або Лактіалє малюк, що свідчить про його ефективність і можливість рекомендувати його включення в схеми лікування алергологічних захворювань, харчової алергії й атопічного дерматиту зокрема.
Актуальность. По данным European Academy of Allergy and Clinical Immunology, в среднем в европейских странах 17,3 % населения имеют проявления пищевой аллергии в течение жизни. При этом повышенная концентрация специфических IgE к пищевым продуктам определяется у 12,2 % детей и подростков и 4,1 % взрослых. Атопический дерматит — это распространенное хроническое воспалительное заболевание кожи, поражающее до 20 % детей и 10 % взрослых в индустриально развитых странах мира. Целью работы было изучить эффективность пробиотического препарата Лактиале для детей и Лактиале малыш у детей с атопическим дерматитом на фоне пищевой аллергии. Материалы и методы. Под нашим наблюдением находилось 97 детей в возрасте от 6 мес. до 9 лет с диагнозом атопического дерматита и пищевой аллергии. Дети были разделены на 2 группы. Основная группа — 59 детей, получавших пробиотический препарат Лактиале для детей или Лактиале малыш в течение 3 месяцев. Группа контроля — 38 детей, не получавших пробиотический препарат. Им предоставлялись только общие рекомендации. Результаты. Пищевая аллергия и атопический дерматит на сегодня остаются одной из актуальных проблем современной педиатрии, поскольку занимают одну из доминирующих позиций в структуре заболеваний детей раннего возраста. Установлено, что у детей основной группы течение пищевой аллергии и атопического дерматита было тяжелее, симптоматика нарушения общего состояния и показатели копрологического и бактериологического анализов кала были достоверно хуже, чем у детей группы контроля, однако в конце исследования наблюдалась достоверно лучшая положительная динамика именно у детей основной группы, которые дополнительно получали пробиотический препарат Лактиале для детей или Лактиале малыш, что свидетельствует о его эффективности и возможности рекомендовать его включение в схемы лечения аллергических заболеваний, пищевой аллергии и атопического дерматита в частности.
Background. According to the European Academy of Allergy and Clinical Immunology, about 17.3 % of European population has food allergies throughout life. At the same time, an increased concentration of specific immunoglobulins E to food is determined in 12.2 % of children and adolescents and in 4.1 % of adults. Atopic dermatitis is a common chronic inflammatory skin disease affecting up to 20 % of children and 10 % of adults in developed countries. The purpose of our research was to study the efficacy of probiotics Lactiale for children and Lactiale baby in children with atopic dermatitis and food allergy. Materials and methods. We observed 97 children aged from 6 months to 9 years with atopic dermatitis and food allergy. They were divided into 2 groups. The main group consisted of 59 children who received probiotics Lactiale for children or Lactiale baby for 3 months. The control group consisted of 38 children who did not receive probiotic. They were given only general recommendations. Results. Food allergy and atopic dermatitis are one of the actual problems in modern pediatrics, because they occupy one of the dominant positions in the structure of young children diseases. It was found that the food allergy and atopic dermatitis were more severe in children of the main group, the symptoms of the disorder of the general condition and the indicators of scatological and bacteriological feces studies were significantly worse than in the children of the control group. But at the end of the study, there was a significantly better positive dynamics in the group, which additionally received probiotics Lactiale for children or Lactiale baby that testifies to its efficacy and the possibility of recommending its inclusion to the treatment regimens in allergic diseases, food allergies and atopic dermatitis in particular.
харчова алергія; атопічний дерматит; Лактіалє; Лактіалє малюк; діти
пищевая аллергия; атопический дерматит; Лактиале; Лактале малыш; дети
food allergy; atopic dermatitis; Lactiale; Lactiale baby; children
Вступ
Харчова алергія (ХА) — це побічна реакція на їжу, зумовлена імунологічними механізмами, тому цей термін охоплює IgE-опосередковані, не-IgE-опосередковані й змішані (IgE-опосередковані й не-IgE-опосередковані) реакції. Алергічні реакції можуть виникати на будь-які харчові продукти, але найчастіше — на коров’яче молоко, куряче яйце, пшеницю, сою, арахіс, лісові горіхи, рибу й морепродукти [1].
За даними European Academy of Allergy and Clinical Immunology [2], у середньому в європейських країнах 17,3 % населення мають ті чи інші прояви ХА протягом життя. При цьому підвищена концентрація специфічних IgE до харчових продуктів визначається у 12,2 % дітей і підлітків (віком до 18 років) і 4,1 % дорослих [3, 4].
Погіршення якості життя хворого, тісний зв’язок із хронічними хворобами травної системи, ензимопатiями, іншими алергічними й соматичними хворобами, а також розмаїття харчових алергенів і варiантiв алергічної відповіді роблять проблему ХА дуже актуальною [5].
Атопічний дерматит (АД) — це поширене хронічне запальне захворювання шкіри, що вражає до 20 % дітей і 10 % дорослих в індустріально розвинених країнах світу [6]. Поширеність АД зросла протягом останніх 30 років [7]. Підраховано, що 7 % дітей і 2–8 % дорослих з AД мають тяжкий перебіг захворювання [8, 9].
Дебют захворювання найчастіше має місце в ранньому дитячому віці. У дітей АД вперше проявляється до 6 місяців у 45 % випадків, упродовж першого року життя — у 60 %, до 5 років — у 85 % випадків.
АД є однією з атопічних хвороб, до яких також належать алергічний риніт, алергічна бронхіальна астма, алергічний кон’юнктивіт та деякі алергічні захворювання шлунково-кишкового тракту [10].
Епідеміологічні дані наводять на думку, що збільшення захворюваності на алергічну патологію можуть зумовлювати такі фактори, як зміни в кишковій мікрофлорі, зниження частоти інфекцій, що передаються фекально-оральним шляхом, і зменшення вмісту мікроорганізмів у продуктах харчування. Непрямим свідченням на користь цього є факт, що в дітей із атопією мікрофлора кишечника містить більше коліморфних бактерій і клостридій і менше біфідо- і лактобактерій, ніж мікрофлора дітей без атопічних захворювань [11].
Механізм дії пробіотиків інтенсивно вивчається. На сьогодні чітко доведено, що певні пробіотичні штами (Lactobacillus rhamnosus — Lactobacillus GG, Американська колекція типових культур 53103) можуть впливати на імунні функції різними шляхами, включаючи дію на ентероцити, антигенпрезентуючі клітини, локальні дендритні клітини, регуляторні Т-клітини, ефекторні Т- і В-клітини [12]. Науково доведено, що бактерії-коменсали зменшують місцевий запальний процес [13] і здатні сприяти зміцненню кишкового бар’єра [14], потенційно зменшуючи можливість антигенного навантаження. Декілька протизапальних ефектів пробіотиків здійснюються опосередковано через Тоll-подібні рецептори (TLR), включно з TLR9 і, можливо, TLR2, TLR3 і TLR4 ентероцитів [15]. Інтестинальна мікробіота також сприяє продукуванню ентероцитами фактора некрозу пухлини (TNF) бета і простагландину E2, які сприяють розвитку імунологічної толерантності за участю дендритних клітин [16]. У роботах вчених було показано, що вживання пробіотичних бактерій дітьми з атопічними захворюваннями або ХА приводить до зростання рівнів інтерферону гамма (IFN-γ), інтерлейкіну (IL) 5, IL-10, TNF-α. Інші дослідження довели, що пробіотики збільшують активність дендритних клітин, посилюють активність і диференціацію T1-хелперів, збільшують імунорегулюючу активність у травній системі [17], посилюють синтез імунорегуляторних цитокінів (IL-10) [18]. Відомо, що алергічні захворювання частково пов’язані з порушенням Thl/Th2-цитокінового балансу в сторону активації Th2-клітин, що приводить до збільшення Th2-цитокінів, таких як IL-4, IL-5 і IL-13, що, у свою чергу, обумовлює індукцію синтезу IgE та IgA, активацію тучних клітин та еозинофілів, які пов’язані з більшістю алергічних симптомів. Пробіотичні бактерії здатні інгібувати Th2 і активізувати Thl-відповідь, продукцію Thl-цитокінів, таких як IFN-γ, IL-2 і IL-12 [19].
Lactobacillus GG продемонструвала безпечність при застосуванні в ранньому віці й ефективність при лікуванні алергічного запалення і харчової алергії.
Лактіалє — сучасний синбіотик (пробіотик + пребіотик), який містить комплекс семи корисних бактерій — біфідобактерій, лактобактерій і стрептокока, які в нормі присутні в мікрофлорі кишечника здорової людини, і пребіотик — фруктоолігосахариди. Кожен пакетик містить 7 корисних штамів пробіотичних мікроорганізмів: Lactobacillus casei, Lactobacillus rhamnosus, Streptococcus thermophylus, Bifidobacterium breve, Lactobacillus acidophylus, Bifidobacterium longum, Lactobacillus bulgaricus — сумарно 1,00 • 109 КУО на 1 пакет у Лактіалє малюк і 5,00 • 108 КУО на 1 пакет у Лактіалє для дітей, а також фруктоолігосахариди.
Мета роботи: вивчити ефективність пробіотичного препарату Лактіалє малюк і Лактіалє для дітей у дітей віком від 6 місяців до 9 років з атопічним дерматитом на фоні харчової алергії.
Матеріали та методи
Пацієнти. У клінічне дослідження, яке проводилось протягом 2018–2019 рр., було залучено 100 дітей віком від 6 міс. до 9 років з діагнозом атопічного дерматиту на фоні харчової алергії.
Критерії включення в дослідження: вік від 6 місяців до 9 років; діагноз — атопічний дерматит на фоні харчової алергії; доношена дитина (термін гестації — 37–42 тижні); маса при народженні — понад 2500 г; згода батьків на отримання препарату й повторний огляд та обстеження під час і після закінчення терапії.
Критерії виключення із дослідження: непереносимість препаратів або їх компонентів; недотримання протоколу призначеної терапії; наявність тяжких супутніх захворювань, вроджених вад розвитку; гостра кишкова інфекція.
У результаті закінчили дослідження 59 дітей з основної групи і 38 дітей із групи контролю. Причиною вибуття 3 дітей із дослідження було недотримання протоколу дослідження (рис. 1).
Отже, під нашим спостереженням перебувало 97 дітей віком від 6 міс. до 9 років (середній вік — 4,5 ± 2,2 року) з діагнозом харчової алергії та атопічного дерматиту, серед них 36 % хлопчиків і 64 % дівчаток, які лікувалися на базі міської дитячої клінічної лікарні м. Львова.
Діти були розподілені на 2 групи. Основна група — 59 дітей (42 % хлопчиків і 58 % дівчаток, середній вік — 3,62 ± 2,10 року, діти до 2 років — 30,5 %), які отримували пробіотичий препарат. Діти від 6 міс. до 2 років отримували Лактіалє малюк, а діти від 2 років — Лактіалє для дітей протягом 3 місяців по 1 пакетику 1 раз на день (після основного прийому їжі, розчинений у воді). Група контролю — 38 дітей (26 % хлопчиків і 74 % дівчаток, середній вік — 5,9 ± 1,7 року), які не отримували пробіотичний препарат. Усім дітям надавалися рекомендації щодо режиму, дієти, догляду за шкірою та лікування згідно з чинним протоколом. Дітям, у яких виявлено інвазію гельмінтами й найпростішими, додатково проводилась антигельмінтна терапія.
Тяжкість атопічного дерматиту була оцінена за шкалою SCORAD (Scoring of Atopiс Dermatitis), що була запропонована в 1993 р. Європейською робочою групою з АД. Шкала SСORAD передбачає: А — оцінку площі ураження шкірних покривів; В — визначення та оцінку інтенсивності морфологічних елементів висипки — еритеми (гіперемії), набряку/папул, мокнуття/кірок, екскоріації, ліхеніфікації, сухості. Кожний симптом оцінюється від 0 до 3 балів: 0 — відсутність, 1 — легкий, 2 — середній, 3 — тяжкий. Оцінка площі ураження й визначення інтенсивності морфологічних елементів висипки умовно вважаються об’єктивними критеріями шкали SСORAD. С — оцінка суб’єктивних ознак, оцінюються свербіж і порушення сну за 10-бальною шкалою, кожна з ознак за останні 3 доби. Розрахунок величини індексу SСORAD проводиться за формулою:
SСORAD = А/5 + 7 ´ В/2 + С,
де А — площа ураження шкіри у відсотках, В — сума балів оцінки інтенсивності морфологічних елементів дерматиту, С — сума балів суб’єктивних ознак (свербіж + порушення сну).
Стандартизована форма оцінки стану хворого заповнювалась при включенні в дослідження, через 1, 2 і 3 місяці. Усім дітям двічі, на початку дослідження й через 3 місяці, проводилися копрологічне дослідження, посів калу на біоценоз, ультразвукове дослідження внутрішніх органів, оцінка тяжкості атопічного дерматиту за шкалою SCORAD.
Статистичні розрахунки проведені з використанням статистичного пакету прикладних програм Statistica For Windows v.6.0 (StatSoft, USA), електронних таблиць Excel 2009 (Microsoft, USA). При проведенні розрахунків обчислювали відносні (інтенсивні й екстенсивні показники) і середні величини. Першочергово ми оцінювали характер змінних (кількісні, якісні) і нормальність розподілу варіаційного ряду. За умови правильного (гауссівського) розподілу змінних для порівняння двох груп застосовували параметричний метод із дослідженням t-критерію Стьюдента для незалежних вибірок. За умови непараметричного (неправильного) розподілу змінних для порівняння двох груп застосовували метод кутового перетворення Фішера (розрахунок критерію φ). Різницю двох середніх величин вважали вірогідною при значеннях р ≤ 0,05 (вірогідність помилки менше від 5 %), відтак ці дані можна перенести на генеральну сукупність з вірогідністю 95 %.
Результати та обговорення
За даними форм оцінки стану хворого, у дітей обох груп спостерігалася харчова алергія на різні продукти. Так, алергія на молочні продукти мала місце в 83 % дітей основної групи й 79 % дітей групи контролю, на какао (шоколад) — у 25,4 і 18,4 % дітей відповідно, на цитрусові — у 16,9 і 42,1 % дітей відповідно, на малину — у 5,1 і 21,1 % дітей відповідно, на яйця — у 6,8 і 10,5 % дітей відповідно, на пшеницю — у 3,9 і 10,5 % дітей відповідно, на суницю й гречку — у 6,8 % дітей основної групи, на мед — у 5,1 % дітей основної групи, на томати, курятину, арахіс, яблука, вівсянку й моркву — у 3,9 % дітей основної групи, на укуси комах — у 3,9 % дітей основної групи (рис. 2).
Отже, найпоширенішими причинними харчовими алергенами в нашому дослідженні були молочні продукти, какао (шоколад) і цитрусові. Ці результати відповідають наявним міжнародним даним.
У формах оцінки стану хворого відзначали наявність симптомів, які свідчили про ступінь порушення загального стану дитини до початку нашого дослідження, через 1 місяць, через 2 і 3 місяці.
Нами встановлено, що діарейний синдром без температури до початку дослідження спостерігався в 39 % дітей основної групи й 31,6 % дітей групи контролю, на той час як через 3 місяці — лише у 3,4 % дітей основної групи (табл. 1).
Генетичне тестування в анамнезі на визначення лактазної недостатності проводилось у 64,4 % дітей основної групи і 18,5 % дітей групи контролю. Так, генотип С/Т було визначено у 25,4 % дітей основної групи й 8 % дітей групи контролю, а генотип С/С — у 39 і 10,5 % дітей відповідно. Проте цінність цього генетичного дослідження в педіатричній практиці мінімальна.
Було визначено, що запори до початку дослідження спостерігалися в 39 % дітей основної групи й 47,4 % дітей групи контролю, а через 3 місяці — у 3,4 і 10,5 % дітей відповідно (табл. 2).
Синдром кишкових кольок до початку дослідження спостерігався в 42,3 % дітей основної групи й 21 % дітей групи контролю, тоді як через 3 місяці він не спостерігався в жодній групі (табл. 3).
Здуття живота до початку дослідження спостерігалося в 91,6 % дітей основної групи й 50 % дітей групи контролю, а через 3 місяці — у 10,2 % дітей основної групи (табл. 4).
Оскільки діти віком до 2 років належали до основної групи, то синдром зригування зустрічався лише серед них: у 10,2 % дітей на початку дослідження, через місяць — у 6,8 % дітей і не виявлявся взагалі через 2 місяці.
Нудота до початку дослідження спостерігалася у 28,8 % дітей основної групи й 50 % дітей групи контролю, а через 3 місяці — не спостерігалася в жодній групі. Блювання до початку дослідження спостерігалося у 22 % дітей основної групи й 7,9 % дітей групи контролю, а через 3 місяці не спостерігалося в жодній групі (табл. 5).
Поганий сон до початку дослідження спостерігався в 91,6 % дітей основної групи й 68,4 % (р < 0,05) дітей групи контролю, а через 3 місяці — у 37,3 і 39,5 % дітей відповідно. Неспокій до початку дослідження спостерігався в 66,1 % дітей основної групи й 18,4 % дітей групи контролю, а через 3 місяці — у 15,3 і 15,8 % дітей відповідно (табл. 6).
Можна зробити висновок, що після проведеного лікування відсоток дітей із діарейним синдромом без температури, запорами, синдромом кишкових кольок, здуттям живота, нудотою, поганим сном і неспокоєм вірогідно зменшився в обох групах, проте тяжкість прояву деяких симптомів (синдром кишкових кольок, здуття живота, поганий сон і неспокій) була вірогідно вищою в дітей основної групи.
Свербіж шкіри до початку дослідження спостерігався у 81,3 % дітей основної групи й 89,5 % дітей групи контролю, а через 3 місяці — у 15,3 і 39,5 % дітей відповідно. Сухість шкіри до початку дослідження спостерігалася у 96,6 % дітей основної групи та 100 % дітей групи контролю, а через 3 місяці — у 61 і 89,5 % дітей відповідно (табл. 7).
Почервоніння шкіри/висипка спостерігалися до початку дослідження в 93,2 % дітей основної групи й 100 % дітей групи контролю, а через 3 місяці — у 28,8 і 100 % дітей відповідно. Розчоси шкіри спостерігалися до початку дослідження у 40,7 % дітей основної групи й 39,5 % дітей групи контролю, а через 3 місяці — у 13,6 і 21 % (р < 0,05) дітей відповідно (табл. 8).
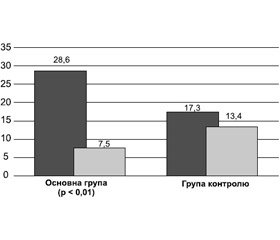
При оцінці тяжкості атопічного дерматиту за шкалою SCORAD на початку дослідження середній бал становив 28,6 ± 10,7 в основній групі й 17,3 ± 4,6 — у групі контролю, а через 3 місяці — 7,50 ± 6,95 і 13,4 ± 4,3 (р < 0,01) відповідно (рис. 3).
На початку дослідження в 5,1 % дітей основної групи було виявлено мокнуття шкіри, але через місяць від початку лікування його вже не спостерігалося.
Вірогідне зменшення відсотка дітей із сухістю й свербежем шкіри, а також з почервонінням/висипкою і розчосами шкіри в основній групі свідчить про ефективність препарату Лактіалє в дітей з атопічною шкірою. Це підтверджується також тим, що в дітей, які отримували зазначений пробіотичний препарат, спостерігалось вірогідне зменшення середнього балу за шкалою SCORAD протягом лікування (28,6 ± 10,7 бала на початку дослідження проти 7,50 ± 6,95 бала в кінці дослідження).
На початку лікування відносно задовільний загальний стан спостерігався в 39 % дітей основної групи й 31,6 % дітей групи контролю, незадовільний — у 61 і 68,4 % відповідно. Через 3 місяці 18,4 % дітей групи контролю (р < 0,05) все ще мали незадовільний стан, на той час як усі діти основної групи мали задовільний загальний стан (р < 0,05).
При об’єктивному обстеженні в 3,4 % дітей основної групи спостерігалося відставання у фізичному й психомоторному розвитку. Оцінка проводилася відповідно до Наказу МОЗ України № 149 «Клінічний протокол медичного догляду за здоровою дитиною віком до 3 років».
На початку нашого дослідження середня маса тіла дітей основної групи становила 16,2 ± 4,9 кг, групи контролю — 20,3 ± 5,8 кг, а через 3 місяці — 16,5 ± 5,0 кг і 20,5 ± 6,1 кг відповідно.
Середній ріст на початку дослідження в дітей основної групи становив 101,7 ± 17,6 см, групи контролю — 121,2 ± 19,7 см, а через 3 місяці — 102,0 ± 17,4 см у дітей основної групи й практично не змінився в дітей групи контролю.
При дослідженні калу на мікробіоценоз на початку нашого дослідження було виявлено патологічні зміни в складі кишкової мікрофлори в значної кількості дітей.
Так, дріжджоподібні гриби роду Candida було виявлено у 64,5 % дітей основної групи та 29 % дітей групи контролю, а через 3 місяці — у 22 % (р < 0,05) і 10,5 % дітей відповідно (табл. 9).
Недостатня кількість Bifidumbacterium (≤ 107 КУО/г) на початку дослідження була виявлена в 45,8 % дітей основної групи й 8 % дітей групи контролю
(р < 0,01), а через 3 місяці — у 15,3 % (р < 0,05) дітей основної групи. Дефіцит Lactobacillus
(≤ 107 КУО/г) був виявлений у 71,2 % дітей основної групи та 8 % дітей групи контролю (р < 0,01), а через 3 місяці — у 22 % (р < 0,05) дітей основної групи. Патогенні мікроорганізми родини кишкових на початку дослідження було виявлено в 45,8 % дітей основної групи й 60,5 % дітей групи контролю, а через 3 місяці — у 6,8 % (р < 0,05) і 42,1 % дітей відповідно (табл. 10).
Отже, у більшості дітей основної групи на початку дослідження основні показники мікробіоценозу випорожнень були вірогідно незадовільними, проте через 3 місяці лікування вони стали вірогідно кращими.
При копрологічному дослідженні калу на початку дослідження патологічні зміни було виявлено в 94,9 % дітей основної групи і 100 % дітей групи контролю. Так, м’язові волокна спостерігалися у випорожненнях 47,4 % дітей основної групи й 49,9 % дітей групи контролю, нейтральний жир — у 56 і 52,6 % дітей відповідно, крохмаль — у 35,6 і 21 % дітей відповідно, слиз — у 13,6 і 10,5 % дітей відповідно, рослинна клітковина — у 20,4 і 28,9 % дітей відповідно, йодофільна флора — у 54,2 і 100 % (р < 0,05) дітей відповідно, жирні кислоти — у 8,5 і 8 % дітей відповідно, яйця аскарид — у 6,8 і 29 % дітей відповідно, цисти лямблій — у 5,1 і 10,5 % дітей відповідно.
Через 3 місяці лікування ми спостерігали позитивну динаміку в показниках повторного копрологічного дослідження. Так, патологічні зміни було виявлено в 45,8 % (р < 0,05) дітей основної групи й 89,4 % дітей групи контролю (табл. 11).
Можна підсумувати, що більшість показників мікробіоценозу й копрологічного дослідження стали вірогідно кращими в дітей основної групи, на той час як у дітей групи контролю спостерігалася лише тенденція до покращення.
При ультразвуковому обстеженні на початку нашого дослідження незначні відхилення від норми (реактивні зміни) у структурі підшлункової залози було виявлено в 55,9 % дітей основної групи й 68,4 % дітей групи контролю, а через 3 місяці — у 13,6 % (р < 0,05) і 21 % (р < 0,05) дітей відповідно.
Висновки
Атопічний дерматит на фоні харчової алергії залишається однією з актуальних проблем сучасної педіатрії, оскільки має доволі тяжкий перебіг, порушує якість життя дітей і їх родин, посідає одну з домінуючих позицій у структурі захворювань дітей раннього віку.
Лікування дітей з атопічним дерматитом на фоні харчової алергії є доволі складним завданням, що вимагає ретельної оцінки стану дитини, алерготестування, вивчення копрологічних і бактеріологічних особливостей випорожнень. Тривале застосування (протягом 3 місяців) пробіотичного препарату Лактіалє для дітей/Лактіалє малюк (відповідно до віку дітей) по 1 пакетику 1 раз на день істотно покращує ефективність комплексної терапії атопічного дерматиту на фоні харчової алергії, що супроводжується вірогідно кращою динамікою загального стану, істотним покращенням оцінки тяжкості атопічного дерматиту за шкалою SCORAD, моторної функції кишок, зменшенням функціональних розладів травної системи, зменшенням свербежу, почервоніння й сухості шкіри, покращенням мікробіоценозу кишок і копрологічних показників, що свідчить про його ефективність і доцільність включення у схеми лікування атопічного дерматиту на фоні харчової алергії.
У нашому дослідженні ми не визначили ознак непереносимості чи побічних дій цього пробіотичного препарату.
Конфлікт інтересів. Не заявлений.
1. Черниш Ю.Р., Охотнікова О.М. Сучасні особливості ведення дітей із гастроінтестинальною формою харчової алергії. Здоровье ребенка. 2018. Т. 13. № 2. С. 215-223.
2. Muraro A., Roberts G., Worm M. et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy. 2014. Vol. 69. № 8. P. 1026-1045.
3. Охотнікова О.М., Черниш Ю.Р. Фактори ризику розвитку і патогенез гастроінтестинальної харчової алергії в дітей. Здоровье ребенка. 2016. № 8. С. 87-93.
4. Nwaru B.I., Hickstein L., Panesar S.S. et al. The epidemiology of food allergy in Europe: a systematic review and meta-analysis. Allergy. 2014. Vol. 69. № 1. P. 62-75.
5. Охотнікова О.М., Гладуш Ю.І., Бондаренко Л.В. та ін. Гастроінтестинальна форма харчової алергії у дітей — актуальна проблема сучасності. Здоровье ребенка. 2015. № 3. С. 20-26.
6. Flohr C., Mann J. New insights into the epidemiology of childhood atopic dermatitis. Allergy. 2014 Jan. 69(1). 3-16. doi: 10.1111/all.12270.
4. Kapur S., Watson W., Carr S. Atopic dermatitis. Allergy Asthma Clin. Immunol. 2018 Sep 12. 14(Suppl 2). 52. doi: 10.1186/s13223-018-0281-6.
7. Silverberg J.I., Simpson E.L. Associations of childhood eczema severity: a US population-based study. Dermatitis. 2014 May-Jun. 25(3). 107-14. doi: 10.1097/DER.0000000000000034.
8. Barbarot S., Auziere S., Gadkari A. et al. Epidemiology of atopic dermatitis in adults: Results from an international survey. Allergy. 2018 Jun. 73(6). 1284-1293. doi: 10.1111/all.13401.
9. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги. Атопічний дерматит: Наказ Міністерства охорони здоров’я України від 04.07.2016 № 670.
10. Viljanen M., Savilahti E., Haahtela T. et al. Пробіотики у лікуванні синдрому атопічної екземи/дерматиту в немовлят: подвійне сліпе плацебоконтрольоване дослідження. Современная педиатрия. 2015. № 8. С. 14-21.
11. Prescott S.L., Dunstan J.A., Hale J. et al. Clinical effects of probiotics are associated with increased interferongamma responses in very young children with atopic dermatitis. Clin. Exp. Allergy. 2005. Vol. 35. P. 1557-1564.
12. Kelly D., Campbell J.I., King T.P. et al. Commensal anaerobic gut bacteria attenuate inflammation by regulating nuclear-cytoplasmic shuttling of PPAR-gamma and RelA. Nat. Immunol. 2004. Vol. 5. P. 104-112.
13. Rosenfeldt V., Benfeldt E., Valerius N.H. et al. Effect of probiotics on gastrointestinal symptoms and small intestinal permeability in children with atopic dermatitis. J. Pediatr. 2004. Vol. 145. Р. 612-616.
14. Rachmilewitz D., Katakura K., Karmeli F. et al. Toll-like receptor 9 signaling mediates the anti-inflammatory effects of probiotics in murine experimental colitis. Gastroenterology. 2004. Vol. 126. P. 520-528.
15. Newberry R.D., McDonough J.S., Stenson W.F. Spontaneous and continuous cyclooxygenase-2-dependent prostaglandin E2 production by stromal cells in the murine small intestine lamina propria: directing the tone of the intestinal immune response. J. Immunol. 2001. Vol. 166.
Р. 4465-4472.
16. Veckman V., Miettinen М., Pirhonen J. et al. Streptococcus pyogenes and Lactobacillus rhamnosus differentially induce maturation and production of Th1-type cytokines and chemokines in human monocyte-derived dendritic cells. J. Leukoc. Biol. 2004. Vol. 75. P. 764-771.
17. Lammers K.M., Brigidi P., Vitali B. et al. Immunomodulatory effects of probiotic bacteria DNA: IL-1 and IL-10 response in human peripheral blood mononuclear cell. FEMS Immunol. Med. Microbiol. 2003. Vol. 38. P. 165-172.
18. Probiotics in Treatment and/or Prevention of Allergies. Nutrition and Health: Probiotics in Pediatric Medicine. Edited by: S. Michail, P.M. Sherman. Humana Press. P. 243-261.

/49-1.jpg)
/50-1.jpg)
/50-2.jpg)
/51-1.jpg)
/52-1.jpg)
/53-1.jpg)
/53-2.jpg)
/54-1.jpg)