Журнал "Гастроэнтерология" Том 53, №4, 2019
Вернуться к номеру
Ефективність рифаксиміну в корекції синдрому надлишкового бактеріального росту при хронічних запальних та функціональних захворюваннях кишечника
Авторы: Степанов Ю.М., Федорова Н.С., Зигало Е.В.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Актуальність. Стаття присвячена проблемі виникнення синдрому надлишкового бактеріального росту (СНБР) при хронічних запальних захворюваннях кишечника (ХЗЗК) і синдромі подразненого кишечника (СПК) та шляхам його корекції. Мета: визначити частоту виникнення СНБР при хворобі Крона (ХК), неспецифічному виразковому коліті (НВК) та СПК з діареєю та оцінити ефективність рифаксиміну в корекції мікрофлори тонкої кишки хворих із цими нозологіями. Матеріали та методи. Проведено обстеження 62 хворих на ХЗЗК та СПК (27 — із НВК, 13 — із ХК та 22 — із СПК) на наявність СНБР шляхом виконання дихального водневого тесту (ВДТ) із навантаженням глюкозою. Усі хворі групи дослідження із наявністю СНБР у складі комплексної терапії отримували рифаксимін (Альфа Нормікс) у дозі 1200 мг на добу впродовж 10 днів. Ефективність терапії визначалася за динамікою показників ВДТ на 10 та 30 день спостереження. Результати. СНБР відзначений у 39 пацієнтів загальної групи, із них 24 (61,5 %) хворі мали ХЗЗК, СПК з діареєю — 15 осіб (38,5 %). У групі хворих на ХЗЗК із СНБР переважали пацієнти з НВК (15 осіб; 62,5 %) порівняно з ХК (9 осіб; 37,5 %). ВДТ, проведений через 10 днів від початку лікування рифаксиміном у 24 хворих на ХЗЗК та 15 хворих на СПК із наявністю СНБР, був негативним у 28 осіб (70,9 %), позитивним — в 11 (29,1 %). Подібний результат відзначений і через 30 днів. Тобто СНБР був усунутий у 70,9 % хворих після прийому рифаксиміну. Висновки. У більшості пацієнтів групи дослідження (у 60 % — із ХЗЗК та 68,1 % — із СПК із діареєю) був СНБР. Кишковий антисептик рифаксимін продемонстрував високу ефективність у корекції СНБР при НВК, ХК та СПК.
Актуальность. Статья посвящена проблеме возникновения синдрома избыточного бактериального роста (СИБР) при хронических воспалительных заболеваниях кишечника (ХВЗК) и синдроме раздраженного кишечника (СРК) и путям его коррекции. Цель: определить частоту возникновения СИБР при болезни Крона (БК), неспецифическом язвенном колите (НЯК) и СРК с диареей и оценить эффективность рифаксимина в коррекции микрофлоры тонкой кишки у больных с данными нозологиями. Материалы и методы. Проведено обследование 62 больных ХВЗК и СРК (27 — с НЯК, 13 — с БК и 22 — с СРК) на наличие СИБР путем выполнения дыхательного водородного теста (ВДТ) с нагрузкой глюкозой. Все больные группы исследования с наличием СИБР в составе комплексной терапии принимали рифаксимин (Альфа Нормикс) в дозе 1200 мг в сутки в течение 10 дней. Эффективность терапии определялась по динамике показателей ВДТ на 10 и 30 день наблюдения. Результаты. СИБР отмечался у 39 пациентов общей группы, из них 24 (61,5 %) человека страдали ХВЗК, СРК с диареей — 15 человек (38,5 %). В группе больных ХВЗК с СИБР преобладали пациенты с НЯК (15 человек; 62,5 %) по сравнению с БК (9 человек; 37,5 %). ВДТ, проведенный через 10 дней от начала лечения рифаксимином у 24 больных ХВЗК и 15 больных СРК с наличием СИБР, был отрицательным у 28 человек (70,9 %), положительным — у 11 (29,1 %). Подобный результат отмечен через 30 дней. СИБР был устранен у 70,9 % больных на фоне приема рифаксимина. Выводы. У большинства пациентов группы исследования (у 60 % — с ХВЗК и 68,1% — с СРК с диареей) был СИБР. Кишечный антисептик рифаксимин продемонстрировал высокую эффективность в коррекции СИБР при НЯК, БК и СРК.
Background. The article deals with the problem of small intestinal bacterial overgrowth (SIBO) syndrome in patients with chronic inflammatory bowel diseases (IBD) and irritable bowel syndrome (IBS), and ways to correct it. The purpose was to determine the incidence of SIBO in Crohn’s disease (CD), ulcerative colitis (UC) and IBS with diarrhea and to evaluate the efficiency of rifaximin in the correction of small intestinal microflora in patients with these pathologies. Materials and methods. A study was conducted in 62 patients with chronic IBD and IBS (27 — with UC, 13 — with CD and 22 — with IBS) to detect the presence of SIBO by performing a hydrogen breath test (HBT) with glucose loading. All patients of the study group with SIBO received Alfa Normix at a dose of 1200 mg per day for 10 days as a part of comprehensive therapy. The efficiency of therapy was determined by the dynamics of HBT on day 10 and 30 of observation. Results. SIBO was detected in 39 patients of the general group, of them 24 (61.5 %) patients suffered from chronic IBD, 15 (38.5 %) people had IBS with diarrhea. Patients with UC (15 persons; 62.5 %) were predominant in the group of chronic IBD with SIBO, compared to those with CD (9 persons; 37.5 %). HBT performed 10 days after the start of rifaximin treatment (Alfa Normix) in 24 patients with chronic IBD and 15 persons with IBS with the presence of SIBO was negative in 28 (70.9 %) and remained positive in 11 people (29.1 %). The same result was noted after 30 days: HBT was negative in 26 (66.7 %) patients, and positive — in 13 (33.3 %). So, the elimination of SIBO was achieved in 70.9 % of patients when using Alfa Normix. Conclusions. Most patients in the study group (60 % with chronic IBD and 68.1 % with IBS with diarrhea) had SIBO. The intestinal antiseptic rifaximin (Alfa Normix) has been shown to be highly effective in correcting SIBO in UC, CD and IBS.
неспецифічний виразковий коліт; хвороба Крона; синдром подразненого кишечника; синдром надлишкового бактеріального росту; рифаксимін
неспецифический язвенный колит; болезнь Крона; синдром раздраженного кишечника; синдром избыточного бактериального роста; рифаксимин
ulcerative colitis; Crohn’s disease; irritable bowel syndrome; small intestinal bacterial overgrowth syndrome; rifaximin
Вступ
У даний час однією з поширених причин направлення хворих у гастроентерологічний стаціонар є хронічні запальні захворювання кишечника (ХЗЗК), основними структурними одиницями яких є хвороба Крона (ХК) та неспецифічний виразковий коліт (НВК). У світі на ХЗЗК хворіють близько п’яти мільйонів осіб, у Європі — 2,2 мільйона [1].
Незважаючи на багаторічну історію вивчення ХЗЗК, їх етіологія залишається невідомою, а патогенез розкритий недостатньо. До цього часу залишається відкритим питання про вплив змін мікрофлори кишечника на розвиток і прогресування запального процесу при НВК і ХК. Процеси, що відбуваються в результаті порушення мікробіоценозу кишечника, можуть прямо або опосередковано впливати на моторику кишечника, змінювати характер метаболічних процесів у його просвіті, сприяючи розвитку імунного запалення в слизовій оболонці, що може лежати в основі патогенезу багатьох хронічних захворювань кишечника [2]. Тому в останні роки змінам стану кишкової мікрофлори при ХЗЗК приділяється велика увага.
У пацієнтів із виразковим колітом спостерігається зниження числа Faecalibacterium, значуще переважання Proteobacteria і надлишкова контамінація товстої кишки видом Fusobacterium varium, а також Escherichia сoli. У пацієнтів з ілеоцекальною локалізацією хвороби Крона недостатньо представлені такі підвиди, як Faecalibacterium і Roseburia, при цьому зростає кількість Enterobacter, зокрема кишкової палички і штамів Ruminococcus gnavus. Помічено, що пацієнти з виразковим колітом і хворобою Крона уразливі до інфекції, асоційованої з Clostridium difficile, і її виникнення у хворих із ХЗЗК ускладнює перебіг захворювання, що в подальшому вимагає госпіталізації і призводить до підвищення летальності. За результатами обстеження пацієнтів із ХЗЗК було виявлено, що у 28 % хворих за рік спостереження хоча б один раз виявляли ознаки кишкової інфекції, викликаної С.difficile [3].
Другою медико-соціальною проблемою, враховуючи значну поширеність та частоту звернень до лікарів сімейної медицини та гастроентерологів, вважаються функціональні захворювання кишечника, зокрема синдром подразненого кишечника (СПК). Результати різних досліджень вказують на наявність якісних змін мікробіоти у хворих із СПК. Найбільш характерним є зменшення колоній біфідобактерій.
Кожне з цих захворювань суттєво знижує якість життя пацієнтів унаслідок численних патологічних синдромів, які характеризують ХЗЗК та СПК. Одним із них є синдром надлишкового бактеріального росту (СНБР). Існують дані, що клінічні прояви синдрому подразненого кишечника перекликаються з симптомами СНБР, тому була висунута гіпотеза, що при СПК у багатьох пацієнтів існує коморбідність із СНБР [4].
СНБР — виявлення понад 105 КУО в 1 мл аспірату з тонкої кишки за рахунок умовно-патогенної флори, що надходить із верхніх відділів ШКТ, і/або поява флори, характерної для товстої кишки [5, 6]. З огляду на це СНБР можна вважати дисбіозом тонкого кишечника.
Розвиток СНБР відбувається під впливом численних ендо- й екзогенних несприятливих факторів: прийому антибіотиків, хіміопрепаратів, послаблюючих, стероїдів, психотропних препаратів, екологічних порушень, промислових ядів, стресів. Також майже всі хронічні захворювання ШКТ можуть призвести до розвитку СНБР як результат послаблення захисних антимікробних механізмів слизових оболонок [2].
Існує декілька патологічних механізмів розвитку СНБР. Перший обумовлений зниженням умісту соляної кислоти в шлунку, що виконує функції захисного бар’єра на шляху проникнення мікрофлори з ротової порожнини. Стан гіпо- та ахлоргідрії може розвиватися внаслідок прийому інгібіторів шлункової секреції, на фоні атрофії слизової оболонки шлунка або після його резекції. Таким чином, цей стан спричинює колонізацію шлунка та тонкого кишечника мікробами з ротової порожнини. Другий механізм розвитку СНБР обумовлений послабленням здатності тонкої кишки елімінувати патогенні та умовно-патогенні мікроорганізми, що потрапляють до неї. Цей процес відбувається при зниженні активності захисних механізмів, що підтримують баланс мікробіоти тонкої кишки, зниженні синтезу секреторного імуноглобуліну А, послабленні фагоцитарної активності макрофагів слизової оболонки тонкої кишки [2, 7].
Наступний механізм виникнення СНБР пов’язаний із ретроградним поширенням мікрофлори товстої кишки в тонку внаслідок недостатності ілеоцекального клапана при запаленні або порушеннях моторики товстої кишки, що спостерігається при СПК, хронічній інтестинальній псевдообструкції, целіакії, неспецифічному виразковому коліті, хворобі Крона, склеродермії (рис. 1).
СНБР має декілька ступенів вираженості:
— I — збільшення аеробної нормальної кишкової мікрофлори (> 105–106 КУО/мл);
— ІІ — збільшення аеробної нормальної кишкової мікрофлори і поява анаеробних бактерій (> 106–107 КУО/мл);
— ІІІ — переважання анаеробної флори (обсіменіння на рівні 109 КУО/мл і більше).
За результатами численних досліджень було показано, що основними клінічними проявами СНБР вважаються діарея (осмотична або секреторна), метеоризм, абдомінальний біль або дискомфорт, стеаторея та поліфекалія, дефіцит вітамінів, (особливо вітаміну В12), зниження маси тіла. Як видно, усі вказані симптоми не є специфічними, пов’язати їх із СНБР не є можливим [5, 8].
Діагностика СНБР — достатньо складне завдання. Фізикальні дані при СНБР неспецифічні. Ретельніше дослідження може виявити латентну тетанію, полінейропатію і шкірні прояви (розацеа). У крові відзначаються анемія, зниження сироваткового рівня вітаміну В12, а також ознаки мальнутриції (лімфопенія, зниження рівнів сироваткового преальбуміну і трансферину). Тому більш інформативними вважаються додаткові методи діагностики СНБР, що були розподілені на дві групи: прямі та непрямі.
Одним із найбільш високоінформативних методів діагностики СНБР, що відносять до прямих методів, вважається бактеріологічне дослідження аспірату з тонкої кишки. Але незважаючи на діагностичну цінність, він має багато недоліків. Передусім це інвазивність, адже забір аспірату виконують за допомогою спеціального зонда або ентероскопії. Кількість рідини, місце забору (зазвичай над зв’язкою Трейтца) і технічні деталі мікробіологічних тестів досі не стандартизовані. Усе це робить цей метод трудомістким і дорогим. Також невирішеним залишається питання щодо діагностичної точності цього методу у випадку дистального СНБР, переважно в клубовій кишці, який не може бути встановлений за допомогою традиційної ентероскопії [5, 9].
Крім посіву мікрофлори тонкої кишки для установлення СНБР застосовуються інші методи, засновані на вивченні концентрації індикану, що виділяється індолпозитивними мікроорганізмами, фенолу і паракрезолу, які є метаболітами аеробної й анаеробної флори. Існує спосіб діагностики стану мікробіоценозу різних біотопів, у тому числі кишечника, заснований на визначенні коротколанцюгових жирних кислот та некон’югованих жовчних кислот у тонкокишковому аспіраті (вони є метаболітами в основному анаеробних видів мікроорганізмів), а також методом газорідинного хроматографічного аналізу [7, 10]. Однак жоден тест поки не впроваджений у рутинну клінічну практику.
Тому на даний момент перевагу віддають непрямим методам діагностики СНБР, в основі яких лежить визначення концентрації водню в повітрі, що видихується. У цю групу входять водневий дихальний тест із глюкозою та лактулозою, 13С-глікохолатний дихальний тест, 14С- і 13С-D-ксилозний дихальні тести [9].
Зважаючи на труднощі, пов’язані з отриманням умісту тонкої кишки, найбільш поширений простий, зручний, економічно привабливий, неінвазивний метод визначення концентрації водню у видихуваному повітрі після вуглеводного навантаження глюкозою або лактулозою — водневий дихальний тест (ВДТ), який вважається золотим стандартом діагностики СНБР при ХЗЗК. Метод заснований на тому, що при СНБР рівень водню у видихуваному повітрі суттєво збільшується за рахунок створення мікробних метаболітів у тонкому кишечнику [10, 11].
Лікування пацієнтів з СНБР є теж складною та актуальною проблемою сучасної гастроентерології й залежить від його клінічних проявів та ступеня вираженості. Існуючі сьогодні стандарти лікування захворювання передбачають необхідність проведення селективної деконтамінації перед призначенням пре- та пробіотиків. Для деконтамінації тонкого кишечника використовують такі групи препаратів: антибактеріальні препарати, непатогенні гриби, спороутворюючі препарати на основі представників транзиторної флори. Але основою лікування СНБР є антибіотикотерапія.
Основні вимоги, які пред’являються сучасним антибактеріальним препаратам, — це висока ефективність, безпечність для нормальної облігатної мікрофлори, наявність вибіркового ефекту, мінімум побічних несприятливих впливів, мінімальна кратність прийому та високі концентрації у просвіті кишечника [6].
Деякі зарубіжні автори виступають за емпіричне лікування пацієнтів, у яких підозрюють СНБР, без діагностичного тестування. Однак такий підхід є проблематичним у зв’язку з частим ефектом плацебо, високою вартістю антибіотиків, потенційними ускладненнями (наприклад, лікарські взаємодії, побічні ефекти), а також необхідністю проведення, як правило, повторного курсу терапії антибіотиками. Дослідження вчених показали, що середня тривалість клінічного поліпшення при емпіричному лікуванні — тільки 22 дні, а така тактика лікування призводить до необхідності щонайменше 12 семиденних курсів антибіотикотерапії на рік, щоб полегшити стан хворих із СНБР [8].
В ідеалі антибіотики, які призначаються при СНБР, повинні селективно діяти на бактеріальні популяції, що спричинили СНБР. Однак на практиці це складно здійснити через те, що при СНБР можуть мати місце різні бактерії з різною чутливістю до антибіотиків. Питання щодо виду антибіотика, дозування і тривалості терапії залишаються відкритими. Зазвичай призначення антибіотиків широкого спектра дії намагаються уникати, оскільки така терапія пов’язана з низкою ускладнень (діарея, експансія Clostridium difficile, підвищення стійкості до антибіотиків та ін.).
Тому одним із перспективних та високоефективних кишкових антисептиків, що відповідає зазначеним вимогам та може використовуватися емпірично, вважається рифаксимін. Рифаксимін має протимікробну активність щодо широкого спектра мікроорганізмів, включаючи грампозитивні (Enterococcus spp., Mycobacterium tuberculosis, Streptococcus pyogenes, Streptococcus faecalis, Streptococcus pneumoniaе, Staphylococcus aureus, Staphylococcus epidermalis), грамнегативні (Escherichia coli, Shigella spp., Salmonella spp., Yersinia enterocolitica, Proteus spp., Peptococcus spp., Vibrio cholera), аеробні та анаеробні (Clostridium perfrigens, Clostridium difficile, Peptococcus spp., Helicobacter pylori) бактерії, що викликають шлунково-кишкові інфекції. В основі механізму протимікробної активності лежить інгібування синтезу бактеріальної РНК шляхом зв’язування з бета-субодиницею бактеріальної ДНК-залежної РНК-полімерази і, таким чином, пригнічення синтезу РНК і білків бактерій [12].
Важливою перевагою рифаксиміну є те, що препарат не метаболізується в печінці, тому при його застосуванні система цитохрому P450 не задіяна і будь-яких клінічно значущих взаємодій з іншими препаратами не встановлено. Рифаксимін добре переноситься та не викликає бактеріальної резистентності.
При підтведженому за допомогою водневого тесту СНБР рифаксимін використовується у дозі 400 мг тричі на добу протягом 10 днів. При цьому рівень водню в повітрі, що видихується, зменшується в 3–5 разів уже на третій день лікування, що свідчить про швидку санацію тонкого кишечника [10, 12].
Рифаксимін практично не абсорбується, тому однією з його переваг вважається відсутність необхідності коректувати дозу при печінковій дисфункції. У пацієнтів із печінковою дисфункцією та печінковою енцефалопатією, які отримували рифаксимін у дозі 800 мг тричі на день, менше ніж 0,1 % рифаксиміну було абсорбовано із ШКТ [11, 12].
Існує стурбованість щодо того, що може розвиватись резистентність до рифаксиміну. Але високі концентрації препарату у фекаліях та відсутність системної абсорбції є вагомими доказами того, що розвиток резистентності до цього препарату малоймовірний.
Незважаючи на високі концентрації рифаксиміну у фекаліях, цей препарат майже не впливає на нормальну мікрофлору кишечника. Навпаки, у дослідженнях доведено, що рифаксимін здатний збільшувати вміст корисних кишкових бактерій, зберігаючи при цьому незмінним загальний склад мікрофлори кишечника. Такий своєрідний ефект рифаксиміну пов’язаний із одним із найпоширеніших наслідків антибіотикотерапії — розвитком стійкості мікроорганізмів. Було показано, що у представників родів Bifidobacterium та Lactobacillus після впливу рифаксиміну можливий розвиток стійкості до препарату, що дозволяє їм рости при високих концентраціях рифаксиміну. Саме завдяки цьому ефекту рифаксимін вважають еубіотиком, що модифікує кишкову мікробіоту [15].
Таким чином, вищенаведене свідчить про актуальність даної проблеми та наявність значної кількості невирішених та суперечливих питань.
Мета: проаналізувати частоту виникнення СНБР при ХК, НВК та СПК із діареєю та оцінити ефективність рифаксиміну в корекції стану мікрофлори тонкої кишки хворих із ХК, НВК та СПК.
Матеріали та методи
У дослідження були залучені пацієнти, яким протягом останніх трьох років була проведена колоноскопія з подальшим гістологічним дослідженням. Діагнози НВК, ХК та СПК базувалися на ендоскопічному та гістологічному обстеженнях, для встановлення функціональної патології кишечника використовували Римські критерії ІV. Для діагностики СНБР виконували ВДТ з глюкозою з використанням газоаналізатора Gastro+ Gastrolyzer (Bedfont Scientific Ltd, Великобританія).
Обстежені 62 хворі на ХЗЗК та СПК віком від 19 до 59 років, у середньому (37,85 ± 1,80) року. З усіх хворих у 27 був установлений діагноз НВК, у 13 — ХК, 22 пацієнти мали СПК. У 18 випадках при НВК та 8 випадках при ХК спостерігався перебіг захворювання середнього ступеня тяжкості, у решти 9 хворих на НВК та 5 хворих на ХК — тяжкий перебіг. Серед обстежених хворих було 38 жінок (61,3 %) та 24 чоловіки (38,7 %). Основними симптомами у хворих були метеоризм, абдомінальний біль або дискомфорт, діарея, слабкість та втрата ваги.
Із метою визначення наявності СНБР у досліджених хворих із ХК, НВК та СПК було виконано ВДТ із навантаженням глюкозою.
Результати та обговорення
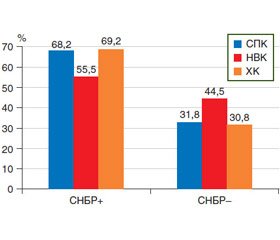
Аналіз частоти виявлення СНБР показав, що зміни у стані мікрофлори тонкої кишки були в 39 пацієнтів із загальної групи, із них 24 (61,5 %) хворі мали ХЗЗК, СПК із діареєю — 15 осіб (38,5 %). У групі хворих на ХЗЗК із СНБР переважали пацієнти з НВК (15 осіб; 62,5 %) порівняно з ХК (9 пацієнтів; 37,5 %). Частота наявності СНБР при кожній нозології представлена на рис. 2.
Середній рівень виділення водню в загальній групі становив (24,3 ± 3,1) ppm, що перевищувало нормальний поріг та свідчило про наявність СНБР. При проведенні порівняльного аналізу між нозологіями цей показник був вірогідно більшим у хворих на НВК ((30,8 ± 3,1) ppm) порівняно з ХК ((18,0 ± 2,6) ppm, р < 0,05). Середні рівні виділення водню у групі СПК ((24,0 ± 3,6) ppm) та у групі ХЗЗК ((24,4 ± 2,9) ppm) суттєво не відрізнялися.
Отже, більшій частині хворих на ХЗЗК та СПК притаманні порушення у складі мікробіоценозу тонкої кишки у вигляді СНБР.
Усім хворим групи дослідження з наявністю СНБР у складі комплексної терапії призначали рифаксимін (Альфа Нормікс) у дозі 1200 мг на добу впродовж 10 днів. Ефективність терапії визначалася за динамікою показників ВДТ на 10 та 30 день спостереження (табл. 2).
При аналізі клінічних симптомів після закінчення лікування відзначався позитивний клінічний ефект: у більшості хворих купірувався абдомінальний біль, зникли симптоми метеоризму та зменшилася частота випорожнень.
Середній рівень виділення водню у хворих на СПК становив (13,7 ± 2,4) ppm, що дещо перевищувало нормальний поріг та свідчило про невагоме порушення мікробіоти в тонкому кишечнику на відміну від груп хворих на НВК та ХК, у яких на 10 день лікування відзначалися підвищені значення показників ВДТ, але вірогідно нижчі, ніж до лікування (р < 0,05). На 30 добу після проведеного лікування позитивна динаміка спостерігалась у всіх досліджених хворих (р < 0,01).
ВДТ, проведений через 10 днів від початку лікування у 24 хворих на ХЗЗК та 15 хворих на СПК із наявністю СНБР, був негативним у 28 осіб (70,9 %), позитивним — в 11 (29,1 %). Аналогічний результат відзначався і через 30 днів. Таким чином, усунення СНБР було досягнуто в 70,9 % хворих після прийому Альфа Норміксу. Середній базальний рівень водню у повітрі, що видихається пацієнтами, до лікування становив 11,8 ppm, рівень через 30 хвилин — 28,9 ppm, через 60 — 43,6 ppm, тобто максимальний приріст — 31,8 ppm. Через 10 днів від початку лікування базальний рівень був 9,5 ppm, рівень через 30 хвилин — 22,3 ppm, через 60 — 28,7 ppm, максимальний приріст — 19,2 ppm. Через 30 днів після лікування базальний рівень становив 7,8 ppm, через 30 хвилин — 18,2 ppm, через 60 — 26,7 ppm, максимальний приріст — 18,9 ppm (рис. 3)
Таким чином, відмічалося зниження показників ВДТ порівняно із підвищеними показниками ВДТ до лікування на 30 та 60 хвилинах дослідження (р < 0,05).
Висновки
1. Перебіг хронічних запальних захворювань кишечника та синдрому подразненого кишечника супроводжується високою частотою розвитку синдрому надлишкового бактеріального росту, що досягала в пацієнтів із хворобою Крона 69,2 %, із неспецифічним виразковим колітом — 55,5 %, у хворих із синдромом подразненого кишечника — 68,2%.
2. У вказаних групах хворих на фоні терапії рифаксиміном у дозі 1200 мг/добу відзначалася позитивна динаміка, що проявлялася вірогідним зниженням показників водневого дихального тесту (p < 0,01) незалежно від нозологічних форм захворювання. При цьому в 70,9 % обстежених хворих прояви синдрому надлишкового бактеріального росту були відсутні вже через 10 днів від початку лікування. Цей ефект зберігався в різній інтенсивності вираженості синдрому надлишкового бактеріального росту аж до 30 дня спостереження від початку лікування. Загалом усунення синдрому надлишкового бактеріального росту було досягнуто в 70,9 % хворих після прийому рифаксиміну.
3. Рифаксимін (Альфа Нормікс) демонструє достатньо високу ефективність при лікуванні синдрому надлишкового бактеріального росту у хворих із синдромом подразненого кишечника і хронічними запальними захворюваннями кишечника, що дозволяє рекомендувати його використання в комплексній терапії синдрому надлишкового бактеріального росту.
Конфлікт інтересів. Не заявлений.
1. Safarpour A.R. et al. Epidemiology of Inflammatory Bowel Diseases in Iran and Asia. Iran J. Med. Sci. 2013. № 38. Р. 140-149.
2. Bures J. et al. Small intestinal bacterial overgrowth syndrome. World J. Gastroenterol. 2010 Jun 28. Vol. 16(24). P. 2978-2990. doi: 10.3748/wjg.v16.i24.2978.
3. Gatta L., Scarpignato C. Systematic review with meta-analysis: rifaximin is effective and safe for the treatment of small intestine bacterial overgrowth. Alimentary Pharmacology and Therapeutics. 2017. Vol. 45. Р. 604-616.
4. Colombel J.-F., Shin A., Gibson P.R. AGA Clinical Practice Update on Functional Gastrointestinal Symptoms in Patients With Inflammatory Bowel Disease: Expert Review Arch. Clinical Gastroenterology and Hepatology. 2019. Vol. 17. Р. 380-390.
5. Передерий В.Г. и др. Синдром избыточного бактериального роста: от микробиологии до лечения. Сучасна гастроентерологія. 2011. № 1(57). С. 124-129.
6. Edward J.K., Stephanie L.H. Small Intestinal Bacterial Overgrowth: A Primary Care Review. Mayo Clin. Proc. 2016. № 91(12). P. 1828-1833. doi: 10.1016/j.mayocp.2016.07.025.
7. Свінціцький А.С. та ін. Роль синдрому надмірного бактеріального росту в розвитку та прогресуванні неалкогольної жирової хвороби печінки. Практикуючий лікар. 2014. № 3. С. 83-85.
8. Звягинцева Т.Д., Черонаба А.И. Синдром избыточного бактериального роста: современные подходы к лечению. Семейная медицина. 2013. № 4(48). С. 31-38.
9. Плотникова Е.Ю. и др. Дыхательные водородные тесты в диагностике синдрома избыточного бактериального роста. Дигностика заболеваний желудочно-кишечного тракта по выдыхаемому воздуху: сб. научных статей. СПб., 2012. С. 64-70.
10. Передерий В.Г. и др. Клиническое применение водородных дыхательных тестов в гастроэнтерологии. Сучасна гастроентерологія. 2010. № 4(54). С. 26-33.
11. Pimentel M. Review article: potential mechanisms of action of rifaximin in the management of irritable bowel syndrome with diarrhea. Alimentary Pharmacology and Therapeutics. 2016. Vol. 43 (Suppl. 1). Р. 37-49.
12. Hoonmo L. Koo et al. The role of rifaximin in the treatment and chemoprophylaxis of travelers’ diarrhea. Therapeutics and Clinical Risk Management. 2009. Vol. 5. P. 841-848.
13. Ткач С.М. и др. Эффективность рифаксимина при синдроме избыточного бактериального роста. Сучасна гастроентерологія. 2015. № 1(81). С. 23-29.
14. DuPont H.L. Review article: the antimicrobial effects of rifaximin on the gut microbiota. Alimentary Pharmacology and Therapeutics. 2016. Vol. 43 (Suppl. 1). Р. 3-10.
15. Ponziani F.R., Zocco M.A., D’Aversa F., Pompili M., Gasbarrini A. Eubiotic properties of rifaximin: Disruption of the traditional concepts in gut microbiota modulation. World J. Gastroenterol. 2017 July 7. Vol. 23(25). Р. 4491-4499. doi: 10.3748/wjg.v23.i25.4491.

/50-1.jpg)
/52-2.jpg)
/52-1.jpg)
/53-1.jpg)
/53-2.jpg)