Газета «Новости медицины и фармации» №12 (700), 2019
Вернуться к номеру
Ефективність застосування препарату Німедар не поступається ефективності застосування препарату Німесил в ортопедичній практиці (проспективне дослідження)
Авторы: Зазірний І.М.
Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Вступ
На думку експертів ВООЗ, 90 % захворювань супроводжуються больовим синдромом, кожен п’ятий працездатний страждає від нього.
Серед усіх больових синдромів лідером є біль у спині. Гострий біль у спині різної інтенсивності протягом життя хоча б одно–кратно відмічається практично в кожної людини, у 15–20 % людей він трансформується в тривалий (до 2 місяців), а у 8–10 % — у хронічний біль, що є причиною тривалої непрацездатності. Основою виникнення болю в спині є складний комплекс дегенеративних змін, що відбуваються в суглобах хребта, міжхребцевих дисках і розташованих біля хребта м’яких тканинах — м’язах, сухожилках і зв’язках. При цьому патологічні зміни можуть проявлятися як остеоартроз (ОА), остео–хондроз, спондильоз, остеопороз.
Термін «деформуючий остеоартроз» (osteoartrosis deformatis) введений у медичну практику Т. Мюллером у 1911 р. Відповідно до останньої міжнародної класифікації для цього захворювання прийнята назва «остеоартроз».
ОА є значно поширеним захворюванням, в основі якого лежать дегенеративно–дистрофічні зміни, що призводять до тимчасової, а часто й до стійкої втрати працездатності. ОА посідає перше місце серед усіх хвороб суглобів. У структурі загальної захворюваності населення ОА діагностується в 17,3 % випадків. Необхідність посиленої уваги до цієї нозології визначається її соціальним значенням, оскільки за останні десятиріччя непрацездатність через ОА збільшилась у 3–5 разів. Гонартроз у чоловіків зустрічається в понад 2 рази рідше, ніж у жінок [1].
Захворювання розвивається переважно в середньому й похилому віці, голов–ним чином уражаються найбільш навантажені великі суглоби нижніх кінцівок, переважно колінні й кульшові.
Порушення метаболізму суглобового хряща, що призводить до його пошкодження, може бути наслідком майже всіх захворювань суглоба. Тому ОА є багатофакторним патологічним процесом. Виділяють фактори ризику, що включають механічні пошкодження суглобового хряща, інфекції, порушення обміну, –ендокринну дисфункцію.
Больовий синдром є постійним супутником ОА. Він негативно впливає на якість життя, призводить до зниження або втрати працездатності, пов’язаний зі значними витратами для системи охорони здоров’я. Біль — перший симптом, що спонукає пацієнта звернутися до лікаря. Важливо підкреслити, що біль — не тільки неприємний для пацієнта симптом і клінічний орієнтир оцінки ефективно–сті лікування, а й фактор, який значною мірою визначає віддалені результати патологічного процесу. Больовий синдром при ОА характеризується гетерогенністю й мультимодальністю, оскільки джерелом больових відчуттів можуть бути різні нав–колосуглобові структури — синовіальна оболонка, сухожилля, зв’язки, м’язи. Больовий синдром при ОА характеризується поєднанням болю механічного, запального, а також нейропатичного характеру, що надає йому хронічного перебігу [2].
Тому боротьба з больовим синдромом є найважливішим компонентом комплексної терапії ОА. Визнання значної ролі запалення в розвитку й прогресуванні ОА постулює необхідність активного за–стосування протизапальних засобів як основного методу патогенетичного впливу.
Основною групою лікарських засобів, що застосовуються в медичній практиці при лікуванні болю й запалення будь–якого генезу, особливо у хворих з ураженням опорно–рухового апарату, є нестероїдні протизапальні препарати (НПЗП). НПЗП є основним засобом для лікування болю в пацієнтів з остеоартрозом, болем у нижній частині спини, гострим подагричним артритом, ОА та запаленням навколосуглобових м’яких тканин, ревматоїдним артритом, анкілозивним спондилітом, реактивними артритами, а також після операційних втручань.
НПЗП широко використовуються в медичній практиці для лікування больового синдрому при остеоартрозі, ревматоїдному артриті, вертеброгенному больовому синдромі, онкологічних захворюваннях і в післяопераційному знеболюванні.
Останніми роками спостерігалася чітка тенденція: НПЗП розглядаються як досить ефективні, але й досить небезпечні симптоматичні знеболюючі засоби. Така позиція визначалася передусім побоюваннями щодо розвитку гастроінтестинальних і кардіоваскулярних ускладнень. Адже більшість пацієнтів з ОА — це люди похилого віку з вагомою коморбідною патологією. Тому використання НПЗП при ОА базувалося на принципі «мінімальні дози протягом мінімального періоду часу». Пропонувався прийом НПЗП за вимогою, тільки в періоди посилення больового синдрому. А як аналгетичний препарат першої лінії численні рекомендації пропонували застосовувати парацетамол [3].
У новій редакції (2016) рекомендацій із лікування ОА колінних суглобів, розроблених групою провідних міжнародних експертів ESCEO (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis), змінено підходи до призначення НПЗП. Так, другий крок алгоритму терапії ОА при неефективності повільно діючих симптом–модифікуючих засобів (SYSADOAs), парацетамолу й засобів локальної терапії передбачає призначення НПЗП, причому не короткими курсами, а «переривчасто або постійно — тривалими циклами» («Intermittent or continuous (longer cycles) oral NSAID») [4].
Це ключове положення, що вказує на усвідомлення ролі НПЗП як принципово важливого засобу для фармакотерапії ОА. Це положення підкреслюється в нещодавньому огляді J.P. Pelletier зі співавт. (2016) [5], присвяченому використанню НПЗП, у якому вказується, що НПЗП є наріжним каменем лікування ОА.
У 2014 році був прийнятий Міжнародний консенсус відносно ролі німесуліду в лікуванні болю. Міжнародний консенсус підтвердив високу ефективність німесуліду. Завдяки потужному протизапальному ефекту німесулід особливо показаний при болі на фоні запальної реакції.
У 2015 році позитивне співвідношення «користь/ризик» для німесуліду було підтверджене Європейським агентством лікарських засобів (European Medicines Agency).
Німесулід посідає особливе місце серед НПЗП завдяки низці переваг, таких як слабка кумуляція в організмі, селективне пригнічення активності циклооксигенази–2 (ЦОГ–2), мультифакторний вплив на запалення, антирадикальна активність, антибрадикініновий і антигістамінний ефекти тощо. Саме ці ефекти, а також хіміко–фізичні характеристики німесуліду забезпечують йому специфічність дії й чітке місце застосування [6].
Одна з таких характеристик — фізико–хімічна структура, що обумовлює фармакокінетику, у тому числі рівень шлунково–кишкової абсорбції, захоплення запаленими синовіальними клітинами й проникнення в синовіальну рідину. Німесулід — похідне сульфонаніліду, що має оригінальну структуру: складається з 2 ароматичних кілець і метилсульфонілової групи, які визначають відносно високу рКа (6,5) і помірну ліпофільність препарату. Німесулід іонізується в умовах кислого середовища шлунка й гірше затримується в його слизовій оболонці, що зменшує ймовірність пошкодження органа. Саме кислотність є запорукою шлунково–кишкової безпеки німесуліду.
Те, що однією з головних переваг німесуліду є значно менший ризик розвитку серйозних ускладнень з боку шлунково–кишкового тракту (не менше ніж у 2 рази) порівняно з традиційними НПЗП, було показано неодноразово. За даними добре відомого популяційного дослідження [7], проведеного в Північній Італії, ускладнення з боку шлунково–кишкового тракту у хворих, які приймали німесулід, мали місце в 10,4 % випадків, на той час як при застосуванні диклофенаку — в 21,2 %, кетопрофену — в 21,7 %, а піроксикаму — в 18,6 %. Це одна з головних переваг німесуліду, оскільки розвиток патології травної системи є, безумовно, головним лімітуючим фактором при використанні НПЗП.
Іншою важливою фармакокінетичною особливістю німесуліду є дуже швидке досягнення максимальних концентрацій і короткий період напіввиведення. Так, максимальна концентрація німесуліду в плазмі становить від 2,86 до 6,50 мг/л і досягається протягом 1,22–2,75 год після перорального прийому. Середній період напіврозпаду становить від 1,8 до 4,7 год, але при дворазовому призначенні препарату лейкоцитарна ЦОГ–2 пригнічується протягом 8 годин. Період напіввиведення становить від 1,8 до 4,73 год; у сечі й фекаліях німесулід визначається в мінімальних концентраціях, основний шлях його елімінації з організму — це мета–болічна трансформація з утворенням 4’–гідро–ксипохідних, які також мають протизапальні й аналгетичні властивості, але меншою мірою.
Короткий період напіврозпаду німесуліду також дозволяє призначати його пацієнтам похилого віку з порушеннями функції нирок без ризику акумуляції в організмі [8]. Німесулід може застосовуватися у хворих із кліренсом креатиніну від 30 до 80 мл/хв без корекції дози. Повторний прийом препарату протягом 7 днів практично не викликає його кумуляції.
Швидкість настання аналгетичного ефекту у німесуліду заслужено вважається визначною: знеболювання настає через 15–20 хв після прийому пероральних форм. Це було яскраво продемонстровано при широкому спектрі патологічних станів. Деякі автори обґрунтовано вважають, що німесулід своїми унікальними властивостями, що мають попит у клінічній практиці, більшою мірою зобов’язаний своїй фармакокінетиці й додатковим ефектам, ніж пригніченню ЦОГ–2 [9]. Не викликає сумнівів, що саме завдяки фармакокінетиці німесулід зарекомендував себе як препарат для швидкої ліквідації болю: німесулід швидко й повністю абсорбується у верхніх відділах шлунково–кишкового тракту, при цьому для досягнення піку плазмової концентрації потрібно менше однієї години –після прийому ентеральних форм.
Німесулід пригнічує гіпералгезію в короткі для нестероїдних протизапальних засобів (і не тільки) строки. Усі НПЗП викликають зменшення гіпералгезії, однак ефект застосування німесуліду перевершує такий у рофекоксибу і практично не відрізняється від ефективності диклофенаку й целекоксибу [10]. Це дає підставу призначати німесулід до і після оперативного втручання.
Перевагою німесуліду є селективне пригнічення ЦОГ–2 і, відповідно, менша кількість ускладнень з боку шлунково–кишкового тракту, вплив на процес запалення через пригнічення різних його механізмів, слабка кумуляція в організмі, антигістамінний і антибрадикініновий ефекти. Не менш важливим є хондро–протекторний ефект німесуліду.
Знеболювальний ефект німесуліду розвивається швидко, у тому числі завдяки доброму проникненню в синовіальну рідину. У синовіальній рідині максимальна концентрація досягається аналогічно до концентрації в крові. Після прийому препарату протягом тижня в дозі 200 мг на добу німесулід затримується в синовіальній рідині протягом 12 год [9].
У 1994 р. була продемонстрована здатність німесуліду пригнічувати ЦОГ–2 при значно меншому впливі на ЦОГ–1, що в подальшому було неодноразово підтверджено в дослідженнях in vitro [11, 12], ex vivo [13], а також in vivo [11]. Німесулід є переважно селективним препаратом щодо ЦОГ–2: у терапевтичних концентраціях він пригнічує 88 % активності ЦОГ–2 і 45 % активності ЦОГ–1. Саме таке співвідношення блокади ізоформ ЦОГ обумовлює швидке настання –клінічного ефекту і низький ризик побічних ефектів. У даному випадку помірна селективність може бути перевагою порівняно з високою селективністю. Передбачається, що німесулід пригнічує ЦОГ–1 саме в осередку запалення й болю, що може забезпечувати особливу терапевтичну перевагу за відсутності впливу на ЦОГ–1 у шлунку й нирках [9].
Запалення супроводжується гіпер–продукцією інтерлейкіну–1 і –6; фактора некрозу пухлини альфа (ФНП–a); накопичені в ділянці тканинного запалення лімфогістіоцитарні клітини виділяють агресивні ферменти (матриксні метало–протеїнази) і перекисні продукти, що ушкоджують клітини синовії, хряща й субхондральної кістки. Утворені при цьому алгогени стимулюють периферичні больові рецептори, а цитокіни й простагландини різко підвищують їх чутливість до больового порушення, що на піку запальної активності, яка припадає на другу половину ночі й ранні ранкові години, призводить до появи типового запального болю в пацієнтів із ревматичними захворюваннями суглобів.
Німесулід є препаратом із мультифакторним механізмом дії, що не обмежується лише пригніченням ЦОГ–2. Численні різнопланові ефекти впливу німесуліду на механізми болю й запалення отримали назву ЦОГ–незалежних ефектів [14].
Так, німесулід пригнічує:
► агрегацію й міграцію нейтрофілів;
► продукцію й вивільнення гістаміну;
► утворення токсичних форм кисню;
► активність індуцибельної NO–синтетази;
► продукцію фактора активації тромбоцитів;
► синтез матриксних металопротеїназ (ММП);
► вивільнення цитокінів (інтерлейкін–6);
► синтез і вивільнення субстанції Р;
► транслокацію епсилон–протеїн–кінази С у сенсорних нейронах.
Особливо значущим ЦОГ–незалежним ефектом німесуліду є пригнічення активності NO–синтетази і, відповідно, утворення окису азоту (NO) й пероксинітриту (ОNOO–), що є ключовими медіаторами в процесі руйнування клітин організму. У процесі досліджень було виявлено, що при остеоартрозі в хондроцитах збільшується утворення оксиду азоту. З одно–го боку, це гальмує синтез матриксу й підсилює його деградацію. З іншого — взаємодія NO з гідроксильними радикалами й супероксид–аніоном призводить до утворення іншого радикала кисню — перо–ксинітриту, що підсилює ушкодження клітин і підвищує чутливість хондроцитів до цитокін–індукованого апоптозу. Німесулід запобігає розвитку NO–індукованого ушкодження тканин двома способами. По–перше, препарат пригнічує активність NO–синтази, що призводить до зменшення утворення NO. По–друге, німесулід і його основний метаболіт захоплюють пероксинітрит, зменшуючи його шкідливу дію на клітини.
Німесулід також пригнічує активність 5–ліпоксигенази, знижуючи таким чином ризик виникнення запалення й виразок у шлунково–кишковому тракті, що додатково підвищує його гастроінтестинальну безпеку [2].
Важлива перевага німесуліду над іншими нестероїдними протизапальними засобами полягає в здатності пригнічувати вивільнення гістаміну тучними клітинами [15]. Цей ефект має величезне значення, оскільки спектр дії гістаміну надзвичайно широкий і вплив на його продукування в низці ситуацій може мати додаткове значення. Так, на відміну від індометацину, німесулід виявився здатним знижувати скорочення ізольованої бронхіальної мускулатури людини у відповідь на вплив гістаміну. Крім того, у дослідах на свинях він зменшував бронхо–констрикцію, викликану ацетальдегідом. Німесулід інгібує імунну й неімунну секрецію гістаміну тучними клітинами, що дозволяє рекомендувати його пацієнтам із болем і схильністю до астмоїдних нападів. Отже, німесулід є препаратом вибору за наявності у хворого астми, а також алергічних реакцій на інші НПЗП.
J. Pelletier і співавт. (1999) [16] продемонстрували, що в терапевтичних концентраціях німесулід, на відміну від напроксену, індукував внутрішньоклітинне фосфорилювання й активацію глюкокортикоїдних рецепторів, що приводить до зміни експресії глюкокортикоїдних генів–мішеней. Отже, одним із механізмів протизапальної активності німесуліду може бути також вплив на глюкокортикоїдні рецептори.
Унікальною властивістю, що вирізняє німесулід серед усіх НПЗП, вважається його антицитокіновий ефект. За останніми даними встановлено, що німесулід пригнічує in vivo вивільнення ФНП–a і продукцію активного кисню — це два ефекти, які роблять суттєвий внесок у протизапальну й аналгетичну дію препарату [9]. Саме ФНП–a є ключовим тригером щодо стимуляції утворення інших цитокінів гіпер–алгезії. На культурі синовіальних фібробластів у хворих на остеоартроз німесулід у терапевтичних концентраціях знижував синтез інтерлейкіну–6 і урокінази при підвищенні продукції інгібітору активатора плазміногену (PAI). Аналогічна дія була в напроксену, однак для цього були потрібні більш високі дози препарату. Такі особливості німесуліду, як активація синтезу інгібітору тканинного активатора плазміногену, блокування синтезу тромбоцит–активуючого фактора, є надзвичайно важливими для ортопедо–травматологічної групи хворих для запобігання післяопераційним тромбоемболічним ускладненням, що особливо значимо для пацієнтів із супутніми кардіо–васкулярними захворюваннями [17].
Німесулід усуває пригнічувальний вплив інтерлейкіну–1 на синтез протео–гліканів. На відміну від індометацину, що значно ушкоджує хрящ, німесулід in vitro навіть у високих дозах не порушував синтез протеогліканів хондроцитами. Було також показано пригнічення виділення еластази й інших маркерів нейтрофільної дегрануляції, що підтримують деструкцію хряща при остеоартрозі.
Ці експериментальні дані знайшли підтвердження в клінічних дослідженнях, у яких призначення терапевтичних доз німесуліду призводило до значного зниження рівня матриксних метало–протеїназ у сироватці крові, зокрема МПП–3 (або стромелізину) [1]. Дослідження М. Bevilacqua і співавт. (2004) [18] також підтвердило, що у хворих знижується концентрація ММП–3 і гіалуронату в сироватці крові при застосуванні німесуліду на відміну від хворих, які прий–мали ібупрофен. Отже, виконані дослідження свідчать про те, що німесулід знижує вміст MMП–2, MMП–3, MMП–8, MMП–9, PAI–1, гіалуронату, хрящового олігомерного матричного протеїну (COMP) у плазмі крові або культурах суглобових клітин, що вказує на його здатність підтримувати нормальну анатомію й фізіологію хряща в пацієнтів з остеоартрозом. Ці факти в поєднанні з низьким ризиком розвитку ускладнень з боку шлунково–кишкового тракту є підставою для застосування німесуліду при остео–артрозі.
Поєднання таких властивостей німесуліду, як протизапальний, аналгетичний і хондропротективний ефекти, є особливо важливим для ефективної боротьби з хронічними захворюваннями суглобів і –опорно–рухового апарату в цілому.
Для застосування в ортопедії й травмато–логії дуже важливою є комбінація аналгетичної, хондропротективної й проти–запальної дії німесуліду.
Матеріали та методи
За дизайном дане клінічне дослідження було проспективним. З метою оцінки ефективності препарату були сформовані клінічні групи хворих, ідентичних за характером і стадією захворювання, які після підписання інформованої згоди включалися в дослідження. Дослідження проведено в нашому центрі з жовтня 2017 року по квітень 2018 року.
Дослідження проведено за участю 300 пацієнтів. 90 хворих становили конт–рольну групу, 180 — дослідну, 30 — ретроспективну.
Хворі контрольної групи отримували Німесил по 1 саше 2 рази на добу після прийому їжі.
Половина хворих дослідної групи отримувала Німедар по 1 саше 2 рази на добу після прийому їжі, друга половина — Німедар у вигляді гранул (саше) і гелю місцево 4 рази на добу.
Хворі ретроспективної групи не отримували вказаних препаратів.
Курс лікування тривав 14 діб.
Контрольна група була поділена на три підгрупи, хворі розподілялись таким чином.
Першу підгрупу становили 30 хворих жіночої статі віком 40–50 років з остео–артрозом колінного суглоба 1–ї стадії й незначним синовітом.
Другу підгрупу становили 30 хворих чоловічої статі з остеохондрозом по–перекового відділу хребта, наявністю больового синдрому без неврологічної симптоматики.
Третю підгрупу становили 30 хворих чоловічої статі віком 30–40 років із парціальним пошкодженням заднього рогу медіального меніска, яким була проведена артроскопічна резекція пошкодженої частини меніска. У дослідження включені лише хворі з клаптеподібним пошкодженням заднього рогу медіального меніска, що було діагностовано артро–скопічно.
Дослідна група була поділена на шість підгруп, хворі розподілялись таким чином.
Першу підгрупу становили 30 хворих жіночої статі віком 40–50 років з остеоартрозом колінного суглоба 1–ї стадії і незначним синовітом, які отримували Німедар у вигляді гранул.
Другу підгрупу становили 30 хворих жіночої статі віком 40–50 років з остео–артрозом колінного суглоба 1–ї стадії і незначним синовітом, які отримували –Німедар у вигляді гранул і гелю місцево.
Третю підгрупу становили 30 хворих чоловічої статі з остеохондрозом поперекового відділу хребта, наявністю больового синдрому без неврологічної симптоматики, які отримували Німедар у вигляді гранул.
Четверту підгрупу становили 30 хворих чоловічої статі з остеохондрозом поперекового відділу хребта, наявністю больового синдрому без неврологічної симптоматики, які отримували Німедар у вигляді гранул і гелю місцево.
П’яту підгрупу становили 30 хворих чоловічої статі віком 30–40 років із парціальним пошкодженням заднього рогу медіального меніска, яким була проведена артро–скопічна резекція пошкодженої частини меніска. У дослідження включені лише хворі з клаптеподібним пошкодженням заднього рогу медіального меніска, що було діагностовано артро–скопічно. Ці хворі отримували Німедар у вигляді гранул.
Шосту підгрупу становили 30 хворих чоловічої статі віком 30–40 років із парціальним пошкодженням заднього рогу медіального меніска, яким була проведена артроскопічна резекція пошкодженої частини меніска. У дослідження включені лише хворі з клаптеподібним пошкодженням заднього рогу медіального меніска, що було діагностовано артро–скопічно. Ці хворі отримували Німедар у вигляді гранул і гелю місцево.
Ще 30 хворих чоловічої статі віком 30–40 років із парціальним пошкодженням заднього рогу медіального меніска, яким була проведена артроскопічна резекція пошкодженої частини меніска, становили ретроспективну групу для оцінки кількості введень знеболюючих препаратів після операції. Вони не отримували ні Німесил, ні Німедар.
Пацієнти не мали інших системних захворювань, а також гострих патологічних процесів з боку печінки, нирок, серцево–судинної, ендокринної й нервової систем.
Перед включенням у групу дослідження з метою визначення й уточнення діагнозу всім хворим проводилися загальноклінічні лабораторні обстеження, що дало можливість провести диференціальну діагностику зі специфічними й неспецифічними запальними захворюваннями суглобів (ревматоїдний артрит, реактивний артрит тощо).
Усім хворим з остеоартрозом виконували рентгенографію колінного суглоба в корональній, сагітальній і аксіальній проекціях, рентгенографію в корональній проекції з навантаженням, рентгенографію в проекції Розенберга і магнітно–резонансну томографію (МРТ) суглоба. Це дало можливість виключити з дослідження всіх хворих із підозрою на травматичні зміни в суглобі.
Усім хворим з остеохондрозом поперекового відділу хребта також виконували рентгенографію поперекового відділу хребта в корональній і сагітальній проекціях, функціональні рентгенограми в сагітальній проекції, МРТ поперекового відділу хребта. Це дало змогу виключити з дослідження хворих із наявністю спондилоартрозу, спондильозу й протрузіями міжхребцевих дисків.
Усім хворим із парціальним пошкодженням заднього рогу медіального меніска виконували рентгенографію колінного суглоба в корональній, сагітальній і аксіальній проекціях, рентгенографію в корональній проекції з навантаженням, рентгенографію в проекції Розенберга та МРТ–дослідження суглоба. Це дало можливість виключити з дослідження всіх хворих із підозрою на дистрофічні зміни в суглобі й інші травматичні ушкодження.
Отже, ми сформували максимально однорідні підгрупи хворих у контрольній і дослідній групах.
Клінічне спостереження за хворими проводили в динаміці: до початку лікування й через 20–25 діб після початку лікування. Функціональний результат був тим кращим, чим менше була вираженість ранкової скутості й функціональних розладів колінного суглоба у хворих першої та другої підгруп, чим нижче була суб’єктивна оцінка больового синдрому за візуально–аналоговою шкалою (ВАШ) [19]. Візуально–аналогова шкала — метод суб’єктивної оцінки болю. Пацієнта просять відмітити на неградуйованій лінії довжиною 10 см точку, що відповідає ступеню вираженості болю. Ліва межа лінії відповідає визначенню «болю немає», права — «найгірший біль, який можна собі уявити». Як правило, використовують паперову, картонну або пластмасову лінійку довжиною 10 см.
Зі зворотного боку лінійки нанесено сантиметрові поділки, за якими лікар відзначає отримане значення й заносить у лист спостереження. До безумовних переваг цієї шкали відносять її простоту й зручність. При динамічній оцінці зміни інтенсивності болю вважають об’єктивними й істотними, якщо справжнє значення ВАШ відрізняється від попереднього більше ніж на 13 мм.
Обстеження хворих на ОА включало клініко–функціональні тести, що давали змогу оцінити стан суглобів, ступінь суглобової декомпенсації на початку лікування і на його етапах, а саме індекс WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index). Індекс WOMAC належить до генеричних методів оцінки здоров’я хворих на остеоартроз. Тест подано у вигляді опитувальника, що включає 24 питання, які характеризують біль (5 питань), скутість (2 питання) і функціональну спроможність (17 питань) у хворих на остеоартроз колінних і кульшових суглобів. Індекс WOMAC — високоінформативний показник, що застосовується для оцінки ефективності як медикаментозного, так і немедикаментозного лікування [13].
Хворих, яким виконували артроскопічну меніскектомію, оцінювали за шкалою Лісхольма і шкалою Тегнера. Шкала підрахунку балів колінного суглоба Лісхольма (The Lysholm knee scoring scale) була запропонована Lysholm і Gillquist. Вона призначена для заповнення пацієнтом за участю лікаря. При загальному підрахунку балів результат класифікується як «незадовільний», «задовільний», «добрий» або «відмінний». Абсолютно здоровому колінному суглобу відповідає показник 100 балів. Показник 84 бали вважається нижньою межею відмінних/добрих результатів [19].
Шкала рівня активності Тегнера (Tegner Activity Level scale) подана у вигляді запитань, що досліджують 11 рівнів можливої активності пацієнта. Пацієнту пропонується самостійно вибрати рівень активності, що відповідає його можливостям на момент огляду. При цьому 0 відповідає максимальним порушенням, а рівень 10 — повним функціональним можливостям колінного суглоба [19].
Також у хворих, яким виконували –артроскопічну меніскектомію, оцінювали потребу в знеболювальних засобах після операції.
Оцінювали появу небажаних реакцій у хворих. До небажаних побічних реакцій були включені: головний біль, порушення сну, безсоння, запаморочення, відчуття нудоти, біль і дискомфорт в епігастральній ділянці, метеоризм, діарея, запор, алергічні реакції.
Результати та обговорення
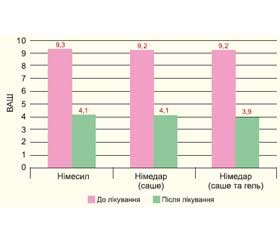
У першій підгрупі дослідної групи (жінки з ОА колінного суглоба 1–ї стадії) інтенсивність болю за ВАШ змінилась після прийому Німесилу з 9,3 до 4,1 бала (різниця становила 5,2 бала). Після прийому Німедару інтенсивність болю за ВАШ змінилась з 9,2 до 4,1 бала, різниця становила 5,1 бала.
У другій підгрупі дослідної групи (жінки з ОА колінного суглоба 1–ї стадії) після поєднаного прийому Німедару у вигляді саше й гелю інтенсивність болю за ВАШ змінилась з 9,2 до 3,9 бала.
Оцінка ефективності лікування за індексом WOMAC вірогідно засвідчила позитивну динаміку зменшення больового синдрому, ранкової скутості й зростання функціональної активності після проведеного лікування препаратом німесулід у хворих на ОА колінного суглоба. При цьому відзначено позитивну динаміку: з 57,3 до 26,6 бала — за умови прийому Німесилу та з 56,9 до 26,9 бала — за умови прийому Німедару. За умови поєднаного застосування Німедару у вигляді саше й гелю місцево індекс WOMAC знизився з 56,9 до 26,4 бала. Різниця результатів у підгрупах хворих виявилась несуттєвою. Отже, результати проведеного лікування й динамічного спостереження за індексом WOMAC підтвердили ефективність застосування Німедару й Німесилу в ме–жах терміну спостереження.
Побічна реакція у вигляді нудоти спостерігалась в однієї пацієнтки, яка прий–мала Німедар.
У другій підгрупі (чоловіки з остеохондрозом поперекового відділу хребта) інтенсивність болю за ВАШ змінилась після прийому Німесилу з 8,4 до 4,0 бала (різниця становила 4,4 бала). Після прийому Німедару інтенсивність болю за ВАШ змінилась з 8,3 до 4,1 бала, різниця становила 4,2 бала. За умови поєднаного прийому гранул і гелю Німедар інтенсивність болю за ВАШ знизилась з 8,3 до 3,9 бала з різницею в 4,4 бала.
Побічні реакції не спостерігались у жодного хворого.
У третій підгрупі (чоловіки з парціальним пошкодженням заднього рогу медіального меніска, яким була проведена артроскопічна резекція пошкодженої частини меніска) інтенсивність болю за ВАШ змінилась після прийому Німесилу з 9,4 до 2,2 бала (різниця становила 7,2 бала). Після прийому Німедару інтенсивність болю за ВАШ змінилась з 9,3 до 2,2 бала, різниця становила 7,1 бала. За умови поєднаного прийому гранул і гелю Німедар інтенсивність болю за ВАШ знизилась з 9,3 до 2,2 бала з різницею в 7,1 бала.
Оцінка функціонального стану колінного суглоба за шкалою Лісхольма у ме–жах 20–денного спостереження за загальною сумою балів і при оцінюванні показників досягнутого результату засвідчила приблизно однаковий функціональний результат при застосуванні в післяопераційному періоді і Німесилу, і Німедару. Так, відразу після операції середній рівень функціональної активності колінного суглоба в підгрупі прийому Німесилу становив 53,9 бала, що відповідало задовільній оцінці. Після застосування Німесилу рівень функції зріс у середньому до 89,6 бала, що відповідає доброму функціональному результату. А середній рівень функціональної активності колінного суглоба в підгрупі прийому Німедару становив відразу після операції 54,1 бала, а через 20 днів — 89,9 бала, що також відповідало доброму функціональному результату. У хворих, які отримували Німедар у вигляді гранул і гелю, інтенсивність функції зросла з 54,1 до 90,0 бала.
Визначення рівня активності хворих за шкалою Тенгера засвідчило зростання активності хворих через 25 діб після початку лікування з 4,6 до 9,3 бала як при застосуванні Німесилу, так і при обох варіантах застосування Німедару.
За суб’єктивною оцінкою лікаря, через 25 діб в дослідній групі хворих відмінний клінічний результат був відмічений у 2,4 % хворих, добрий — у 41,1 %, задовільний — у 49,7 %, а недостатній ефект був у 6,8 % пацієнтів.
При оцінці результатів лікування пацієнтами кількість відмінних і добрих результатів була дещо нижчою.
Побічні реакції у хворих цієї підгрупи також не спостерігались.
Хворим даної підгрупи вводилось менше знеболюючих препаратів, у тому числі опіоїдів. Так, кількість введень знеболю–ючих препаратів у перші три дні –після операції становила 1,4 на добу в обох підгрупах, а кількість введення опіоїдів становила 0,3 на добу на одного оперованого хворого. На той час як у хворих ретроспективної групи кількість введень знеболюючих становила 1,6 на добу, з них опіоїдів — 0,6. У жодного хворого ми не спостерігали післяопераційного синовіту.
► Оцінюючи появу небажаних побічних реакцій, а саме головного болю, порушення сну, безсоння, запаморочення, відчуття нудоти, болю й дискомфорту в епігастральній ділянці, метеоризму, діареї, запору, алергічних реакцій, ми виявили лише один випадок появи нудоти після прийому Німедару у хворої першої підгрупи, що було скориговано прийомом препарату. Тобто частота небажаних побічних реакцій після прийому Німесуліду становила 0 %, а після прийому Німедару — 0,3 %.
Висновки
Результати проведеного проспективного клінічного дослідження засвідчили ефективність застосування препарату Німедар при лікуванні хворих із остеоартрозом колінного суглоба першої стадії й остео–хондрозом поперекового відділу хребта без неврологічних ознак. У –межах спостереження встановлено суттєве зменшення больового синдрому за ВАШ. У системі мультимодальної анестезії застосування препарату Німедар також привело до зменшення введення анестетиків після проведення артроскопічних втручань і позитивної динаміки больового синдрому. Ефективність застосування препарату Німедар не поступалася ефективності застосування препарату Німесил.
Характер і частота виникнення побічних реакцій у групі спостереження засвідчили, що при застосуванні Німедару спорадичні випадки негативних побічних ефектів повністю усувалися корекцією режиму застосування й дієтою і не потребували припинення лікування, що підтверджує безпечність його застосування у хворих на остеоартроз із наявністю коморбідних станів.
На підставі отриманих результатів можна дійти висновку, що Німедар виявляє ефективну знеболюючу й проти–запальну дію, має високий профіль безпеки, добре проникає в синовіальну рідину, чинить хондропротекторний вплив, має відносно невисоку вартість курсу лікування, що дозволяє застосовувати його в системі лікування й профілактики дегенеративно–дистрофічних захворювань хребта й суглобів і в системі мульти–модальної анестезії після ендоскопічних операцій на суглобах.
Застосування комплексної терапії препаратом Німедар у гранулах та у формі гелю місцевої дії збільшує ефективність лікування остеоартрозу колінного суглоба 1–ї стадії, остеохондрозу поперекового відділу хребта без неврологічної симптоматики порівняно з монотерапією. Поєднане застосування Німедару у вигляді саше й гелю також показало кращу ефективність у хворих після артроскопічної парціальної резекції медіального меніска, ніж монотерапія.
Застосування препарату Німедар у системі мультимодальної анестезії після інших ортопедо–травматологічних операцій вимагає подальших досліджень.
! Отже, отримані нами результати демонструють переваги застосування комплексної терапії препаратом Німедар у гранулах і у формі гелю місцевої дії в ортопедичній практиці, тому що комплексне застосування препарату збільшує ефективність лікування порівняно з моно–терапією.
Конфлікт інтересів. Не заявлений.
Список літератури знаходиться в редакції

/u/11-1.jpg)