Газета «Новости медицины и фармации» №12 (700), 2019
Вернуться к номеру
Место Ритмокора в комплексной антиаритмической терапии у пациентов с патологией щитовидной железы
Авторы: Егорова М.С., Седая Л.В., Каташова Е.В., Кухарчук Х.Н.
ГУ «Институт эндокринологии и обмена веществ имени В.П. Комиссаренко НАМН Украины», г. Киев, Украина
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
По данным ВОЗ, патологией щитовидной железы (ЩЖ) страдает более 200 млн человек в мире. Только за последние 5 лет абсолютный прирост числа вновь выявленных случаев заболеваемости в экономически развитых странах составил 51,8 % среди женщин и 16,7 % среди мужчин. По данным Фремингемского исследования, повышенный уровень тиреотропного гормона (ТТГ) отмечен у 13,6 % женщин, а в Колорадском исследовании — у 9,5 % людей [1].
Давно известно, что основные клинические проявления и симптомы заболеваний ЩЖ связаны с эффектом воздействия тиреоидных гормонов (ТГ) на сердечно–сосудистую систему. Как избыток, так и недостаток тиреоидных гормонов вызывает изменения сердечной сократимости, сердечного выброса, артериального давления и общего периферического сосудистого сопротивления [2, 3]. В большинстве случаев сердечно–сосудистые изменения обратимы при нормализации функции ЩЖ. В последние десятилетия показано, что и субклинические –нарушения функции ЩЖ могут оказывать эффект на сердечно–сосудистую систему и увеличивать сердечно–сосудистый риск [4].
Патология сердца при дисфункции щитовидной железы зачастую является ведущей в клинике заболевания и нередко приводит к утрате трудоспособности, а при тяжелом течении — и к смерти у этой категории больных. В клинической картине отмечаются разнообразные сложные нарушения ритма сердца, артериальная гипертензия, метаболическая кардиомиопатия с развитием хронической сердечной недостаточности [5].
Морфофункциональным изменениям миокарда всегда предшествуют метаболические нарушения в сердечной мышце. Изменения сердечно–сосудистой системы при гипертиреозе обусловлены воздействием избыточного количества тиреоидных гормонов на обменные процессы и гемодинамику. Одним из важных эффектов тиреоидных гормонов является разобщение окислительного фосфорилирования, что приводит к снижению в сердечной мышце содержания АТФ и креатинфосфата. В результате происходит угнетение анаболических процессов: снижается синтез и усиливается распад гликогена и белка, снижается содержание калия в миоцитах и других клетках. Потребление кислорода миокардом увеличивается, однако эффективность его утилизации в процессе биологического окисления снижается. При избытке тироксина нарушается проницаемость митохондриальных мембран [6]. Под влиянием тиреоидных гормонов происходит усиление сократительной функции миокарда, вероятно, вследствие активизации стимулирующего влияния на сердце и прямого действия тироксина на сердечную мышцу.
Избыток тиреоидных гормонов изменяет симпатическое и парасимпатическое влияние на миокард. При высокой степени тиреотоксикоза при длительном его течении в результате резкого снижения эффективности биологического окисления, преобладания распада белка над его синтезом снижается уровень энергетических ресурсов и пластических процессов, что приводит к угнетению сократительной функции миокарда [1, 4, 7]. Снижение уровня тиреоидных гормонов в организме, даже ничтожный дефицит, также обусловливает серьезные нарушения обменных процессов, в том числе дистрофические изменения в сердце, сопровождающиеся снижением интенсивности окислительного фосфорилирования, замедлением синтеза белка, уменьшением поглощения кислорода миокардом, электролитными сдвигами. Поражается как сократительный миокард, так и строма. В кардиомиоцитах откладывается креатинфосфат и возникает так называемая псевдогипертрофия миокарда. В сердце, как и в других тканях, депонируются кислые гликозаминогликаны, приводящие к слизистому отеку миокарда и стромы [1, 7]. Важно раннее, до манифестации клинических симптомов, выявление пато–логии сердца, что возможно при скрининговом обследовании.
Основой для развития аритмии сердца у пациентов с патологией ЩЖ являются различные патофизиологические сдвиги, развивающиеся под влиянием действия гормонов ЩЖ, которая секретирует 2 вида гормонов — Т3 и Т4. Физиологическое действие гормонов связывают в большей степени с трийодтиронином (Т3), который активнее тироксина (Т4) в 4–5 раз. В сутки секретируется около 100 мкмоль тироксина и 5 мкмоль три–йодтиронина. 99,96 % указанных гормонов находятся в связанной с белками форме и депонируются. Биологическая активность тиреоидных гормонов осуществляется за счет остальных 0,4 % указанных гормонов [2].
Основные эффекты ТГ реализуются на уровне клеточного ядра, изменяя экспрессию генома, а также вне генома путем воздействия на плазматическую мембрану клетки (регулируя поток субстратов и катионов в клетку и из нее), цитоплазму, митохондрии (влияя на окислительный обмен). В механизмах негеномных эффектов могут участвовать компоненты систем передачи сигналов в клетку: фосфолипид или Са–зависимая протеинкиназа, цАМФ–зависимая протеинкиназа, комплекс кальмодулин — Са. К негеномным эффектам ТГ относятся: регуляция внутриклеточного уровня некоторых ионов и их распределение внутри клетки [9, 10].
Патогенез аритмий при избытке тиреоидных гормонов до конца не изучен, и в настоящее время в их развитии придают значение следующим факторам: токсическое воздействие ТГ на миокард, повышение симпатического тонуса вегетативной нервной системы, снижение внутриклеточного калия (табл. 1). Истощение нормотопной функции синусового узла вследствие уменьшения запасов субстрата автоматизма — ацетилхолина также ведет к развитию синдрома слабости синусового узла и переходу на патологический ритм [10].
Кардиопротекторы — это фармакологические средства профилактики нарушений и оптимизации функции сердца при нормальных физиологических и патологических условиях. Данный термин, выделяющий целый класс препаратов цитопротекторного и метаболического действия, применяемых для коррекции и восстановления функционального состояния миокарда, появился в медицинской и научной терминологии еще в 1990–х годах. На сегодня сформировалась точка зрения, согласно которой кардиопротекторы — это лекарственные препараты разных химических классов, действие которых не связано с гемодинамическим эффектом, а опосредуется оптимизацией процессов образования и расхода энергии, коррекцией функции дыхательной цепи, нормализацией баланса между интенсивностью процессов свободнорадикального окисления и антиоксидантной защитой, непосредственным влиянием на кардиомиоциты, что способствует их выживаемости в условиях ишемии, препятствует формированию метаболического ремоделирования (изменения) миокарда [8].
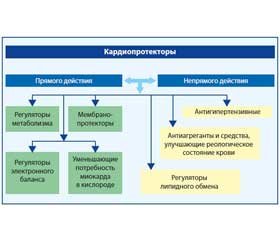
Механизм действия кардиопротекторов разнообразен и многопланов, поэтому необходимо разделить фармакологические средства данной категории на виды по их биологическим свойствам и иным факторам (рис. 1). Так, существует разделение кардиопротекторов на два больших типа: прямого и непрямого действия. Активность первых обусловливается как местным (стабилизация мембран, сосудорасширяющий эффект, влияние на процесс обмена веществ в кардиомиоцитах), так и центральным воздействием (регуляция сосудистого тонуса благодаря влиянию на структурные элементы центральной нервной системы). Вторые же примечательны тем, что способны уменьшать нагрузку на миокард и вследствие этого предупреждать метаболические нарушения в кардиомиоцитах [8, 11].
Принципиальным отличием в механизме действия недавно разработанного препарата Ритмокор (фармацевтическая фирма «ФарКоС») является активация обмена глюкозы при ишемии без блокады окисления жирных кислот в нормоксических условиях. Действующим веществом препарата является пентаоксикапроновая кислота в виде магниевой и калиевой солей, обладающая метаболическим, мембраностабилизирующим, антиоксидантным и антиаритмическим действием. Метаболическая активность препарата определяется активацией пентозофосфатного цикла (гексозомонофосфатный шунт) — сложного ферментативного процесса прямого аэробного окисления фосфорилированной глюкозы до CO2 и H2O, сопровождающегося накоплением важного кофермента — восстановленного никотинамидадениндинуклеотид–фосфата (НАДФН) (рис. 2). Установлено, что парентеральное введение Ритмокора на фоне базисной терапии улучшает переносимость физических нагрузок и уменьшает клинические проявления стенокардии напряжения у больных пожилого возраста, а также оказывает выраженный антиаритмический эффект [12].
В ходе экспериментальных исследований установлено, что Ритмокор в условиях ишемии стимулирует пентозофосфатный путь окисления глюкозы, способствует угнетению процессов перекисного окисления липидов и свободно–радикального окисления белков, нормализует активность основных ферментов метаболизма миокарда лактатдегидрогеназы, креатинфосфокиназы, сукцинатдегидрогеназы, а также способствует нормализации ионного гомеостаза.
Известно, что магний в состоянии способствовать нормализации внутриклеточного содержания ионов натрия, калия и кальция, ведя тем самым к улучшению коронарного кровообращения вследствие снижения тонуса сосудов и уменьшения миокардиального потребления кислорода, предотвращению –некроза клетки, их электрической стабилизации.
Кроме того, существует целый ряд клинических ситуаций, при которых Ритмокору может быть отдано предпочтение перед другими метаболическими препаратами: наличие нарушений сердечного ритма, изменение уровня калия, магния, натрия в сыворотке крови при непереносимости антиангинальных средств основ–ных классов и ограничениях или противо–показаниях к их назначению [11].
Благоприятное влияние на метаболизм обусловлено повышением активности окислительно–восстановительных ферментов, в частности Na+/K+–АТФазы [10], что, в cвою очередь, способствует повышению стабильности электро–физиологических свойств кардиомио–цитов [11].
При экспериментальном моделировании нарушений сердечного ритма антиаритмический эффект Ритмокора сопоставим с эффектами амиодарона. Ритмокор обладает широким спектром антиаритмической активности, в том числе снижает риск развития желудочковой тахикардии и экстрасистолии высоких градаций.
Глюконовая кислота и ее соли обладают способностью нормализовать нарушенный баланс калия и натрия в миокарде при коронарной недостаточности (повышается содержание калия и снижается содержание натрия), что обусловливает антиаритмическое действие в условиях экспериментального моделирования ишемии сердца [11].
По результатам экспериментальных исследований, Ритмокор улучшает клеточный метаболизм, оказывает мембраностабилизирующее, антиаритмическое и антиоксидантное действие [11].
Опыт клинического применения препарата до последнего времени ограничивался исследованием антиаритмической эффективности и переносимости его капсулированной формы.
Целью данного исследования является комплексный анализ антиаритмической активности, оценка эффективности и безопасности курсового приема Ритмокора у пациентов с диффузным токсическим зобом (ДТЗ) в состоянии компенсации в дополнение к базовой терапии бета–блокаторами, которая используется в Украине согласно стандартам ведения таких пациентов, по следующей схеме: Ритмокор по 15 мл 10% раствора внутривенно в течение 10 дней, далее по 1 капсуле 3 раза в день в течение 1 месяца.
Данное клиническое испытание проводилось как наблюдательное (неинтервенционное) открытое контролируемое несравнительное проспективное исследование, в котором лекарственное средство Ритмокор назначалось в соответствии с зарегистрированными показаниями. В исследовании не проводились дополнительные мониторинговые процедуры, а обследование пациентов выполнялось в рамках обычной рутинной медицинской практики. В исследовании приняли участие 25 пациентов (5 мужчин и 20 женщин, средний возраст — 43 ± 6 лет), которые получали лечение в Государственном учреждении «Институт эндо–кринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины» по поводу диффузного токсического зоба.
В исследование не включали пациентов со всеми формами фибрилляции предсердий, с некорригируемым артериальным давлением (АД) > 160/90 мм рт.ст., снижением фракции выброса < 40 % по данным двухмерной эхокардиографии, перенесших инфаркт миокарда и инсульт, с клинически выраженной сердечной недостаточностью, значительно выраженными нарушениями функции почек и печени, с наркотической или алкогольной зависимостью, перенесенными острыми воспалительными заболеваниями в течение предшествующего месяца. Также в исследовании не принимали участие пациенты, перенесшие реваскуляризацию, с нестабильной стенокардией или инфарктом миокарда и ревматическими пороками сердца.
Также все пациенты проходили общепринятое клиническое, лабораторное (общий анализ крови и мочи, определение липидного профиля, уровня креатинина, мочевины, глюкозы, аспартатаминотрансферазы, аланинаминотрансферазы, билирубина) и инструментальное исследование (электрокардиография (ЭКГ) с оценкой вариабельности ритма сердца (ВРС), холтеровское мониторирование ЭКГ).
Исследование ВРС проводилось на диагностическом комплексе Cardio с использованием статистического анализа временной области и спектрального анализа короткой (пятиминутной) последовательности электрокардиографических интервалов R–R в состоянии покоя. Определялись следующие показатели временного анализа: стандартное отклонение (SDnn, мс), стандартное отклонение разностей продолжительности соседних интервалов R–R (RMSSD, мс). При выполнении спектрального анализа определялись: общая мощность спектра ритма сердца (tP, мс2), мощности в диапазоне 0,00–0,04 Гц (VLF, мс2), 0,04–0,15 Гц (LF, мс2), 0,15–0,4 Гц (HF, мс2) и соотношение LF/HF. Спектральные составляющие LF и HF анализировались как в абсолютных значениях, так и в производных от них нормализованных единицах, которые автоматически рассчитывались по формулам:
LFnorm = LF/(TP – VLF) ´ 100 %
и
HFnorm = HF/(TP – VLF) ´ 100 %.
Определялась также структура спектра в процентном соотношении составляющих: %VLF, %LF, %HF.
Исследование предполагало три визита пациента к врачу (табл. 2).
Оценка врачом–исследователем эффективности лечения пациентов исследуемым лекарственным средством Ритмокор производилась согласно данным, полученным из дневника пациента. Для оценки динамики уменьшения частоты симптомов проводился анализ изменений их частоты в процентах по отношению к данному показателю до лечения, взятому за 100 %.
► Критерии оценки исследователем эффективности терапии:
► высокая эффективность (3 балла) — уменьшение клинических проявлений на 50 % и более;
► умеренная эффективность (2 балла) — уменьшение клинических проявлений на 20–49 %;
► низкая эффективность (1 балл) — уменьшение клинических проявлений менее чем на 20 %;
► отсутствие эффективности (0 баллов) — отсутствие динамики (или ухудшение) клинических проявлений.
Переносимость терапии исследуемым лекарственным средством Ритмокор оценивалась на основании субъективных данных, сообщаемых пациентом, и объективных данных, полученных исследователем в процессе лечения. Учитывалась динамика инструментальных показателей, а также частота возникновения и характер побочных реакций. Оценка врачом–исследователем переносимости лечения пациентов исследуемым лекарственным средством Ритмокор производилась согласно данным, полученным из дневника пациента. В дальнейшем вычисляли процент пациентов, у которых переносимость лечения лекарственным средством Ритмокор была оценена следующим образом:
► хорошая переносимость (2 балла) — не отмечено побочных реакций;
► удовлетворительная переносимость (1 балл) — наблюдаются незначительные побочные реакции, не доставляющие серьезных проблем пациенту и не требующие отмены препарата;
► неудовлетворительная переносимость (0 баллов) — имеют место серьезные побочные реакции, оказывающие значительное отрицательное влияние на состояние больного, требующие отмены препарата и проведения дополнительных медицинских мероприятий.
Статистический анализ проводился с помощью пакета Statistica 6.0.
Результаты и их обсуждение
В соответствии с принятыми критериями нами проведена оценка эффективности комплексного лечения пациентов c ДТЗ (табл. 3). Анализ полученных данных показал, что у подавляющего большинства пациентов данной выборки, в частности у 21 (84,0 %) больных, эффективность комплексной терапии с применением препарата была оценена как высокая и только у 4 (16,0 %) больных — как умеренная. Случаев отсутствия или низкой эффективности комплексной терапии с применением препарата в данном исследовании зафиксировано не было (табл. 3).
Аналогично в соответствии с принятыми критериями нами была проведена оценка переносимости комплексного лечения препаратом Ритмокор пациентов с ДТЗ (табл. 4). Анализ полученных данных показал, что у всех пациентов данной выборки (100 %) переносимость комплексной терапии с применением препарата Ритмокор была оценена как хорошая.
Нами была проведена оценка безопасности комплексного лечения пациентов. Анализ полученных данных показал, что у всех пациентов данной выборки в течение всего периода комплексной терапии возникло 2 побочные реакции (аллергические), что свидетельствует о безопасности данного лекарственного средства.
Ритмокор продемонстрировал выраженный антиаритмический эффект у пациентов с ДТЗ. Так, после 10–дневного парентерального введения 15 мл Ритмокора в дополнение к базовым бета–блокаторам статистически значимо уменьшилось количество одиночных и парных суправентрикулярных экстрасистол, а также одиночных желудочковых экстрасистол, регистрируемых на ЭКГ (рис. 3, табл. 5). Статистически значимая разница в количестве данных нарушений ритма наблюдалось и на 2–м и 3–м визите по сравнению с первичной ЭКГ–оценкой. При этом уровень электролитов и гормонов у пациентов с ДТЗ статистически значимо не изменялся.
При проведении суточного мониторирования ЭКГ нами также отмечен положительный антиаритмический эффект препарата Ритмокор. Прежде всего обращает на себя внимание статистически значимое снижение (нормализация) максимальной частоты сердечных сокращений (ЧСС) за сутки, в дневное и ночное время, а также нормализация средне–суточного значения ЧСС (рис. 4).
Антиаритмический эффект Ритмокора также подтверждается статистически значимым уменьшением общего количества суправентрикулярных и желудочковых экстрасистол, а также в отдельности одиночных, парных и групповых по данным суточного мониторирования ЭКГ (рис. 5, 6).
Для оценки влияния Ритмокора на вегетативный статус был проведен анализ вариабельности ритма сердца до и после применения данного препарата. Одним из наиболее информативных методов оценки вегетативного статуса является исследование вариабельности ритма сердца. Нарушения ВРС могут рассматриваться в качестве предикторов сердечно–сосудистых осложнений. Для оценки вегетативного баланса рассчитывали временные и спектральные показатели ВРС. При анализе полученных данных у больных ДТЗ отмечено статистически значимое снижение спектральных показателей после лечения Ритмокором: в частности, до лечения LF = 1,46 ± 0,19, после — 1,02 ± 0,08 мс ´ 2/Гц и VLF = 1,73 ± 0,14, после — 1,18 ± 0,15 мс ´ 2/Гц, что может свидетельствовать о снижении симпатической активности ВРС после курсового лечения Ритмокором. Такая тенденция демонстрирует характерное смещение симпато–парасимпатического баланса в сторону превалирования симпатического отдела центральной нервной системы и активизации подкоркового парасимпатического центра у пациентов с ДТЗ, несмотря на компенсированный гормональный фон и нормализацию данного –состояния после лечения.
Данные изменения при спектральном анализе ВРС свидетельствуют о гармонизации симпатико–парасимпатического баланса вегетативной нервной системы у данной категории больных после лечения Ритмокором.
1. Hak A.E., Pols H.A., Visser T.J. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: the Rotterdam study. Ann. Intern. Med. 2000. Vol. 132. P. 270–278.
2. Шекера О.Г., Кухарчук Х.М. Рання оцінка розвитку кардіоваскулярної патології у безсимптомних пацієнтів із субклінічним гіпотиреозом. Сімейна медицина. 2018. № 2(76). С. 41–44.
3. Заремба Є.Х., Шатинська–Мицик І.С. Cубклінічний гіпотиреоз: лабораторний феномен чи окрема нозологія? Сучасні препарати та технології. 2010. № 4(70). С. 52–55.
4. Mourouzis I., Forini F., Pantos C., Iervasi G. Thyroid Hormone and Cardiac Disease: From Basic Concepts to Clinical Application. Cere–brovasc. Dis. 2007. № 23 (1). Р. 75–80.
5. Катеренчук В.І., Берегова О.П. Серцево–судинні маски гіпотиреозу. Внутрішня медицина. 2007. № 3 (3). Режим доступу: http://www.mif–ua.com/archive/article_print/419.
6. Гома Т.В., Хамнуева Л.Ю., Орлова Г.М. Поражение сердечно–сосудистой системы при тиреотоксикозе. Сибирский медицинский журнал. 2007. № 3. С. 9–12.
7. Марусенко И.М., Петрова Е.Г. Тирео–токсикоз и фибрилляция предсердий. Рацио–нальная фармакотерапия в кардиологии. 2017. 13(3). С. 398–402. DOI: http://dx.doi.org/10.20996/1819–6446–2017–13–3–398–402.
8. Долженко М.Н. К вопросу о целесообразности применения метаболической кардиопротекции в эпоху доказательной медицины. Мистецтво лікування. 2012. № 2–3(88–89).
9. Zosin I. Значение скрининга для выявления субклинических нарушений функции щитовидной железы. Международный эндо–кринологический журнал. 2009. № 1(19). С. 54–56.
10. Surks M.I., Ortiz E., Daniels G.H. et al. Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. JAMA. 2004. 291(2). Р. 228–238.
11. Компендиум 2018 — лекарственные препараты / Под ред. В.Н. Коваленко. К., 2018.

/m/8-1.jpg)
/m/8-2.jpg)
/m/8-3.jpg)
/m/9-1.jpg)
/m/10-1.jpg)
/m/10-2.jpg)
/m/10-3.jpg)
/m/11-1.jpg)
/m/11-2.jpg)
/m/11-3.jpg)