Журнал «Здоровье ребенка» Том 14, №7, 2019
Вернуться к номеру
Антигістамінні препарати в комплексному лікуванні алергічних захворювань
Авторы: Няньковська О.С.(1), Няньковський С.Л.(1), Камуть Н.В.(1), Никитюк С.І.(2)
(1) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) — Комунальне некомерційне підприємство «Міська дитяча клінічна лікарня», м. Львів, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Мета роботи: вивчити ефективність застосування препарату Едермік у дітей віком від 3 міс. до 7 років при лікуванні атопічного дерматиту та кропив’янки. Матеріали та методи. Під спостереженням знаходились 20 дітей з атопічним дерматитом та 10 дітей з кропив’янкою віком від 3 міс. до 7 років. Діти отримували базову терапію згідно з протоколом МОЗ України, як антигістамінний препарат — Едермік у вигляді пероральних крапель у добовій дозі 0,1 мг/кг маси тіла на добу протягом 15 днів. Результати. Під впливом лікування відзначена позитивна динаміка клінічного стану дітей, що проявилося істотним зменшенням тяжкості атопічного дерматиту за шкалою SCORAD (з 64,4 до 19 балів), зниженням рівня еозинофілів у крові, покращанням стану шкіри (зменшення свербежу, висипу, сухості), зниженням частоти гастроінтестинальної та неврологічної симптоматики. Висновки. Застосування препарату Едермік у комплексному лікуванні алергічних захворювань у дітей сприяє полегшенню перебігу захворювання, зменшенню патологічних змін з боку шкіри та більш швидкому одужанню дітей.
Цель работы: изучить эффективность применения препарата Эдермик у детей в возрасте от 3 мес. до 7 лет при лечении атопического дерматита и крапивницы. Материалы и методы. Под наблюдением находились 20 детей с атопическим дерматитом и 10 детей с крапивницей в возрасте от 3 мес. до 7 лет. Дети получали базовую терапию согласно протоколу МЗ Украины, в качестве антигистаминного препарата — Эдермик в виде пероральных капель в суточной дозе 0,1 мг/кг массы тела на протяжении 15 дней. Результаты. Под влиянием лечения отмечена положительная динамика клинического состояния детей, что проявилось существенным уменьшением тяжести атопического дерматита по шкале SCORAD (с 64,4 до 19 баллов), снижением уровня эозинофилов в крови, улучшением состояния кожи (уменьшение зуда, высыпаний, сухости), снижением частоты гастроинтестинальной и неврологической симптоматики. Выводы. Применение препарата Эдермик в комплексном лечении аллергических заболеваний у детей способствует облегчению течения заболевания, уменьшению патологических изменений со стороны кожи и более быстрому выздоровлению детей.
Background. To investigate the effectiveness of Edermik in children aged from 3 months to 7 years old for the treatment of atopic dermatitis and urticaria. Materials and methods. We examined 20 children with atopic dermatitis and 10 children with urticaria aged from 3 months to 7 years old. The children received background therapy according to the protocol of the Ministry of Health of Ukraine as well as Edermik as an antihistamine, oral drops at the day dosage of 0.1 mg/kg of body mass within 15 days. Results. The treatment contributed to positive dynamics of the clinical condition of children in the form of significant reduction of atopic dermatitis severity by SCORAD (from 64.4 to 19 scores), decrease in blood eosinophils, improvement in skin condition (itching, rash, dry skin), reduction of incidence of gastrointestinal and neurologic symptoms. Conclusion. The usage of Edermik for the complex treatment of allergic diseases contributes to the decrease in the pathology severity, reduction of skin lesions, acceleration of the convalescence of children.
діти; атопічний дерматит; кропив’янка
дети; атопический дерматит; крапивница
children; atopic dermatitis; urticaria
Вступ
За останні десятиліття алергія зайняла провідне місце у списку найбільш поширених захворювань у світі. На конгресі Європейської академії алергології і клінічної імунології (ЕААСІ-2019) було зазначено, що найбільше зростання захворюваності на алергію спостерігається саме в дитячій популяції. За даними досліджень, частота атопічних захворювань серед дорослого населення в розвинених країнах становить 10–30 %, із них приблизно 80 % людей з атопією мають сімейну історію алергії [1]. До найбільш поширених і тяжких за клінічним перебігом алергічних захворювань, що, як правило, розпочинаються в дитячому віці, належить атопічний дерматит (АД), який щорічно вперше діагностують майже в 1 млн осіб [2]; захворюваність серед дітей становить приблизно 20 % [3].
Динамічне дослідження поширеності алергічних захворювань серед населення України (було охоплено понад 100 тис. осіб) показало, що протягом 10 років (із 1981 до 1991 р.) поширеність атопії в нашій країні зросла з 6,03 до 9,28 % і в 2010 р. склала 25 % [4, 5].
АД, або атопічна екзема, — це хронічне запальне або хронічно-рецидивуюче запальне захворювання шкіри, яке передбачає взаємодію імунних, генетичних та екологічних збудників, часто зустрічається в сім’ях з іншими атопічними захворюваннями (гастроінтестинальні розлади, бронхіальна астма та/або алергічний ринокон’юнктивіт) [6].
Розвиток АД на сучасному етапі розглядають як наслідок складних взаємодій генетичних факторів, оточуючого середовища, інфекційних агентів, дефектів бар’єрної функції шкіри та порушень імунологічної відповіді [7–9]. Цьому захворюванню властивий поліморфізм клінічних форм ураження шкіри, стадійність перебігу й розвиток супутніх патологічних змін із боку різних органів та систем організму. Клінічний перебіг АД в дитячому віці характеризується певними особливостями, що потребує індивідуального підходу до діагностики та лікування цього захворювання, з обов’язковим урахуванням форми, стадії, тяжкості шкірного ураження, наявності респіраторних симптомів, супутніх захворювань, віку пацієнта, стану імунної системи [10–12].
Питання ведення пацієнтів з АД регламентовані в Україні відповідною клінічною настановою, яка ґрунтується на даних світової доказової медицини. Безперечно, найефективнішою є етіотропна терапія, спрямована на усунення контакту з факторами, які спричиняють загострення захворювання. Проте АД лише в 30–40 % дітей пов’язаний з харчовою алергією, тому елімінаційна дієта далеко не завжди є ефективною при цій патології. Ранній початок і доволі значний поліморфізм проявів захворювання обумовлюють необхідність індивідуального підходу в кожному окремому випадку, застосування профілактичних заходів у групах дітей з підвищеним ризиком захворювання. Адекватна вторинна профілактика АД покликана зменшити не лише поширеність, а й тяжкість його перебігу, підвищити ефективність лікувальних заходів, що в цілому має покращити якість життя таких пацієнтів [13–15].
Доведено, що провідна роль у розвитку хронічного алергічного запалення належить першому реагінзалежному типу алергічних реакцій за класифікацією P. Gell, R. Coombs (1968), що характеризується гіперпродукцією реагінових антитіл (IgE) у відповідь на звичайний контакт із поширеними алергенами зовнішнього середовища [16, 17]. Упродовж останніх років погляди на атопію й зумовлені нею алергічні хвороби суттєво змінилися. Доведено, що провідну роль у розвитку IgE-опосередкованої патології відіграє хелперна субпопуляція Т-лімфоцитів (Th2-алергенспецифічні CD4+ Т-клітинні клони), яка надмірно активується внаслідок суттєвого зниження супресії (дефіцит Тh1-алергенспецифічних CD8+ Т-клітинних клонів) [18]. Дослідження показали, що на мастоцитах і базофілах експресований особливий високоафінний рецептор до IgE — FcRI. Важливо, що зв’язування IgE з цим рецептором відбувається ще до їх зустрічі з антигеном, що відрізняє IgE від антитіл, які відносяться до імуноглобулінів інших класів і їх зв’язків із клас-специфічними рецепторами FcR [19]. При потраплянні розчинного алергену у внутрішнє середовище організму він швидко зв’язується з фіксованим на базофілах тканин і крові IgE [20]. Унаслідок цього відбувається ушкодження фосфоліпідів клітинних мембран, починається надходження іонів кальцію всередину клітини й вивільнення медіаторів. Далі активуються Th2, які починають секретувати інтерлейкіни (IL) — IL-4, IL-6, IL-10, IL-13, що веде до подальшого збільшення утворення специфічних IgE-антитіл, які, у свою чергу, фіксуються на мастоцитах (тканинні базофіли) і базофілах крові [21]. Медіатори, що вивільняються з базофілів тканин і крові, умовно можна поділити на дві групи. Першу групу складають речовини, які містяться у гранулах цих клітин: гістамін, еозинофільний і нейтрофільний хемотаксичний фактори, протеази. Друга група медіаторів утворюється у процесі активації базофілів під час алергічної реакції. Активація цих клітин веде до утворення активної форми фосфоліпази А2, яка, у свою чергу, призводить до відщеплення арахідонової кислоти з фосфоліпідів клітинної мембрани. Вільна арахідонова кислота метаболізується двома шляхами — циклооксигеназним з утворенням простагландинів і ліпоксигеназним з утворенням лейкотрієнів С4, D4, Е4, В4 [22]. Окрім того, в активованих мастоцитах індукується тромбоцитоактивуючий фактор та інші цитокіни — TNF, IL-1, IL-4, IL-5, IL-6, IL-8, IL-3, GM-CSF, секретуються особливі протеази — триптаза, хімаза, карбоксипептидаза і катепсин G [23]. Саме медіатори базофілів тканин і крові забезпечують виникнення клінічних симптомів і синдромів алергічних реакцій негайного типу, викликаючи ушкодження тканин системно або місцево через вазодилатацію, скорочення гладкої мускулатури бронхів, гіперсекрецію на слизових оболонках, локальний протеоліз [24]. Якщо алерген швидко не елімінується, до зони алергічної реакції притягуються інші клітини (еозинофіли, нейтрофіли). Паралельно з Th2 виділяються цитокіни (IL-3, IL-5, гранулоцитарно-макрофагальний колонієстимулюючий фактор), які також сприяють переміщенню в шоковий орган активних мігруючих клітин. Ці новоприбулі до зони алергічної реакції клітини (еозинофіли, нейтрофіли, макрофаги) також піддаються стимуляції і виділяють специфічні медіатори (лейкотрієни, простагландини, тромбоксан, фактор активації тромбоцитів) та токсичні протеїни, що ще більше посилює запальний процес і сприяє хронізації запалення [25].
Одним із важливих лікарських засобів у комплексному лікуванні алергічних захворювань шкіри та інших сверблячих дерматозів є антигістамінні препарати [2, 3, 14]. Антигістамінні препарати блокують Н1-рецептори, але не перешкоджають вивільненню гістаміну. Оскільки ефект гістаміну доповнюється діями інших медіаторів запалення, застосування антагоніста тільки одного медіатора, тобто гістаміну, не гарантує ліквідації або зменшення симптомів алергічного захворювання. Вважається, що значного ефекту від застосування антигістамінних препаратів можна досягти, приймаючи їх з профілактичною метою, тобто безпосередньо перед дією алергену, коли вони блокують Н1-рецептори ще до вивільнення гістаміну [3].
Фармакологічні властивості диметиндену малеату (Едермік), який є антагоністом гістаміну на рівні Н1-рецепторів, справляє стимулюючу дію на гістамінметилтрансферазу, що призводить до інактивації гістаміну. Він проявляє високу спорідненість з Н1-рецепторами і є стабілізатором тучних клітин, що дозволяє ефективно використовувати його при лікуванні алергічних захворювань у дітей. На Н2-рецептори диметиндену малеат не впливає, має місцевоанестезуючі властивості.
Диметинден малеат є антагоністом брадикініну, серотоніну та ацетилхоліну. Існує у вигляді рацемічної суміші з R-(–)-диметинденом, який має більш виражену Н1-антигістамінову активність. Значно знижує надмірну проникність капілярів, що пов’язана з реакціями гіперчутливості негайного типу.
Системна біодоступність диметиндену у формі крапель становить приблизно 70 %. Початкова відповідь організму на препарат очікується протягом 30 хвилин після прийому, максимальна відповідь — протягом 5 годин. Після прийому крапель максимальна концентрація диметиндену в плазмі крові досягається протягом 2 годин. Період його напіввиведення становить майже 6 годин. Диметинден і його метаболіти виводяться печінкою та нирками.
Більшість антигістамінних препаратів використовується в дітей віком понад 2 роки, у той час як Едермік дозволено застосовувати в дітей з віку 1 місяць, що має велике значення з огляду на той факт, що АД у більшості дітей стартує на першому році життя. Крім того, оптимальними лікарськими формами для дітей раннього віку є сиропи та краплі. Едермік випускається у формі крапель (20 крапель = 1 мл = 1 мг диметиндену малеату), що забезпечує зручність та точність дозування. Краплі Едермік мають приємний смак, їх можливо додавати в пляшечку з дитячим харчуванням безпосередньо перед годуванням, запобігаючи впливу високих температур, а також можливо застосовувати в нерозведеному вигляді, з ложечки, якщо дитина знаходиться на грудному вигодовуванні. Рекомендована добова доза становить 0,1 мг (тобто 2 краплі) на 1 кг маси тіла на добу, розподілена на 3 прийоми.
Мета роботи: вивчити ефективність застосування препарату Едермік у дітей віком від 3 міс. до 7 років із діагнозом атопічного дерматиту чи кропив’янки.
Матеріали та методи
Під нашим спостереженням знаходились 30 дітей віком від 3 міс. до 7 років, із них 20 дітей з атопічним дерматитом (АД) та 10 дітей з кропив’янкою.
Антигістамінний препарат диметинден малеат (Едермік) призначали у вигляді пероральних крапель у добовій дозі 0,1 мг (2 краплі) на 1 кг маси тіла; доза була розділена на 3 прийоми. Курс лікування становив 15 днів. Закінчили спостереження 30 дітей. Призначення препарату проводили на фоні базової терапії, яка включала рекомендації щодо режиму, дієти, догляду за шкірою та лікування згідно з чинним протоколом.
Критерії включення: діти віком від 3 міс. до 7 років із діагнозом атопічного дерматиту чи кропив’янки. Батьки дітей дали згоду на отримання препарату й на повторний огляд і обстеження під час та після закінчення терапії.
Критерії виключення: непереносимість препаратів або їх компонентів; недотримання протоколу призначеної терапії; наявність тяжких супутніх захворювань, вроджених вад розвитку чи гострої інфекційної патології.
Оцінку ефективності застосування препарату Едермік проводили за допомогою анкетно-опитувальних та клінічних методів обстеження. Для клінічної характеристики хворих на атопічний дерматит ми використовували шкалу атопічного дерматиту SCORAD (Scoring of Atopic Dermatitis). Стан пацієнта оцінювали на початку спостереження, через 5, 10 та 15 днів.
У всіх дітей на початку спостереження та через 15 днів визначали рівень загального IgE та кількість еозинофілів. Також проводили збір алергологічного анамнезу (визначали наявність обтяженої спадковості), уточнювали наявність реакцій на продукти харчування, медикаменти тощо, звертаючи особливу увагу на особливості догляду за шкірою та спектр засобів зовнішньої терапії, характер житлово-побутових умов. Брали до уваги скарги, анамнез захворювання (тривалість, частота загострень, імовірні провокуючі фактори, особливості перебігу, ефективність застосованих методів лікування) та життя (перенесені захворювання, характер вигодовування на першому році та впродовж життя), наявність супутньої патології. Симптоми та скарги оцінювали згідно з показниками ступеня вираженості, де 0 — симптому немає, 1 — незначний ступінь, 2 — значний ступінь вираженості. Діти проходили обстеження й лікування на базі педіатричного відділення КМДКЛ м. Львова.
Результати та обговорення
Для клінічної характеристики дітей з АД (20 дітей) ми використовували шкалу тяжкості атопічного дерматиту SCORAD (Scoring of Atopic Dermatitis). На початку терапії з легким перебігом атопічного дерматиту (індекс до 25) було 3 дитини (15 %), середньої тяжкості за шкалою SCORAD (індекс 25–50) — 14 дітей (70 %), із тяжким перебігом атопічного дерматиту (індекс понад 50) — 3 дитини (15 %) (табл. 1).
Якщо на початку спостереження в більшості дітей (85 %) загальний стан розцінювався як тяжкий або середньої тяжкості, то протягом 2 тижнів лікування ми відзначили чітку позитивну динаміку. При фінальній оцінці в 95 % дітей індекс тяжкості АД за шкалою SCORAD відповідав легкому перебігу й тільки в однієї дитини (5 %) він залишався в межах середньої тяжкості.
У нашому дослідженні ми відмітили позитивну динаміку показника за шкалою SCORAD у групі дітей з атопічним дерматитом. Так, на початку спостереження середній бал за шкалою SCORAD становив 36,3 бала, через 5 днів — 25 балів, через 10 днів — 20 балів, а через 15 днів зменшився до 11,6 бала (рис. 1).
Викликав інтерес той факт, що рівень загального IgE фактично не корелював із ступенем тяжкості АД. Діти з легким, середнім і тяжким перебігом мали доволі різні рівні IgE (табл. 2).
Дещо інша картина спостерігалась у групі дітей з кропив’янкою. Так, на початку спостереження, перед застосуванням диметиндену малеату, рівень загального IgE у середньому становив 246 Од/мл. Через 15 днів лікування він істотно зменшився і складав 54,1 Од/мл. Натомість у групі дітей з атопічним дерматитом середній рівень загального IgE на початку спостереження був значно нижчим порівняно з дітьми з кропив’янкою і становив 68,8 Од/мл, через 15 днів його рівень зменшився до 18,2 Од/мл (рис. 2).
Дещо подібна ситуація спостерігалась і з рівнем еозинофілів у крові. Так, перед застосуванням препарату Едермік середній рівень еозинофілів у крові дітей з кропив’янкою був 17,6 % і через 15 днів зменшився до 5,1 %; у групі дітей з АД — 13,2 і 5,5 % відповідно (рис. 3).
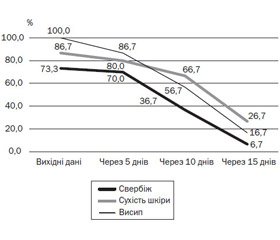
100 % дітей, як з атопічним дерматитом, так і з кропив’янкою, надійшли до лікарні з висипом, який зменшувався впродовж 15 днів лікування. Так, через 15 днів застосування препарату Едермік висип спостерігався лише в 16,7 % дітей. Свербіж шкіри на початку терапії спостерігався в 73,3 % дітей, а через 15 днів — у 6,7 % дітей. Сухість шкіри до початку лікування відзначали у 86,7 % дітей, а через 15 днів — у 26,7 % дітей з атопічним дерматитом (рис. 4).
На початку спостереження в 29 дітей (96,7 %) спостерігалася різноманітна помірна гастроінтестинальна та неврологічна симптоматика. Зокрема, нестійкі випорожнення без температури — у 16,7 % дітей обох груп, коліки — у 33,3 % дітей; здуття живота — у 33,3 % дітей, зригування — у 13,3 % дітей, закрепи — у 10 % дітей, неспокій — у 53,3 % дітей, поганий, переривчастий сон — у 43,3 % дітей, голосний плач — у 16,7 % дітей. Під час лікування ми спостерігали чітке зменшення цієї симптоматики. При останньому обстеженні тільки в однієї дитини спостерігались коліки (3,3 %), ще в однієї — поганий сон (3,3 %) (табл. 3).
Таким чином, застосування препарату Едермік у комплексі лікування дітей з атопічним дерматитом у фазі загострення та у дітей з кропив’янкою дозволяє ефективно покращити загальний стан дитини, зменшити клінічні прояви ураження шкіри за бальною оцінкою з використанням шкали SCORAD, знизити рівень загального IgE та еозинофілів у крові. Відзначена чітка позитивна динаміка щодо зменшення шкірного висипу, сухості шкіри, свербежу, неспокою. У дітей груп обстеження покращився сон, зменшились гастроінтестинальні розлади, такі як закрепи, діарейний синдром без температури, коліки, здуття живота та зригування.
Висновки
Результати проведеної оцінки ефективності препарату Едермік дозволяють зробити висновок, що застосування диметиндену малеату в дітей віком від 3 міс. до 7 років із діагнозом атопічного дерматиту чи кропив’янки впродовж 15 днів у розділеній на 3 прийоми добовій дозі 0,1 мг (2 краплі) на 1 кг маси тіла на добу сприяє зниженню рівня загального IgE та еозинофілів у крові, зменшенню тяжкості загострення атопічного дерматиту за даними шкали SCORAD, покращанню клінічної симптоматики та стану дітей.
Конфлікт інтересів. Не заявлений.
1. Angel A. Justiz Vaillant, Arif Jan. Atopy. StatPearls Publishing. 2019 Jan.
2. Wollenberg A., Oranje A., Deleuran M., Simon D., Szalai Z., Kunz B., Svensson A., Barbarot S., von Kobyletzki L., Taieb A. et al. TFAD/EADV Eczema task force 2015 position paper on diagnosis and treatment of atopic dermatitis in adult and paediatric patients. J. Eur. Acad. Dermatol. Venereol. 2016 May. 30 (5). 729-47. Epub 2016 Mar 23.
3. Wollenberg A., Barbarot S., Bieber T., Christen-Zaech S., Deleuran M., Fink-Wagner A., Gieler U., Girolomoni G., Lau S., Muraro A. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J. Eur. Acad. Dermatol. Venereol. 2018 Jun. 32 (6). 850-878.
4. Недельська С.М., Ярцева Д.О., Мазур В.І. та ін. Алергічний риніт та бронхіальна астма пилкової етіології у дітей: ретроспективне дослідження клінічного перебігу. Современная педиатрия. 2013. № 1. С. 24-29.
5. Наумова О.О. Підвищення якості діагностики та прогнозування ефективності лікування хворих на сезонний алергічний риніт на основі використання молекулярної алергодіагностики: Автореф. дис. на здобуття наук. ступеня канд. мед. наук: спец. 14.01.21 «Клінічна імунологія». Київ, 2015. 20 с.
6. Mesquita K., Colombini M., Duarte G., Ferreira S.B., Yang A., Mallozi M., Lupi O., Guidacci M., Abreu D., Paiva H. Unveiling atopic dermatitis burden in Brazil: a report from clinical assistance perspective. JBES: Brazilian Journal of Health Economics. Aug 2019. Vol. 11. Issue 2. Р. 153-160.
7. Bin L., Leung D.Y.M. Genetic and epigenetic studies of atopic dermatitis. Allergy Asthma Clin. Immunol. 2016. 12. 52. doi: 10.1186/s13223-016-0158-5.
8. Brunner P.M., Silverberg J.I., Guttman-Yassky E., Paller A.S., Kabashima K., Amagai K. et al. Increasing comorbidities suggest that atopic dermatitis is a systemic disorder. J. Invest. Dermatol. 2017. 137. 18-25. doi: 10.1016/j.jid.2016.08.022.
9. McAleer M.A., Jakasa I., Raj N. et al. Early life regional and temporal variation in filaggrin-derived natural moisturising factor, filaggrin processing enzyme activity, corneocyte phenotypes and plasmin activity: implications for atopic dermatitis. Br. J. Dermatol. 2018. 179. Р. 431-441.
10. Brunner P.M., Leung D.Y.M., Guttman-Yassky E. Immunologic, microbial, and epithelial interactions in atopic dermatitis. Ann. Allergy Asthma Immunol. 2018. 120. Р. 34-41.
11. Vandervoort R. Allergy and Asthma: Anaphylaxis. FP Essent. 2018 Sep. 472. Р. 20-24.
12. Czarnowicki T., Krueger J.G., Guttman-Yassky E. Novel concepts of prevention and treatment of atopic dermatitis through barrier and immune manipulations with implications for the atopic march. J. Allergy Clin. Immunol. 2017. 139. Р. 1723-34. doi: 10.1016/j.jaci.2017.04.004.
13. Jihyun K., Byung E.K., Leung D.Y.M. Pathophysiology of atopic dermatitis: Clinical implications. Allergy Asthma Proc. 2019 Mar. 40 (2). Р. 84-92.
14. Lowe A.J., Leung D.Y.M., Tang M.L.K., Su J.C., Allen K.J. The skin as a target for prevention of the atopic march. Ann. Allergy Asthma Immunol. 2018 Feb. 120 (2). Р. 145-151.
15. Наказ Міністерства охорони здоров’я України від 04.07.2016 № 670 «Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги. Атопічний дерматит».
16. Ameli F., Brocchetti F., Tosca M.A. et al. Adenoidal hypertrophy and allergic rhinitis: is there an inverse relationship? Am. J. Rhinol. Allergy. 2013. Vol. 27. № 1. Р. e5-е10.
17. Gelardi M., Passalacqua G., Fiorella M.L., Quaranta N. Assessment of biofilm by nasal cytology in different forms of rhinitis and its correlations. Eurор. Ann. Allergy Clin. Immunol. 2013. Vol. 45. № 1. Р. 25-29.
18. Doherty T.A., Scott D., Walford H.H. et al. Allergen challenge in allergic rhinitis rapidly induces increased peripheral blood ILC2 which express CD84. J. Allergy Clin. Immunol. 2014. Vol. 133. № 4. Р. 1203-1205.
19. Westman M., Lupinek C., Bousquet J. et al. Early childhood IgE reactivity to pathogenesis-related class 10 proteins predicts allergic rhinitis in adolescence. J. Allergy Clin. Immunol. 2015. Vol. 135. № 5. P. 1199-1206.
20. Wu Yu-Chang B., James K.L., Vander Heiden A.J. et al. Influence of seasonal exposure to grass pollen on local and peripheral blood IgE repertoires in patients with allergic rhinitis. J. Allergy Clin. Immunol. 2014. Vol. 134. № 3. P. 604-612.
21. Недельская С.М., Кузнецова Е.Д. Показатели иммунного статуса у детей с гиперчувствительностью к плесневым грибам. Здоровье ребенка. 2008. № 5. С. 75-78.
22. Ненашева Н.М. Бронхиальная астма и сопутствующие заболевания: в фокусе аллергический ринит. Практическая пульмонология. 2014. № 1. С. 1-8.
23. Куценко Н.Л., Ізмайлова О.В., Весніна Л.Е. та ін. Спектр алерген-специфічних IgE серед полтавської популяції та залежність їх синтезу від наявності поліморфізмів Toll-подібних рецепторів. Одеський мед. журн. 2014. № 3. С. 9-14.
24. Dranitsaris G., Ellis A.K. Sublingual or subcutaneous immunotherapy for seasonal allergic rhinitis: an indirect analysis of efficacy, safety and cost. J. Evaluation Clin. Practice. 2014. Vol. 20. № 3. Р. 225-238.
25. Прилуцкий А.С., Кайдашев И.П., Проценко Т.В. и др. Определение специфического IgE к различним аллергенам. Клінічна імунологія. Алергологія. Інфектологія. 2011. № 2, спецвипуск. С. 80-82.

/37-1.jpg)
/38-3.jpg)
/38-1.jpg)
/38-2.jpg)
/39-1.jpg)