Международный эндокринологический журнал Том 15, №6, 2019
Вернуться к номеру
Корекція ендотеліальної дисфункції та порушень мікроциркуляції в пацієнтів із критичною ішемією нижніх кінцівок та високим ризиком розвитку реперфузійно-реоксигенаційних ускладнень
Авторы: Колотило О.Б.
Вищий державний навчальний заклад України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Епідеміологічні дослідження свідчать, що критична ішемія нижніх кінцівок трапляється в 500–1000 пацієнтів на один мільйон населення на рік. В Україні щорічно проводиться близько 10 000 реконструктивних операцій із приводу оклюзійних уражень артерій нижніх кінцівок. Одночасно щорічно виконується близько 8–10 тис. ампутацій нижніх кінцівок на ґрунті атеросклерозу. Метою дослідження було вивчення можливості корекції ендотеліальної дисфункції та порушень мікроциркуляції в пацієнтів із хронічною критичною ішемією нижніх кінцівок та високим ризиком розвитку реперфузійно-реоксигенаційних ускладнень після реконструктивних операцій. Матеріали та методи. В основу роботи покладено аналіз комплексного обстеження та хірургічного лікування 220 хворих на облітеручий атеросклероз аорти та магістральних артерій нижніх кінцівок. Ендотеліальну дисфункцію оцінювали шляхом визначення рівня маркерів: Р-селектину, Е-селектину, тканинного активатора плазміногену, ендотеліну-1, молекули адгезії судинного ендотелію 1-го типу, циркулюючих ендотеліальних клітин. Результати. Порівнюючи рівень ендотеліальної дисфунції та стан мікроциркуляції в ранньому післяопераційному періоді в пацієнтів із спеціальною доопераційною підготовкою й без такої, можна говорити про потребу та ефективність передопераційного застосування бета-блокатора небівололу, інгібітора АПФ периндоприлу аргініну та L-аргініну. Висновки. Застосування в передопераційному періоді бета-блокатора небівололу, інгібітора АПФ периндоприлу аргініну, L-аргініну та сольового гіперосмотичного гіпертонічного розчину декстрану в пацієнтів із високим ризиком реперфузійно-реоксигенаційних ускладнень дає можливість запобігти значним порушенням при розвитку ендотеліальної дисфункції та погіршенню функціонування мікроциркуляторного русла й забезпечити оксигенацію тканин на рівні 5,04 ± ,37 мм рт.ст. після реваскуляризації нижніх кінцівок.
Актуальность. Эпидемиологические исследования показывают, что критическая ишемия нижних конечностей встречается у 500–1000 пациентов на один миллион населения в год. В Украине ежегодно проводится около 10 000 реконструктивных операций по поводу окклюзионных поражений артерий нижних конечностей. Одновременно ежегодно выполняется около 8–10 тыс. aмпутаций нижних конечностей на почве атеросклероза. Целью исследования было изучение возможности коррекции эндотелиальной дисфункции и нарушений микроциркуляции у пациентов с хронической критической ишемией нижних конечностей и высоким риском развития реперфузионно-реоксигенационных осложнений после реконструктивных операций. Материалы и методы. В основу работы положен анализ комплексного обследования и хирургического лечения 220 больных облитерирующим атеросклерозом аорты и магистральных артерий нижних конечностей. Эндотелиальную дисфункцию оценивали путем определения уровня маркеров Р-селектина, Е-селектина, тканевого активатора плазминогена, эндотелина-1, молекулы адгезии сосудистого эндотелия 1-го типа, циркулирующих эндотелиальных клеток. Результаты. Сравнивая уровень эндотелиальной дисфунции и состояние микроциркуляции в раннем послеоперационном периоде у пациентов со специальной дооперационной подготовкой и без таковой, можно говорить о необходимости и эффективности предоперационного применения бета-адреноблокатора небиволола, ингибитора АПФ периндоприла аргинина и L-аргинина. Выводы. Применение в предоперационном периоде бета-блокатора небиволола, ингибитора АПФ периндоприла аргинина, L-аргинина и солевого гиперосмотического гипертонического раствора декстрана у пациентов с высоким риском реперфузионно-реоксигенационных осложнений позволяет предотвратить значительные нарушения при развитии эндотелиальной дисфункции и ухудшение функционирования микроциркуляторного русла и обеспечить оксигенацию тканей на уровне 5,04 ± 0,37 мм рт.ст. после реваскуляризации нижних конечностей.
Background. Epidemiological studies show that critical ischemia of the lower extremities occurs in 500–1,000 patients per million population per year. About 10,000 reconstructive operations are performed annually in Ukraine for occlusive arterial lesions of the lower extremities. At the same time, about 8–10 thousand amputations of the lower extremities due to atherosclerosis are performed annually. The objective was to study the possibility of correcting endothelial dysfunction and microcirculation disorders in patients with chronic critical lower limb ischemia and a high risk of reperfusion-reoxygenation complications after reconstructive operations. Materials and methods. The work is based on an analysis of a comprehensive examination and surgical treatment of 220 patients with obliterated atherosclerosis of the aorta and main arteries of the lower extremities. Endothelial dysfunction was assessed by determining the level of the following markers: P-selectin, E-selectin, tissue plasminogen activator, endothelin-1, vascular cell adhesion molecule 1, circulating endothelial cells. Results. Comparing the severity of endothelial dysfunction and the state of microcirculation in the early postoperative period in patients with and without special preoperative preparation, it is possible to state the necessity and effectiveness of the preoperative use of nebivolol beta-blocker, angiotensin-converting enzyme inhibitor perindopril arginine and L-arginine. Conclusions. The use of beta-blocker nebivolol, angiotensin-converting enzyme inhibitor perindopril arginine, L-arginine and saline hyperosmotic hypertonic dextran solution in the preoperative period in patients at high risk of reperfusion-reoxygenation complications can prevent significant disturbances in the development of endothelial dysfunction and impaired microcirculation and provide tissue oxygenation at the level of 5.04 ± 0.37 mmHg after revascularization of the lower extremities.
реперфузійно-реоксигенаційний синдром; ендотеліальна дисфункція; мікроциркуляторне русло; критична ішемія; реваскуляризація
реперфузионно-реоксигенационный синдром; эндотелиальная дисфункция; микроциркуляторное русло; критическая ишемия; реваскуляризация
reperfusion-reoxygenation syndrome; endothelial dysfunction; microvasculature; critical ischemia; revascularization
Вступ
Епідеміологічні дослідження свідчать, що критична ішемія нижніх кінцівок (КІНК) трапляється у 500–1000 пацієнтів на один мільйон населення на рік [1]. В Україні щорічно проводиться близько 10 000 реконструктивних операцій із приводу оклюзійних уражень артерій нижніх кінцівок. Одночасно щорічно виконується близько 8–10 тис. ампутацій нижніх кінцівок на ґрунті атеросклерозу [2, 4].
Досить високим залишається відсоток летальних наслідків: у ранньому післяопераційному періоді при трансметатарзальній ампутації стопи він досягає 5,0–6,0 %, при ампутаціях гомілки — 5,0–10,0 %, а при високих проксимальних ампутаціях стегна — 10–20 % [3, 7]. Летальність у хворих із КІНК протягом 30 днів після високої екстреної ампутації досягає 25–39 %, протягом двох років — 25–56 %, через 5 років — 50–84 % [4, 12].
Консервативна терапія КІНК базується на комплексі підходів, що враховують етіологічні чинники (атеросклероз, порушення метаболізму циклопентан-пергідрофенантренових сполук, тригліцеридів), патогенетичні чинники (порушення ендотелію, гемокоагуляції, системне запалення) та інші аспекти [5, 14].
Метою дослідження було вивчення можливості корекції ендотеліальної дисфункції та порушень мікроциркуляції в пацієнтів із хронічною критичною ішемією нижніх кінцівок та високим ризиком розвитку реперфузійно-реоксигенаційних ускладнень після реконструктивних операцій.
Матеріали та методи
Дана стаття є фрагментом НДР кафедри хірургії № 2 «Обґрунтування, розробка та впровадження нових методів профілактики та лікування гнійно-септичних захворювань у хірургії з використанням фізичних чинників» (номер 0113U004036).
Стаття написана з дотриманням основних положень GСР (1996 р.), Конвенції Ради Європи про права людини та біомедицину (від 04.04.1997 р.), Гельсінської декларації Всесвітньої медичної асоціації про етичні принципи проведення наукових медичних досліджень за участю людини (1964–2013 рр.), наказу МОЗ України № 690 від 23.09.2009 р., № 616 від 03.08.2012 р., після дозволу комісії із біоетики ВДНЗ України «Буковинський державний медичний університет» (протокол № 3 від 05.04.2019).
В основу роботи покладено аналіз комплексного обстеження та хірургічного лікування 220 хворих на облітеручий атеросклероз аорти та магістральних артерій нижніх кінцівок.
Ендотеліальну дисфункцію оцінювали шляхом визначення рівня маркерів: Р-селектину, Е-селектину, тканинного активатора плазміногену (t-PA), ендотеліну-1, молекули адгезії судинного ендотелію 1-го типу (sVCA M-1), циркулюючих ендотеліальних клітин (ЦЕК).
Концентрацію Р-селектину, Е-селектину, t-PA, sVCA M-1 визначали з використанням наборів фірми Bender MedSystems (Австрія) для імуноферментного аналізу. Концентрацію ендотеліну-1 встановлювали з використанням наборів фірми Biomedica (Канада) для імуноферментного аналізу. Оцінку реакції проводили на мікропланшетному напівавтоматичному фотометрі Sunrise (Tecan, Австрія) за допомогою промивної станції Hydroflex (Tecan, –Австрія) [6].
Для визначення ЦЕК застосували методику J. Hiadovec та Н.Н. Пертищева і співавт. (2001 р.).
Визначали рівні метаболітів оксиду азоту (NO), фактор росту ендотелію судин (VTGF) імуноферментним методом із використанням аналізатора KHGO111 для VTGF та реактиву Грісса — для NO.
Для одержання інформації про зміни капілярного кровотоку й артеріовенулярного шунтування крові застосовували метод лазерної допплерівської флуорометрії за допомогою апарата ЛАКК («ЛАЗМА», Росія). Метод дозволяє оцінити інтегральний кровообіг по капілярах шкіри і поверхнево розміщених артеріолах і венулах. Дослідження проводяться в ділянці основи великого пальця стопи.
Визначали базальний рівень перфузії шкіри (ПШ), концентрацію еритроцитів (КЕ). Рівень перфузії тканин залежить від концентрації еритроцитів і швидкості їх пересування. Швидкість капілярного кровотоку (ШКК) розраховували шляхом ділення рівня ПШ на показник КЕ.
Шкірний перфузійний тиск (ШПТ) визначали за допомогою методу лазерної допплерівської флуорометрії з використанням сфігмоманометричного методу. Для оцінки результатів проводили визначення відношення ШПТ/РСТ (регіонарний систолічний тиск) — індекс шкірного тиску (ІШТ).
Індекс опору мікроциркуляторного русла розраховували за формулою Хагена — Пуазеля як відношення величини перфузійного тиску до інтегральної величини перфузії шкіри.
Результати
З метою запобігання поглибленню ендотеліальної дисфункції та нормалізації стану ендотелію призначали бета-блокатор небіволол, інгібітор АПФ периндоприлу аргінін та L-аргінін. Для корекції порушень мікроциркуляторного русла та нормалізації мікросудинної проникності в передопераційному періоді призначали сольовий гіперосмотичний гіпертонічний розчин декстрану.
Передопераційна підготовка у пацієнтів із високим ризиком розвитку реперфузійного синдрому дає можливість стабілізувати і знизити рівень ендотеліальної дисфункції (табл. 1).
Зокрема, перед хірургічним втручанням уміст у крові ЦЕК знизився на 17,99 % (р < 0,05), Р-селектину — на 18,97 % (р < 0,05), ендотеліну-1 — на 15,62 % (р < 0,05), рівень NO — на 13,92 %. Реваскуляризація нижніх кінцівок сприяє підвищенню рівня ендотеліальної дисфункції за рахунок збільшення вмісту в крові ЦЕК, Р-селектину, ендотеліну-1 відповідно у 2,3 (р < 0,001) раза, в 1,1 (р > 0,05) раза, в 1,7 (р < 0,001) раза.
Водночас зазначене зниження вмісту в крові Е-селектину, NO, VEGF в 1,3 (р < 0,05) раза, в 1,1 (р > 0,05) раза, в 1,2 (р > 0,05) раза відповідно. Зниження вмісту в крові NO, VEGF вказує на те, що передопераційна цілеспрямована підготовка дещо гальмує реперфузійне ушкодження ендотелію.
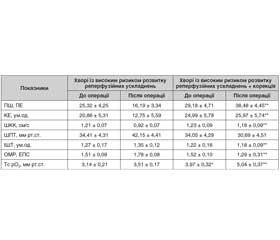
У пацієнтів із спеціальною передопераційною підготовкою після реваскуляризації нижніх кінцівок рівень ПШ у 2,4 раза (р < 0,001), а показник КЕ — у 2,0 раза (р < 0,001) були вищими, ніж аналогічні показники в пацієнтів без цілеспрямованої передопераційної підготовки. Подібне відбувається за умови зниження в 1,3 раза (р < 0,05) показника ШПТ і в 1,3 раза (р < 0,05) — індекса ОМР.
Указаний рівень функціонування мікроциркуляторного русла дав можливість забезпечити оксигенацію тканин на рівні 5,04 ± 0,37 мм рт.ст., що вище в 1,4 раза (р < 0,05) за рівень оксигенації в пацієнтів після хірургічного втручання за умови стандартної доопераційної підготовки.
Порівнюючи рівень ендотеліальної дисфунції в ранньому післяопераційному періоді в пацієнтів із спеціальною доопераційною підготовкою й без такої (табл. 2), можна говорити про потребу та ефективність передопераційного застосування бета-блокатора небівололу та інгібітора АПФ.
У пацієнтів із передопераційною цілеспрямованою підготовкою після реваскуляризації нижніх кінцівок уміст у крові ЦЕК і ендотеліну-1 був нижчим відповідно в 1,3 (р < 0,05) раза, у 2,1 (р < 0,001) раза за їх рівень у пацієнтів із стандартною перед–операційною підготовкою.
Крім того, спеціальна доопераційна підготовка сприяла підвищеному вмісту в крові Р-селектину, Е-селектину, VEGF за незмінної концентрації NO порівняно з рівнем зазначених складових ендотеліальної дисфункції в пацієнтів із звичайною перед–операційною підготовкою після хірургічного втручання.
На доопераційному етапі в пацієнтів із застосуванням спеціальної підготовки відчутних змін показників функціонування мікроциркуляторного русла порівняно з показниками в пацієнтів без цілеспрямованої передопераційної підготовки не виявлено. Однак на післяопераційному етапі не помічено суттєвого погіршення у функціонуванні мікроциркуляторного русла (табл. 3).
Завдяки цілеспрямованій доопераційній підготовці, метою якої було зниження рівня ендотеліальної дисфункції, вдалося запобігти значним порушенням мікроциркуляторного русла (табл. 4).
Обговорення
Реперфузійне ушкодження тканин, активація нейтрофілів супроводжуються адгезією лейкоцитів на поверхні ушкоджених ендотеліальних клітин з утворенням лейкоцитарно-тромбоцитарних конгломератів, що сприяє порушенню мікроциркуляції. Висока адгезивно-агрегаційна здатність лейкоцитів провокує порушення цілості ендотеліального шару, активізує процес згортання крові та сприяє мікротромбоутворенню, посиленню катаболічних процесів і збільшенню клітин швидкого реагування. Ендотеліальна дисфункція призводить до пригнічення механізму регуляції місцевих процесів гемостазу, проліферації й підтримки тонусу судин, як наслідок — поглиблюються порушення мікроциркуляторного русла.
На доопераційному етапі підготовки пацієнта до операційного втручання нами не були застосовані засоби зниження нейтрофільної активності. Під час реваскуляризації нижніх кінцівок активація нейтрофільних лейкоцитів супроводжується адгезією їх на поверхні ушкоджених ендотеліальних клітин з утворенням лейкоцитарно-тромбоцитарних конгломератів, які і спричиняють порушення мікроциркуляції.
Лікування хворих на гнійно-некротичні захворювання нижніх кінцівок, особливо при ускладнених формах, є складним завданням та поєднує комплекс заходів, метою яких є вплив як на організм хворого, так і на збудника [14]. Лікування проводять з урахуванням збудника інфекції, фази та локалізації запального процесу, особливостей загальних і місцевих проявів, що визначає необхідність індивідуалізації лікування, спрямованого на усунення інфекції та гнійного осередку, інтоксикації, компенсацію порушень функцій організму. Гнійно-некротичні захворювання нижніх кінцівок поєднують низку поліморфних патологічних станів (трофічні виразки, гострі активні нагнійні процеси, хронічні інфекційно-запальні процеси, ранові дефекти з персистуючим запаленням, що довго не загоюються, різні за характером, поширеністю та локалізацією некрози тканин стопи), що зумовлюють вживання різних за обсягом і терміновістю лікувальних заходів, до складу яких входить використання антибактеріальних засобів [15]. Узагальнення результатів провідних досліджень вказує на те, що основною причиною виконання таких видів оперативних втручань, що спричиняють утворення тяжких анатомічних дефектів дистальних відділів нижніх кінцівок і значних порушень статокінетичної функції, є прогресування некротичного та інфекційно-запального процесу із залученням великих масивів тканин кінцівки у кількох топографо-анатомічних зонах, що, у свою чергу, зумовлює показання до проведення розширених некректомій та атипових ампутацій стопи.
Висновки
Застосування в передопераційному періоді бета-блокатора небівололу, інгібітора АПФ периндоприлу аргініну, L-аргініну та сольового гіперосмотичного гіпертонічного розчину декстрану в пацієнтів із високим ризиком реперфузійно-реоксигенаційних ускладнень дає можливість запобігти значним порушенням при розвитку ендотеліальної дисфункції та погіршенню функціонування мікроциркуляторного русла й забезпечити оксигенацію тканин на рівні 5,04 ± 0,37 мм рт.ст. після реваскуляризації нижніх кінцівок.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
- Cherniak VA. Surgery of critical ischemia of the lower extremities. UMJ Heart and Vessels. 2013;(41):54-63. (in Ukrainian).
- Hallett JV, Bower TC, Cherry KJ. Selection and preparation of high-risk patients for repair of abdominal aortic aneurysm. Mayo Clin Proc. 1994 Aug;69(8):763-768. doi: 10.1016/s0025-6196(12)61096-9.
- Nikulnikov PI, Ratushnuk AV, Furkalo SN, Guch AA, Liskunov AV. Tactics of treatment of the multifocal atherosclerosis. Actual problems of modern medicine: Bulletin of Ukrainian Medical Stomatological Academy. 2009;9(1):318-321. (in Russian).
- Kalmykov EL, Skrypnik DA, Vinogradov RA, Gaibov AD. 30th Annual Meeting of the European Society for Vascular Surgery (Copenhagen, Denmark, September 28-30, 2016). Angiology and vascular surgery. 2017;23(1):143-147. (in Russian).
- Poluektov LV, Poluektov VL, Dudarev VE. The choice of reconstruction method for multiple occlusive lesions of the brachiocephalic arteries. Angiology and vascular surgery. 2000;6(3):131-135. (in Russian).
- Honcharuk ND. By the method of determining the type of central hemodynamic. Naukovi praci. Tehnogenna bezpeka. 2009;226(238):40-44. (in Russian).
- Horobets NM. New strategic approaches towards correction of endothelial dysfunction. Liky Ukrainy. 2015;(188):20-24. (in Ukrainian).
- Genyk SM, Simchich AV. Reperfusion syndrome after revascularization of the ischemic lower limbs. UMJ Heart and Vessels. 2016;(3):104-108. (in Ukrainian).
- Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med. 2017 May 4;376(18):1713-1722. doi: 10.1056/NEJMoa1615664.
- Strobl FF, Brechtel K, Schmehl J, et al. Twelve-month results of a randomized trial comparing mono with dual antiplatelet therapy in endovascularly treated patients with peripheral artery disease. J Endovasc Ther. 2013 Oct;20(5):699-706. doi: 10.1583/13-4275MR.1.
- Teraa M, Conte MS, Moll FL, Verhaar MC. Critical limb ischemia: current trends and future directions. J Am Heart Assoc. 2016 Feb 23;5(2). pii: e002938. doi: 10.1161/JAHA.115.002938.
- Goshchyhsky VB, Pyatnychka OZ, Migenko BO. Place of the therapeutic neoangyogenesis in critical ischemia treatment of lower limbs. Art of medicine. 2018;(4):44-47. (in Ukrainian).
- Kalinin RE, Pshennikov AS, Suchkov IA. Reperfusion injury of tissues in lower limb arterial reconstructive surgery. Novosti Khirurgii. 2015;23(3):348-352. (in Russian).
- Antoniou GA, Fisher RK, Georgiadis GS, Antoniou SA, Torella F. Statin therapy in lower limb peripheral arterial disease: systematic review and meta-analysis. Vascul Pharmacol. 2014 Nov;63(2):79-87. doi: 10.1016/j.vph.2014.09.001.
- Fakhry F, Spronk S, van der Laan L, et al. Endovascular revascularization and supervised exercise for peripheral artery disease and intermittent claudication: a randomized clinical trial. JAMA. 2015 Nov 10;314(18):1936-44. doi: 10.1001/jama.2015.14851.

/455-1.jpg)
/456-1.jpg)