Международный эндокринологический журнал Том 15, №6, 2019
Вернуться к номеру
Стан мелатонін-асоційованої гормональної системи в дітей із надмірною масою тіла
Авторы: Сорокман Т.В., Макарова О.В., Колєснік Д.І.
ВДНЗ України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Надмірна маса тіла (НдМТ) може бути першим кроком до ожиріння. Для боротьби з цією глобальною пандемією вивчаються механізми, що лежать в основі патогенезу ожиріння і пов’язаних із ним хронічних захворювань. У цьому контексті розглядається дисфункція жирової тканини, що проявляється у вигляді змін профілю адипокінів, секреція деяких із них знаходиться під циркадним контролем. Ця регуляція може бути, принаймні частково, опосередкована мелатоніном. Мета: дослідити стан мелатонін-асоційованої гормональної системи в дітей із надмірною та нормальною масою тіла. Матеріали та методи. Проведено одномоментне епідеміологічне обстеження дитячої популяції 7–18 років під час профілактичних оглядів у школах м. Чернівці та Чернівецької області (936 осіб). Первинний скринінг включав опитування, антропометрію та оцінку фізичного розвитку. Серед 936 осіб відібрано для детального дослідження 60 осіб із надмірною масою тіла. Групу порівняння становили 55 здорових осіб із нормальною масою тіла (НМТ). Діагноз НдМТ встановлювали при індексі маси тіла (ІМТ), який перевищує 85-й перцентиль, але є меншим 95-го перцентиля згідно з віково-статевими номограмами. Нормальну масу тіла діагностували при значеннях ІМТ, які становлять від 5-го до 84-го перцентиля. При оцінюванні сироваткових концентрацій мелатоніну, адипонектину, лептину, резистину й оментину-1 використовували комерційно доступні набори для імуноферментного аналізу на аналізаторі Model 680 Microplate Reader. Статистичний аналіз даних виконано з використанням пакета прикладних програм Statistica 10.0. Результати. Серед осіб із НдМТ переважали хлопчики, кількість яких становила 32 (53,3 %). Надмірна маса тіла найчастіше реєструвалася серед хлопчиків старше 17 років (59,4 %) та у дівчаток 15–16 років (64,2 %, рφ < 0,05). За результатами дослідження встановлено, що діти із НдМТ мають вірогідно нижчі показники мелатоніну та дисбаланс мелатонін-асоційованих гормонів. Показники лептину і резистину знаходилися в межах референсних значень в обох групах та в усіх вікових підгрупах, рівень адипонектину був статистично значимо нижче в пацієнтів із НдМТ, а рівень оментину-1 мав тенденцію до зниження. Гормональний дисбаланс поглиблюється в міру наростання маси тіла. Висновки. Встановлено, що діти із НдМТ мають вірогідно нижчі показники мелатоніну та дисбаланс мелатонін-асоційованих гормонів.
Актуальность. Избыточная масса тела (ИзбМТ) может быть первым шагом к ожирению. Для борьбы с этой глобальной пандемией изучаются механизмы, лежащие в основе патогенеза ожирения и связанных с ним хронических заболеваний. В этом контексте рассматривается дисфункция жировой ткани, проявляющаяся изменениями в профиле адипокинов, секреция некоторых из них находится под циркадным контролем. Эта регуляция может быть, по крайней мере частично, опосредована мелатонином. Цель: исследовать состояние мелатонин-ассоциированной гормональной системы у детей с избыточным и нормальным весом. Материалы и методы. Проведено одномоментное эпидемиологическое обследование детской популяции 7–18 лет во время профилактических осмотров в школах г. Черновцы и Черновицкой области (936 человек). Первичный скрининг включал опрос, антропометрию и оценку физического развития. Среди 936 человек отобраны для детального исследования 60 детей с избыточной массой тела. Группу сравнения составили 55 здоровых лиц с нормальной массой тела (НМТ). Диагноз ИзбМТ устанавливали при индексе массы тела (ИМТ), превышающем 85-й перцентиль, но меньше 95-го перцентиля согласно возрастно-половым номограммам. Нормальную массу тела диагностировали при значениях ИМТ от 5-го до 84-го перцентиля. При оценивании сывороточных концентраций мелатонина, адипонектина, лептина, резистина и оментина-1 использовали коммерческие наборы для иммуноферментного анализа на анализаторе Model 680 Microplate Reader. Статистический анализ данных выполнен с использованием пакета прикладных программ Statistica 10.0. Результаты. Среди лиц с ИзбМТ преобладали мальчики, число которых составляло 32 (53,3 %). Избыточная масса тела чаще регистрировалась среди мальчиков старше 17 лет (59,4 %) и у девочек 15–16 лет (64,2 %, рφ < 0,05). По результатам исследования установлено, что дети с ИзбМТ имеют достоверно более низкие показатели мелатонина и дисбаланс мелатонин-ассоциированных гормонов. Показатели лептина и резистина находились в пределах референсных значений в обеих группах и во всех возрастных подгруппах, уровень адипонектина был статистически значимо ниже у пациентов с ИзбМТ, а уровень оментина-1 имел тенденцию к снижению. Гормональный дисбаланс углублялся по мере нарастания избыточной массы тела. Выводы. Установлено, что дети с ИзбМТ имеют достоверно более низкие показатели мелатонина и дисбаланс мелатонин-ассоциированных гормонов.
Background. Overweight (OW) may be the first step to obesity. The mechanisms underlying the pathogenesis of obesity and chronic diseases associated with it are being studied to combat this global pandemic. In this context, dysfunction of adipose tissue is considered, which manifests itself in the form of changes in the profile of adipokines, the secretion of some of them is under circadian control. This regulation may, at least, be partially mediated by melatonin. Objective: to study the state of the melatonin-associated hormonal system in children with OW and normal weight (NW). Materials and methods. A one-time epidemiological survey of the children population aged 7–18 years was conducted during preventive examinations in schools in Chernivtsi and Chernivtsi region (936 people). Primary screening included questioning, anthropometry, and assessment of physical development. A total of 60 people with OW were selected from 936 individuals for a detailed study. The comparison group included 55 healthy subjects with NW. Diagnosis of OW was established if body mass index was greater than 85th percentile, but less than 95th percentile according to age-sex nomograms. NW was diagnosed with body mass index values ranging from 5th to 84th percentiles. For evaluation of serum concentrations of melatonin, adiponectin, leptin, resistin, and omentin-1, commercially available immunoassay kits for the Model 680 Microplate Reader were used. Statistical data analysis was performed using the Statistica 10.0 application package. Results. Among those with OW, boys were dominant — 32 (53.3 %). OW was most often registered among boys over 17 years of age (59.4 %) and girls aged 15–16 years (64.2 %, pφ < 0.05). According to the study, children with OW have significantly lower melatonin levels and imbalance of melatonin-associated hormones. Leptin and resistin indices were within the reference values in both groups and in all age groups, the level of adiponectin was statistically significantly lower in patients with OW, and the level of omentin-1 tended to decrease. Hormonal imbalance deepens with increasing body mass. Conclusions. It has been established that children with оverweight have significantly lower melatonin levels and imbalance of melatonin-associated hormones.
діти; надмірна маса тіла; мелатонін; адипонектин; лептин; резистин; оментин-1
дети; избыточная масса тела; мелатонин; адипонектин; лептин; резистин; оментин-1
children; overweight; melatonin; adiponectin; leptin; resistin; omentin-1
Вступ
Ожиріння і його медичні наслідки є основними проблемами охорони здоров’я в усьому світі [1–3]. Скорочення поширеності та розробка нових стратегій лікування ожиріння і його медичних ускладнень, безсумнівно, є пріоритетом громадської охорони здоров’я. Немаловажним є той факт, що у більше ніж 60 % хворих ожиріння бере свій початок саме в дитячому віці [4]. Надмірна маса тіла (НдМТ) може бути першим кроком до ожиріння. Для боротьби з цією глобальною пандемією вивчаються механізми, що лежать в основі патогенезу ожиріння і пов’язаних із ним хронічних захворювань. Жирова тканина — це орган, що складається з адипоцитів, матриксу сполучної тканини, нервової тканини, стромоваскулярних клітин і макрофагів [5] та виконує важливу ендокринну функцію і секретує понад 600 біологічно активних молекул — адипокінів [6]. Адипокіни беруть участь у регуляції численних процесів, включаючи ліпідний обмін, апетит і енергетичний баланс, чутливість до інсуліну, ангіогенез, артеріальний тиск, гемостаз і коагуляцію, імунітет і запалення [7].
На 23-му щорічному науковому конгресі Американська асоціація ендокринологів запропонувала розробити нові підходи до діагностики та класифікації ожиріння, які повинні базуватися на наявності та характері ускладнень, пов’язаних із цією патологією [8]. Науковим підґрунтям для створення такої класифікації має стати визначення критеріїв прогресування ожиріння та розвитку його ускладнень залежно від гормональних та метаболічних параметрів. У цьому контексті розглядається дисфункція жирової тканини, що проявляється змінами профілю адипокінів, зокрема у підвищенні рівнів лептину та резистину і зниженні вивільнення адипонектину й оментину-1 [9–12]. Порушення патерну секреції адипокінів було пов’язано із хронічним запальним станом і підвищеним оксидативним стресом, які спостерігаються при ожирінні [13]. Багато метаболічних процесів у жировій тканині, включаючи експресію і секрецію деяких адипокінів, знаходяться під циркадним контролем [14, 15]. Ця регуляція може бути, принаймні частково, опосередкована мелатоніном (N-ацетил-5-метокситриптаміном) — індоламіном, що секретується в основному пінеалоцитами і є похідним триптофану. Його синтез/секреція найбільш висока під час темнової фази циклу світло/темрява [16]. Мелатонін є важливим хронобіотиком, який бере участь у регуляції внутрішнього біологічного годинника, що організовує сезонні і циркадні ритми [17]. Як хронобіологічний агент, мелатонін також бере участь у регуляції обміну речовин і енергетичного балансу в організмі [18, 19].
Мета: дослідити стан мелатонін-асоційованої гормональної системи в дітей із надмірною та нормальною масою тіла.
Матеріали та методи
Дослідження здійснювалося в три етапи. На першому етапі проведено одномоментне епідеміологічне обстеження дитячої популяції 7–18 років під час проведення профілактичних оглядів у школах м. Чернівці та Чернівецької області (936 осіб). Вибірка дітей формувалася поетапно в процесі рандомізації методом стратифікованої випадкової 10% репрезентативної вибірки. Первинний скринінг включав опитування, антропометрію (ріст, маса тіла, індекс маси тіла (ІМТ), окружність талії (ОТ), окружність стегон (ОС), співвідношення ОТ/ОС) та оцінку фізичного розвитку. Фізичний розвиток оцінювали за центильними таблицями. Нормальну масу тіла (НМТ) діагностували, керуючись наказом Міністерства охорони здоров’я України від 27.04.2006 р. № 254 в редакції наказу МОЗ України від 03.02.2009 р. № 55 «Про затвердження протоколів лікування дітей з ендокринними захворюваннями». Серед 936 осіб відібрано для детального дослідження 60 осіб із надмірною масою тіла. Групу порівняння становили 55 здорових осіб із нормальною масою тіла. Діагноз НдМТ встановлювали при ІМТ, який перевищує 85-й перцентиль, але є меншим 95-го перцентиля згідно з віково-статевими номограмами. Нормальну масу тіла діагностували при значеннях ІМТ, які становлять від 5-го до 84-го перцентиля.
Зважування проводилося на вагах Bodi Fat Analiser ВF-662W із визначенням процентного вмісту жирової маси. Окружність талії вимірювали маркованою сантиметровою стрічкою на середині відстані від нижнього краю реберної дуги до гребеня клубової кістки, ОС вимірювали на рівні вертлюгів стегнових кісток, точність вимірювання становила 0,005 м. Величину ОТ трактували згідно з центильними номограмами.
Програма детального обстеження на другому етапі складалася з вивчення анамнестичних даних (генеалогічний, соціальний, акушерський анамнез); використовувалися відомості з амбулаторних карт (форма № 112) і історій хвороби (форма № 003/0); за необхідності діти були проконсультовані вузькими спеціалістами — окулістом, неврологом, ендокринологом, алергологом, гастроентерологом, отоларингологом.
Критеріями невключення в дослідження були: НдМТ внаслідок інших ендокринних захворювань (гіпотиреоз, гіперкортицизм, гіпопітуїтаризм і інші види); НдМТ внаслідок травм гіпоталамо-гіпофізарної ділянки, ожиріння внаслідок генетичних синдромів.
Зразки крові збирали вранці (о 8-й годині) після голодування протягом ночі з серединної ліктьової вени в поліпропіленові пробірки (6 мл). Для оцінки сироваткових концентрацій мелатоніну (Cloud-Clone Corp., Х’юстон, Техас, США), адипонектину (Human Adiponectin ELISA, BioVendor, Брно, Чехія), лептину (Human Leptin, ELISA, BioVendor, Брно, Чехія), резистину (Human Resistin, ELISA, BioVendor, Брно, Чехія), оментину-1 (Human Omentin-1 ELISA; BioVendor, Брно, Чехія) використовували комерційно доступні набори для імуноферментного аналізу на аналізаторі Model 680 Microplate Reader та застосовували відповідно до інструкцій виробника.
Клінічне дослідження проводилось із дотриманням передбачених у таких випадках заходів безпеки для здоров’я пацієнта, захисту його прав, людської гідності та морально-етичних норм відповідно до принципів Гельсінської декларації прав людини, Конвенції Ради Європи про права людини і біомедицини, відповідних законів України; дозволу комісії з біоетики ВДНЗ України «Буковинський державний медичний університет», протокол № 2 від 05.03.2019 р.).
Статистичний аналіз даних виконано з використанням пакета прикладних програм Statistica 10.0. Результати подані у вигляді середнього значення і стандартного відхилення (М ± σ). Характер розподілу визначали за допомогою критерію Колмогорова — Смирнова. Для порівняння величин при їх нормальному розподілі використовували t-критерій Стьюдента. Відмінності вважалися статистично значущими при p < 0,05.
Результати
Розподіл дітей за віком та статтю наведений у табл. 1. Серед осіб із НдМТ переважали хлопчики, кількість яких становила 32 (53,3 %). Аналізуючи вік обстежених пацієнтів, ми встановили, що НдМТ найчастіше реєструвалася серед хлопчиків старше 17 років (59,4 %) та у дівчаток 15–16 років (64,2 %, рφ < 0,05).
У 66,6 % випадків у дітей із НдМТ встановлено зміни з боку серцево-судинної системи, у 58,3 % — шлунково-кишкового тракту. Порушення ритму і провідності зареєстровано у 66,6 %, зміни морфометричних параметрів серця — у 58,3 %, артеріальна гіпертензія — у 25 %. Порушення ритму характеризувалися синусовою тахікардією (47,5 %) і тахіаритмією (52,5 %). Порушення провідності — неповною блокадою ніжок пучка Гіса і синдромом ранньої реполяризації шлуночків (12,5 %). У 22,5 % випадків зареєстровані ЕКГ-ознаки навантаження на міокард лівого шлуночка. Зміни морфометричних і гемодинамічних параметрів виявлялися мітральною, трикуспідальною регургітацією і розширенням легеневої артерії при збільшенні діастолічного і систолічного розмірів серця. При проведенні добового моніторування артеріального тиску визначена тенденція до збільшення середнього і мінімального значень систолічного артеріального тиску, індексу артеріальної гіпертензії при порівнянні з показниками дітей із нормальною масою тіла. Найчастіше у дітей із НдМТ траплялися функціональні розлади шлунково-кишкового тракту (51,4 %) та біліарної системи (28,5 %).
За результатами дослідження встановлено, що діти із НдМТ мають вірогідно нижчі показники мелатоніну та дисбаланс мелатонін-асоційованих гормонів (табл. 2).
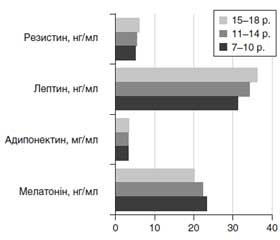
Що стосується вмісту гормонів жирової тканини, то показники лептину і резистину знаходилися в межах референсних значень в обох групах та в усіх вікових підгрупах, однак рівень адипонектину був статистично значимо нижче в пацієнтів із НдМТ, а рівень оментину-1 мав тенденцію до зниження. Визначено також, що в дітей із НМТ з віком рівень мелатоніну знижується (найнижчі показники зареєстровані в дітей 17–18 років — 18,40 ± 0,97 нг/л проти 21,50 ± 0,62 нг/л у дітей 7–8 років; p < 0,05), а вміст адипонектину, лептину, резистину підвищується (рис. 1).
Обговорення
Для більш детального аналізу отриманих результатів пацієнти були проаналізовані за значенням ІМТ, тому що цей чинник здійснює вагомий внесок у зміни спостережуваних нами параметрів. Згідно з рис. 2, у дітей з ІМТ в межах 90–94-го перцентиля показники мелатоніну, адипонектину були дещо нижчими, а інших гормонів жирової тканини — дещо вищими щодо таких у дітей з ІМТ, що знаходиться в 85–89-му перцентилі. Тобто гормональний дисбаланс поглиблюється в міру наростання маси тіла.
Встановлено прямий кореляційний зв’язок між рівнем лептину й ІМТ (r = 0,3706; p < 0,05) і зворотний між мелатоніном (r = –0,7436; p < 0,01), адипонектином (r = –0,4315; p < 0,01) та ІМТ у дітей із надмірною масою тіла. В дослідженнях [17] також встановлена зворотна кореляція між рівнем мелатоніну та індексом маси тіла. В літературі обговорюється питання про те, що мелатонін може бути причетним до патогенезу ожиріння, з урахуванням активації процесів перекисного окислення ліпідів на фоні зниження його секреції [20, 21]. Доведена участь мелатоніну в розвитку аберацій харчової поведінки, зокрема синдрому нічної обжерливості, що відіграє важливу роль у розвитку ожиріння [22]. На сьогодні залишаються дискутабельними питання щодо зв’язку між рівнями циркулюючих гормонів жирової тканини та інсулінемією, чутливістю тканин до інсуліну [23–27].
Мелатонін-асоційовані гормони жирової тканини є потенційними кандидатами на роль маркерів підвищеного ризику розвитку ожиріння та, можливо, коморбідної патології, зокрема серцево-судинних захворювань у пацієнтів із надмірною масою тіла. Однак їх роль у розвитку ожиріння та коморбідної патології все ще залишається дискутабельною.
Висновки
Встановлено, що діти із надмірною масою тіла мають вірогідно нижчі показники мелатоніну та дисбаланс мелатонін-асоційованих гормонів. Розуміння механізмів міжгормонального взаємозв’язку може стати основою для оптимізації діагностично-лікувальних підходів при наданні допомоги пацієнтам із НдМТ, розробки ефективних профілактичних програм для дітей.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
- Ball GDC, Savu A, Kaul P. Changes in the prevalence of overweight, obesity, and severe obesity between 2010 and 2017 in preschoolers: A population-based study. Pediatr Obes. 2019 Nov;14(11):e12561. doi: 10.1111/ijpo.12561.
- Javed A, Jumean M, Murad MH, et al. Diagnostic performance of body mass index to identify obesity as defined by body adiposity in children and adolescents: a systematic review and meta-analysis. Pediatr Obes. 2015 Jun;10(3):234-44. doi: 10.1111/ijpo.242.
- Swinburn BA, Sacks G, Hall KD, et al. The global obesity pandemic: shaped by global drivers and local environments. Lancet. 2011 Aug 27;378(9793):804-14. doi: 10.1016/S0140-6736(11)60813-1.
- Psaltopoulou T, Tzanninis S, Ntanasis-Stathopoulos I, et al. Prevention and treatment of childhood and adolescent obesity: a systematic review of meta-analyses. World J Pediatr. 2019 Aug;15(4):350-381. doi: 10.1007/s12519-019-00266-y.
- Trayhurn P. Adipocyte biology. Obes Rev. 2007 Mar;8 Suppl 1:41-4. doi: 10.1111/j.1467-789X.2007.00316.x.
- Kershaw EE, Flier JS. Adipose tissue as an endocrine organ. J Clin Endocrinol Metab. 2004 Jun;89(6):2548-56. doi: 10.1210/jc.2004-0395.
- Aguilar-Valles A, Inoue W, Rummel C, Luheshi GN. Obesity, adipokines and neuroinflammation. Neuropharmacology. 2015 Sep;96(Pt A):124-34. doi: 10.1016/j.neuropharm.2014.12.023.
- The American Association of Clinical Endocrinologists, American College of Endocrinology. 2014. Available from: https://www.aace.com/files/2014.
- De Ferranti S, Mozaffarian D. The perfect storm: obesity, adipocyte dysfunction, and metabolic consequences. Clin Chem. 2008 Jun;54(6):945-55. doi: 10.1373/clinchem.2007.100156.
- Leal Vde O, Mafra D. Adipokines in obesity. Clin Chim Acta. 2013 Apr 18;419:87-94. doi: 10.1016/j.cca.2013.02.003.
- Ray I, Mahata SK, De RK. Obesity: An Immunometabolic Perspective. Front Endocrinol (Lausanne). 2016 Dec 12;7:157. doi: 10.3389/fendo.2016.00157.
- Vincent HK, Taylor AG. Biomarkers and potential mechanisms of obesity-induced oxidant stress in humans. Int J Obes (Lond). 2006 Mar;30(3):400-18. doi: 10.1038/sj.ijo.0803177.
- Gómez-Santos C, Gómez-Abellán P, Madrid JA, et al. Circadian rhythm of clock genes in human adipose explants. Obesity (Silver Spring). 2009 Aug;17(8):1481-5. doi: 10.1038/oby.2009.164.
- Johnston JD. Adipose circadian rhythms: translating cellular and animal studies to human physiology. Mol Cell Endocrinol. 2012 Feb 5;349(1):45-50. doi: 10.1016/j.mce.2011.05.008.
- Reiter RJ, Tan DX, Galano A. Melatonin: exceeding expectations. Physiology (Bethesda). 2014 Sep;29(5):325-33. doi: 10.1152/physiol.00011.2014.
- Hardeland R, Madrid JA, Tan DX, Reiter RJ. Melatonin, the circadian multioscillator system and health: the need for detailed analyses of peripheral melatonin signaling. J Pineal Res. 2012 Mar;52(2):139-66. doi: 10.1111/j.1600-079X.2011.00934.x.
- Bonnefont–Rousselot D. Obesity and oxidative stress: potential roles of melatonin as antioxidant and metabolic regulator. Endocr Metab Immune Disord Drug Targets. 2014;14(3):159-68. doi: 10.2174/1871530314666140604151452.
- Cipolla-Neto J, Amaral FG, Afeche SC, Tan DX, Reiter RJ. Melatonin, energy metabolism, and obesity: a review. J Pineal Res. 2014 May;56(4):371-81. doi: 10.1111/jpi.12137.
- Walecka-Kapica E, Chojnacki J, Stępień A, Wachowska-Kelly P, Klupińska G, Chojnacki C. Melatonin and female hormone secretion in postmenopausal overweight women. Int J Mol Sci. 2015 Jan 5;16(1):1030-42. doi: 10.3390/ijms16011030.
- Bonnefont-Rousselot D. Obesity and oxidative stress: potential roles of melatonin as antioxidant and metabolic regulator. Endocr Metab Immune Disord Drug Targets. 2014;14(3):159-68. doi: 10.2174/1871530314666140604151452.
- de Luxán-Delgado B, Caballero B, Potes Y, et al. Melatonin administration decreases adipogenesis in the liver of ob/ob mice through autophagy modulation. J Pineal Res. 2014 Mar;56(2):126-33. doi: 10.1111/jpi.12104.
- Tanofsky-Kraff M, Yanovski SZ, Wilfley DE, Marmarosh C, Morgan CM, Yanovski JA. Eating-disordered behaviors, body fat, and psychopathology in overweight and normal-weight children. J Consult Clin Psychol. 2004 Feb;72(1):53-61. doi: 10.1037/0022-006X.72.1.53.
- Mirzayi K, Hossein-Nejad A, Shamari M, Shahbazi S. Evidence of the role of ANGPTL6 in resting metabolic rate and its possible application in the treatment of obesity. Minerva Endocrinol. 2011 Mar;36(1):13-21.
- Schoppen S, Riestra P, García-Anguita A, et al. Leptin and adiponectin levels in pubertal children: relationship with anthropometric variables and body composition. Clin Chem Lab Med. 2010 May;48(5):707-11. doi: 10.1515/CCLM.2010.142.
- Shibata R, Ouchi N, Takahashi R, et al. Omentin as a novel biomarker of metabolic risk factors. Diabetol Metab Syndr. 2012 Jul 26;4(1):37. doi: 10.1186/1758-5996-4-37.
- Wanders D, Plaisance EP, Judd RL. Lipid-lowering drugs and circulating adiponectin. Vitam Horm. 2012;90:341-74. doi: 10.1016/B978-0-12-398313-8.00013-0.
- Halabis M, Dziedzic M, Warchulinska J, Kaznowska-Bystryk I, Solski J. Omentin – a new adipokine with many roles to play. Current Issues in Pharmacy and Medical Sciences. 2015 Sep;28(3): 176-180. doi: 10.1515/cipms-2015-0067.
- Hossein-nezhad A, Mirzaei K, Alatab S, Ahmadivand Z, Najmafshar A. Circulating Omentin-1 in Obesity and Metabolic Syndrome Status Compared to Control Subjects. Endocrinol Metabol Syndrome. 2012;S1:008. doi:10.4172/2161-1017.S1-008.

/471-g.jpg)
/472-1.jpg)