Газета «Новости медицины и фармации» №14 (709), 2019
Вернуться к номеру
Сучасні можливості лікування катетер-асоційованих інфекцій в урологічній практиці з використанням Пембіни-Блю
Авторы: Нікітін О.Д.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Разделы: Клинические исследования
Версия для печати
Проблема профілактики й лікування інфекційних захворювань є однією з пріоритетних у практичному аспекті охорони здоров’я. У загальній структурі хірургічної патології гнійно–запальні процеси посідають одну з лідируючих позицій і спостерігаються в 40–60 % усіх пацієнтів хірургічного профілю [1, 2].
Питання госпітальної інфекції є одним з найбільш актуальних саме в урології. Поширенню нозокоміальних інфекцій у першу чергу сприяють зниження факторів неспецифічної протимікробної стійкості макроорганізму й підвищення резистентності мікроорганізмів в умовах нераціональної антибіотикотерапії. Госпітальна урологічна інфекція разом з катетер–асоційованими інфекціями належить до ускладнених інфекцій сечових шляхів (ІСШ). Пацієнти з уретральними катетерами надзвичайно схильні до розвитку ускладнених ІСШ навіть при застосуванні закритих систем [3].
Дещо менш гостро стоїть питання ІСШ у пацієнтів із цистостомними й нефростомними дренажними трубками, проте й у таких пацієнтів розвиток ІСШ — лише питання часу. За даними останніх досліджень, ризик виникнення ІСШ на фоні носійства уретрального катетера зростає на 4–7,5 % щодня, при цьому до 80 % хворих з катетерами, яким виконується хірургічне втручання, отримують антибактеріальну терапію [8].
Велике значення має структура поверхні катетера, від якої залежить швидкість і характер росту мікробної плівки. Катетер–асоційовані інфекції становлять складність саме тому, що відбувається інфікування антибіотикорезистентними госпітальними штамами. Додатково потрібно враховувати здатність бактерій мігрувати по катетеру й досягати сечового міхура за 1–3 доби [8].
За даними багатьох авторів, частка виникнення перехресного інфікування в умовах стаціонару становить 40 % серед усіх пацієнтів з катетеризованим сечовим міхуром. Водночас більшість штамів Pseudomonas spp., стафілококів і ентерококів, що викликають катетер–асоційовані ІСШ, не є досить вірулентними. Більшість інфекцій, викликаних цими мікроорганізмами, зникають без проведення антибіотикотерапії після видалення катетера й нормалізації уродинаміки [17]. Уваги варте також те, що друге й третє місце за частотою виявлення (після найпоширенішого збудника ІСШ — E.coli) при ускладнених ІСШ посідають Enterococcus spp. і Pseudomonas spp., а при катетер–асоційованих інфекціях — дріжджові гриби, що відсутні при неускладнених інфекціях сечових шляхів. Так, за даними Європейського центру з контролю й запобігання захворюванням 2015 р., найбільш поширеними мікроорганізмами в пацієнтів із катетер–асоційованою інфекцією були E.coli (28 %), Candida sрp. (18 %), Enterococcus spр. (17 %), P.aeruginosa (14 %) і Klebsiella spр. (8 %) [4].
Дослідження етіології інфекційних захворювань у наш час проводилось на основі виявлення чистих культур мікроорганізмів, виділених з патологічного вогнища. Цей традиційний шлях культивування сприяв вивченню бактерій, багатьох аспектів фізіології мікроорганізмів, однак ріст чистої культури у зваженому стані зустрічається в природних умовах вкрай рідко [14]. Зараз основною частиною мікробіологів визнано, що більшість мікроорганізмів у природних і штучно створених навколишніх середовищах існують у вигляді структурованих, прикріплених до поверхні асоціацій — біоплівок.
Біоплівка — мікробна асоціація, що характеризується клітинами, прикріпленими до поверхні або одна до одної та замкненими в матрикс синтезованих ними позаклітинних полімерних речовин, які демонструють зміну фенотипу, що відображається в зміні параметрів росту й експресії специфічних генів [2]. За даними Центру з контролю та профілактики захворювань у США, до 80 % інфекційної патології людини можуть бути пов’язані з формуванням біоплівок. У природних екосистемах біоплівка — майже незмінно багатовидова мікробна асоціація, де кожен мікроорганізм знаходиться у власній мікроніші й входить до складу єдиного матриксу біоплівки. На формування біоплівок при катетер–асоційованих інфекціях впливають: імунний захист пацієнта, заходи профілактики, прийом антибіотиків, а також взаємодія різних мікроорганізмів, що формують спільноту (синергічно чи антагоністично), їх вірулентність і реакція на терапію [4].
Вплив на мікробні біоплівки й лікування асоційованих з ними інфекцій на сьогодні є складною та до кінця не вирішеною задачею.
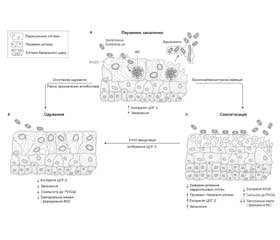
Додаткову актуальність вирішення проблеми біоплівок має для запобігання хронічному циститу. Відома здатність Escherichia coli утворювати всередині поверхневих клітин епітелію сечового міхура під біоплівкою так звані внутрішньоклітинні бактеріальні спільноти. Внутрішньоклітинне розташування й наявність біоплівки робить такі утворення надзвичайно стійкими для терапії антибіотиками й збільшує ризик повторення циститу (рис. 1).
З огляду на складнощі проведення ефективної антибактеріальної терапії хронічних інфекційних процесів, що супроводжуються утворенням біоплівок, стає очевидною зацікавленість факторами, які впливають на процес їх формування, зокрема на процес зв’язування бактерій з епітеліальними клітинами. Необхідність розробки антиадгезивної терапії для боротьби із захворюваннями, викликаними мікробними агентами, є особливо актуальною. Можливість застосування такого підходу зараз інтенсивно вивчається. Подальші дослідження поверхневих вуглеводів людських клітин і бактеріальних лектинів допоможуть отримати більш ефективні інгібітори мікробної адгезії. Однак слід дотримуватись важливої умови: оскільки різноманітні інфекційні агенти, навіть різні бактеріальні клітини в межах одного й того ж штаму, можуть мати широкий спектр вуглеводних властивостей, для запобігання захворюванням або їх лікування, напевно, знадобляться суміші інгібіторів [13].
Терапевтична дія на біоплівки може бути спрямована на механізми першочергової адгезії бактерій до поверхні, блокування синтезу або деструкцію полімерного матриксу, порушення міжклітинного обміну інформацією, а також може поєднуватись із власне бактерицидними агентами. Дана модель лікування, дія якого спрямована на структуру й функцію біоплівок, може виявитись більш ефективною, ніж стандартна антибактеріальна терапія [18].
Виявлена нова ціль для впливу на бактерії з метою підвищення ефективності антибактеріальної терапії — позаклітинна ДНК матриксу біоплівок. Використання ДНК матриксу як додаткової мішені терапії дозволяє підвищити ефективність дії антибіотиків на бактерії різних родин, що входять до складу біоплівок, знизити ймовірність виникнення, поширення й зберігання резистентності до лікарського засобу, скоротити загальну тривалість лікування, зменшити термін перебування пацієнтів у стаціонарі й знизити частоту виникнення рецидивів захворювання [11].
Інший шлях покращення дії антибіотиків на біоплівки — удосконалення форм їх доставки [13]. Відомо, що ліпосомальний комплекс амфотерицину В має виражену активність щодо резистентних біоплівок, продукованих Candida spp., що дозволяє використовувати його при системних інвазивних мікозах [9].
До ферментів, що викликають деструкцію матриксу біоплівки, відносять протеази й дезоксирибонуклеази. Так, використання ДНКази запобігає in vitro утворенню біоплівки представниками роду Staphylococcus і Enterococcus [19]. Доведена ефективність ферменту дисперсин Б при його застосуванні щодо біоплівки S.aureus і S.epidermidis [20]. У даний час проводяться дослідження можливості використання різноманітних антибіоплівкових агентів у клінічній практиці.
Одним з напрямків впливу на біоплівки є використання фізичних факторів. Низка авторів відмічають ефективність імпульсних електричних полів, акустичних ударних хвиль, ультразвуку [12]. Дослідження показали ефективність поєднання антибіотиків та ультразвуку в боротьбі з біоплівками.
Низка наукових робіт вказують на ефективність антимікробних пептидів щодо бактеріальної біоплівки ізолятів P.аeruginosa, виділених від пацієнтів із муковісцидозом [5]. Ці речовини зв’язуються з фрагментами клітинних мембран мікроорганізмів, порушуючи її стабільність. У дослідженнях показано, що деякі пептиди здатні запобігати утворенню біоплівки золотистим стафілококом [11].
На думку багатьох авторів, використання бактеріо–фагів може стати альтернативою використанню антибіотиків у боротьбі з біоплівками [6]. Бактеріофаги спроможні виділяти ферменти, що сприяють деструкції матриксу біоплівки. Крім того, вони викликають лізинг клітин–персистерів, стійких до багатьох агентів. Процес реплікацій бактеріофагів відбувається в бактеріальних клітинах біоплівок, що викликає руйнування їх структури. Проведені дослідження підтвердили ефективність їх застосування в профілактиці утворення біоплівки S.epidermidis і P.аeruginosa на медичному обладнанні [7].
На сьогодні утворення біоплівок госпітальними ізолятами бактерій становить серйозну загрозу для практичної сфери охорони здоров’я. Розробляються нові підходи до ідентифікації й вивчення біоплівок, включно з імунною відповіддю на інфекції, пов’язані з біоплівками, змінюється тактика застосування антибіотиків, а також проводиться пошук інгібіторів міжклітинної сигналізації, ферментів та інших методів руйнування біоплівок.
Одним з варіантів впливу на утворення й руйнування біоплівок є використання хімічних сполук, що поєднують декілька властивостей: накопичуватись у сечі, глибоко проникати в біоплівки й уротелій, а також впливати на збудники. Ці властивості має відома сполука — метилтіонінію хлорид (МХ), або метиленовий синій, що є компонентом відомого європейського препарату Пембіна–Блю.
Метилтіонінію хлорид є індуктором окиснювального стресу. Раніше вважалось, що протигрибкова дія МХ можлива за рахунок зміни окисно–відновного статусу C.albicans [15]. Крім того, МХ застосовувався для того, щоб викликати окисно–відновні процеси в отриманих від людини ендотеліальних клітинах [10]. Проведене більш широке спостереження підтвердило цей ефект МХ проти Candida й Mycobacterium, демонструючи збільшення генерації активних форм кисню. Було досліджено, що оброблені МХ клітини показали вищий рівень флуоресценції порівняно з необробленими клітинами, так само як клітини, оброблені перекисом водню. Крім того, формування активних форм кисню поновлювалось у присутності антиоксиданту в обробленій МХ клітині.
МХ пригнічує формування біоплівки. Біоплівки слугують оборонними системами для мікроорганізмів. У складі біоплівок вони не чутливі до антибіо–тикотерапії й можуть створювати джерела стійкої інфекції. Раніше повідомлялося про гальмування морфогенетичного перемикання під час лікування МХ, що змусило вивчати фактор вірулентності, а саме формування біоплівки [9]. Формування біоплівки вивчалося трьома незалежними методами — це кількісне визначення біоплівки за допомогою тесту МТТ (3–[4,5–диметилтіазол–2–іл]–2,5–дифеніл–тетразолію бромід) із зображенням метаболічної активності, візуалізація забарвленої калькофлуором білим (Calcofluor white) клітини й оцінювання висушеної маси. Усі три методи виявляють значне пригнічення формування біоплівки обох патогенів за наявності МХ. Отже, МХ є потужним інгібітором формування біоплівки C.albicans і M.smegmatis [6] (рис. 2).
На поверхні бичачої емалі культивовано біоплівки з асоціацій Actinomyces viscosus. Фотомеханічна хвиля, згенерована шляхом лазерної абляції, направлена на біоплівку в присутності 50 мкг/мл розчину МХ. Проникаюча здатність МХ вимірювалася за допомогою конфокальної лазерної сканувальної мікроскопії. Надалі біоплівки було опромінено світловою хвилею довжиною 666 нм. Після освітлення бактерії було висіяно на живильне середовище — кров’яний агар. Потім було підраховано кількість колоній бактерій, що виросли.
Методом конфокальної лазерної сканувальної мікроскопії виявлено, що однієї фотомеханічної хвилі достатньо для збільшення глибини проникнення МХ у біоплівку до 75 %. Це збільшило концентрацію МХ у біоплівці й сприяло її фотодеструкції.
З огляду на наведені дані великий інтерес становить використання препарату Пембина–Блю, що утримує у своєму складі МХ, для лікування катетер–асоційованих інфекцій сечових шляхів (КАІСШ).
Метою проведеного дослідження було визначення клініко–лабораторної ефективності використання Пембіни–Блю у хворих із катетер–асоційованими інфекціями сечових шляхів.
Матеріали та методи
Проведено клініко–лабораторне обстеження 58 хворих, у яких було діагностовано катетер–асоційовані інфекції сечових шляхів. 30 хворих основної групи (ОГ) отримували препарат Пембіна–Блю по 1 капсулі двічі на день протягом 1 місяця. 28 хворих групи порівняння (ГП) отримували комбінований рослинний препарат із сечогінним та уроантисептичним ефектом. Середній вік хворих а ОГ становив 37,0 ± 5,7 року, а в ГП — 41,0 ± 7,3 року. Дані про розподіл пацієнтів залежно від характеру патології наведені в табл. 1.
Як видно з табл. 1, в обох групах переважали хворі з уретральними стентами, встановленими з приводу сечокам’яної хвороби (СКХ). У дослідженні брали участь пацієнти, термін стентування яких був понад місяць. 84,2 % хворих ОГ і 82,35 % ГП перенесли оперативні втручання (ендоскопічні або лапароскопічні) з приводу СКХ. У 23,3 % пацієнтів ОГ і 21,4 % хворих ГП проводилось дренування сечового міхура внаслідок гострої затримки сечі при доброякісній гіперплазії простати. 4 хворим ОГ (13,4 %) і 5 хворим ГП (17,9 %) було встановлено нефростомічні дренажі з приводу –субренальної обструкції.
Критеріями оцінки ефективності проведеного лікування були клінічні прояви й лабораторні показники: загальний аналіз сечі й бактеріологічне її дослідження.
Результати дослідження
Результати оцінки клінічної ефективності проведеного лікування у хворих обох груп наведені в табл. 2.
Як свідчать дані табл. 2, застосування препарату Пембіна–Блю призвело до вірогідної зміни таких показників: біль у попереку — з 94,7 до 52,6 %, гематурія — з 89,5 до 42,1 %, лихоманка — з 84,2 до 47,4 %, дизурія — з 78,9 до 68,4 %. На відміну від цього вірогідні зміни в ГП стосувались лише такого показника, як гематурія, — з 88,2 до 58,8 % (рис. 3).
Окремо зупинимось на такому показнику, як субфебрильна лихоманка. В основній групі цей показник змінився вірогідно — з 84,2 до 47,4 %, у групі порівняння — ні (з 82,4 до 70,6 %). Насправді цей показник має велике значення не лише як маркер активності запального процесу, але й як суб’єктивний фактор, що є дуже важливим для оцінки самопочуття хворої людини.
Не менш важливим критерієм для оцінки ефективності лікування була динаміка лейкоцитурії, що подана на рис. 4. Є досить показовим той факт, що використання препарату Пембіна–Блю було більш ефективним щодо антисептичної дії.
Якщо характеризувати динаміку лейкоцитурії в процесі лікування, слід зазначити, що починаючи з 10–ї доби різниця між показником кількості лейкоцитів у полі зору в ОГ та ГП була вірогідною (p < 0,05).
Дані щодо бактеріологічній ефективності є також досить показовими, вони демонструють перевагу лікування з використанням препарату Пембіна–Блю.
Стосовно клінічної ефективності лікування хворих ОГ слід орієнтуватись на дані табл. 4.
Як свідчать дані табл. 4, хворі ОГ оцінили ефективність лікування як найкращу в 76,7 % випадків, як задовільну — у 16,7 %, тобто 93,4 % хворих лишились задоволеними результатами лікування. Не в останню чергу це пов’язано з тим, що прийом Пембіни–Блю не супроводжувався побічними діями, які б призвели до припинення його застосування.
Висновки
Використання Пембіни–Блю у хворих з катетер–асоційованими інфекціями сечових шляхів виявилось ефективним у 86,7 % пацієнтів і привело до вірогідного покращення клінічних і лабораторних показників.
93,4 % хворих оцінили результативність проведеного лікування як найкращу та задовільну, що дає змогу рекомендувати Пембіну–Блю до застосування в пацієнтів з ускладненими інфекціями сечових шляхів.
1. Винник Ю.С., Перьянова О.В., Онзудь Е.В. Микробные биопленки в хирургии: механизмы образования, лекарственная устойчивость, пути рeшения проблемы. Новости хирургии. 2010. № 6. С. 115–122.
2. Гинцбург А.Л., Кузнецов О.Ю. Бактериальная колония как сложное организованное сообщество клеток. Микробиология. 2005. № 2. С. 3–7.
3. Лоран О.Б. Воспалительные заболевания органов мочевой системы. 2008. 88 с.
4. Azevedo A.S. et al. Impact of polymicrobial biofilms in catheter–associated urinary tract infections. Crit. Rev. Microbiol. 2017 Aug. 43(4). 423–439.
5. Hoyle B.D., Williams L.J., Costerton J.W. Production of mucoid exopolysaccharide during development of Pseudomonas аeruginosa biofilm. Infect. Immun. 1993. 61. 777–780.
6. Geller M., Gama C.R.B., Guimarães O.R., Varella R.B., Oliveira L., Fonseca A., De Paoli S., de Paoli F. Recurrent urinary tract infections. 2008. Р. 63–69.
7. Nikaido Н. Multidrug resistance in bacteria. Annual Review of Biochemistry. 2009. Vol. 78. Р. 119–146.
8. Hooton T.M. et al. Diagnosis, Prevention, and Treatment of Catheter–Associated Urinary Tract Infection in Adults: 2009 International Clinical Practice Guidelines from the Infectious Diseases Society of America. Clin. Infect Dis. 2010. 50(5). 625–63.
9. Lee J.A., Robbins N., Xie J.L., Ketela T., Cowen L.E. Functional Genomic Analysis of Candida albicans Adhe–rence Reveals a Key Role for the Arp2/3 Complex in Cell Wall Remodelling and Bioflm Formation. PLoS Genetics. 2016. Vol. 12. № 11. Article ID e1006452.
10. May J.M., Qu Z.–C., Whitesell R.R. Generation of oxidant stress in cultured endothelial cells by methylene blue: Protective efects of glucose and ascorbic acid. Biochemical Pharmacology. 2003. Vol. 66. № 5. Р. 777–784.
11. Tanwar J., Das S., Fatima Z., Hameed S. Multidrugresistance: an emerging crisis. Interdisciplinary Perspectives on Infectious Diseases. 2014. Vol. 2014. Article ID 541340. 7 p.
12. Costerton J.W., Ellis B., Lam K., Johnson F., Khou–ry A.E. Mechanism of electrical enhancement of efficacy of antibiotics in killing biofilm bacteria. 1994. 38. 2803–2809.
13. McCaulif L.A., Xu Z., Li R. et al. Multiple surface regions on the Niemann–pick C2 protein facilitate intracellular cholesterol transport. Te Journal of Biological Chemistry. 2015. Vol. 290. № 45. Р. 27321–27331.
14. Losick R., Kaiser D. Why and how bacteria communicate. Sci. Amer. 1997. February. P. 68–73.
15. Ansari M.A., Fatima Z., Hameed S. Antifungal action of methylene blue involves mitochondrial dysfunction and disruption of redox and membrane homeostasis in C.аlbicans. The Open Microbiology Journal. 2016. Vol. 10. Р. 12–22.
16. Glen C., Schembri M. Remodeling recurrent infection. Nature Microbiology. 2016. 2. 16256. DOI: 10.1038/nmicrobiol.2016.256.
17. Olson M.E., Ceri H., Morck D.W., Buret A.G., Read R.R. Biofilm bacteria: formation and comparative susceptibility to antibiotics. Can. J. Vet. Res. 2002. Vol. 66. P. 86–92.
18. Gilbert P., Das J., Foley І. Biofilm susceptibility to antimicrobials. Adv. Dent. Res. 1997. 11. 160–167.
19. Wainwright M., Phoenix D.A., Gaskell M., Marshall B. Photobactericidal activity of methylene blue derivatives against vancomycin–resistant Enterococcus spp. J. Antimicrob. Chemother. 1999. 44. 823–825.
20. Wainwright M., Phoenix D.A., Laycock S.L., Wareing D.R.A., Wright P.A. Photobactericidal activity of phenothiazinium dyes against methicillin–resistant strains of Staphylococcus aureus. FEMS Microbiol. Lett. 1998. 160. 177–181.

/7-1.jpg)
/9-1.jpg)
/10-1.jpg)
/10-2.jpg)
/10-3.jpg)
/10-4.jpg)
/11-1.jpg)
/11-2.jpg)