Журнал «Травма» Том 20, №5, 2019
Вернуться к номеру
Корекція гомеостазу крові у хворих із септичним незрощенням гомілки після переломів у періопераційному періоді
Авторы: Рушай А.К. (1), Климовицький В.Г. (2), Мартинчук О.О. (3)
1 - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
2 - Науково-дослідний інститут травматології і ортопедії Донецького національного медичного університету, м. Лиман, Україна
3 - Міська клінічна лікарня № 1, м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
У роботі подано досвід періопераційної профілактики кровотеч і тромбозів у 36 хворих із септичним незрощенням кісток гомілки. Втручання проводились в обсязі фістулсеквестрнекректомії. У періопераційному періоді хворі отримували беміпарин і транексамову кислоту. Одночасне застосування транексамової кислоти й беміпарину було виправданим з урахуванням механізмів дії на різні фактори загортальної і антизгортальної систем і відсутності протипоказань до спільного застосування цих препаратів. Щоб оцінити ефективність і безпеку такої комбінації в пацієнтів із септичним незрощенням кісток гомілки при виконанні втручання, через 1, 3 і 7 днів, проводили дослідження гомеостазу, оцінювали клінічні дані. Ці терміни відповідали гострому, найбільш небезпечному періоду. Динаміка більшості досліджуваних параметрів гомеостазу крові статистично не відрізнялася, але спостерігалася тенденція до зсуву показників до рекомендованої безпечної зони і навіть статистично вірогідне зниження рівня розчинних фібрин-мономерних комплексів. Спостерігалися позитивні клінічні ефекти. Ніяких ускладнень відмічено не було. Під час операції втрати крові не відзначалося. У той же час тромбоемболічні ускладнення не зареєстровані. Прояви альтерації в післяопераційному періоді були менш виражені, але набряклість зменшилася. Кількість ранового виділення і час загоєння післяопераційної рани скоротилися. В оперованих хворих не було рецидивів запалення протягом 3–8 місяців. Виявлено високу безпеку й ефективність застосування транексамової кислоти й низькомолекулярного гепарину беміпарину.
В работе представлен опыт периоперационной профилактики кровотечений и тромбозов у 36 больных с септическим несращением костей голени. Вмешательства проводились в объеме фистулсеквестрнекрэктомии. В периоперационном периоде пациенты получали бемипарин и транексамовую кислоту. Одновременное применение транексамовой кислоты и бемипарина было оправданным с учетом механизмов действия на различные факторы свертывающей и противосвертывающей систем и отсутствия противопоказаний к совместному применению этих препаратов. Чтобы оценить эффективность и безопасность такой комбинации у пациентов с септическим несращением костей голени при выполнении вмешательства, через 1, 3 и 7 дней проводили исследование гомеостаза, оценивали клинические данные. Эти сроки соответствовали острому, наиболее опасному периоду. Динамика большинства исследуемых параметров гомеостаза крови статистически не отличалась, но наблюдались тенденция к сдвигу показателей к рекомендованной безопасной зоне и даже статистически достоверное снижение уровня растворимых фибрин-мономерных комплексов. Наблюдались положительные клинические эффекты. Никаких осложнений отмечено не было. Во время операции потери крови не отмечалось. В то же время тромбоэмболические осложнения не зарегистрированы. Проявления альтерации в послеоперационном периоде были менее выражены, но отечность уменьшилась. Количество раневого отделяемого и время заживления послеоперационной раны сократились. У оперированных больных не было рецидивов воспаления в течение 3–8 месяцев. Выявлена высокая безопасность и эффективность применения транексамовой кислоты и низкомолекеулярного гепарина бемипарина.
This article presents the experience of perioperative prevention of bleeding and thrombosis in 36 patients with septic nonunion of the shin bones. The interventions were carried out in the amount of fistulsequestrnecrectomy. In the perioperative period, patients received bemiparin and tranexamic acid. The simultaneous use of tranexamic acid and bemiparin was justified taking into account the mechanisms of action on various factors of coagulant and anticoagulant systems, and the absence of contraindications for the combined use of these drugs. To evaluate the efficacy and safety of such a combination in patients with septic nonunion of the shin bones when performing an intervention, studies of homeostasis were performed on days 1, 3, and 7, and clinical data were evaluated. Such timeframes were in line with the acute, most dangerous period. The dynamics of the majority of investigated indices of blood homeostasis didn’t differ statistically, but there was a tendency to the shift the indices to the recommended safe zone and even to a statistically significant decrease in the level of soluble fibrin monomer complexes. Positive clinical effects were noted. No complications were detected. There was no marked blood loss during surgery. At the same time, thromboembolic complications were not observed. The manifestations of alteration in the postoperative period were less pronounced, but rather the swelling decreased. The amount of wound discharge and the time of postoperative wound healing reduced. In the operated patients, there was no recurrent inflammation within 3–8 months. High safety and efficacy of tranexamic acid and low molecular weight heparin bemiparin were revealed.
кровотеча; тромбоз; гомеостаз; беміпарин; транексамова кислота
кровотечение; тромбоз; гомеостаз; бемипарин; транексамовая кислота
bleeding; thrombosis; homeostasis; bemiparin; tra-nexamic acid
Вступ
Хірургічне втручання у хворих із септичним незрощенням кісток гомілки є досить травматичною й небезпечною операцією.
Завдання з корекції гомеостазу крові, які доводиться вирішувати хірургам, є суперечливими. Так, основним завданням під час оперативного втручання й у ранньому післяопераційному періоді є профілактика крововтрати. У післяопераційному ж періоді необхідно покращувати реологічні властивості крові, проводити профілактику тромбозів і тромбоемболій. Ці завдання суперечать одне одному.
Система гомеостазу є буферною, складною, із безліччю взаємопов’язаних факторів [2, 9]. Грубе втручання може призвести до дисбалансу всієї системи. Тому використання поєднання препаратів, що сприяють тромбоутворенню, і препаратів для профілактики тромбозів вимагає фармакокінетичного обґрунтування й вивчення.
Мета роботи: покращання результатів лікування хворих із септичними незрощенням кісток гомілки після переломів на основі обґрунтованої медикаментозної профілактики кровотеч і тромбозів у періопераційному періоді.
Завдання:
— обґрунтувати можливість застосування низькомолекулярного гепарину нового покоління беміпарину (Цибор) і транексамової кислоти;
— показати безпеку такої комбінації;
— вивчити ефективність профілактики кровотеч і тромбозів поєднанням беміпарину й транексамової кислоти.
Матеріали та методи
Під нашим спостереженням перебувало 36 хворих із септичним незрощенням кісток гомілки. Більшість із них — чоловіки (28 — 77,8 %), особи працездатного віку — від 18 до 60 років — становили 88,9 % (32 особи). Хворим проводилася фістулсеквестрнекректомія в межах здорових тканин. Перед операцією внутрішньовенно вводили розчин 750 мг транексамової кислоти, через 12 годин прийом повторювали для зниження ризику кровотеч.
Система гемостазу — складна біологічна система, що забезпечує збереження рідкого стану циркулюючої крові й одночасно — запобігання кровотечам і лікування їх.
Прийнято виділяти такі компоненти системи гемо–стазу:
— судинно-тромбоцитарна ланка;
— система згортання крові (коагуляція);
— фізіологічні антикоагулянти;
— фібринолітична система (тромболізис).
З метою спостереження й для характеристики отриманих результатів проводилася низка досліджень.
Дуже важливим було визначення кількості тромбоцитів.
Основна функція кров’яних пластинок у системі згортання крові — захисна. Це реакція організму на пошкодження для запобігання втраті крові. У тромбоцитах наявні 12 факторів, що беруть участь у згортанні крові. При пошкодженні стінки судини пластинки агрегують, прилипають до утворюваних ниток фібрину, унаслідок чого формується тромб, що закриває рану. У процесі тромбоутворення виділяються кілька етапів, що відбуваються за участю багатьох компонентів крові.
Розглянемо етапи тромбоутворення.
На першому етапі відбувалося накопичення тромбоцитів і вихід фізіологічно активних речовини.
На другому етапі — коагуляція і зупинка кровотечі (гемостаз). Цей етап має три основні фази змін. У першій фазі відбувалося утворення активного тромбопластину з тромбоцитів (внутрішній фактор) і з тканин судини при їх пошкодженні (зовнішній, тканинний фактор).
У другій фазі — утворення активного тромбіну з неактивного протромбіну під впливом тромбопластину.
У третій фазі під впливом тромбіну з фібриногену утворюється фібрин. Для усіх фаз згортання крови необхідній Са2+.
На третьому етапі спостерігалася ретракція кро-в’яного згустка, пов’язана зі скороченням ниток актину у відростках тромбоцитів і ниток фібрину [1, 6].
Розчинні фібрин-мономерні комплекси (РФМК) характеризували пул фібриногену [5]. РФМК-тест призначений для кількісного визначення в плазмі крові РФМК, що є маркерами тромбінемії при внутрішньосудинному згортанні крові [4].
Метод полягає у визначенні часу появи в плазмі, що містить РФМК, зерен (паракоагуляту) фібрину після додавання до неї розчину о-фенантроліну.
Підвищені значення (референтні — 3,0–4,5 мг/ 100 мл) свідчать про активацію згортання крові, причому чим більше концентрація, тим вище ризик внутрішньосудинного тромбоутворення; знижені значення — про ефективність лікування низькомолекулярним гепарином.
Міжнародне нормалізоване відношення (МНВ; International Normalized Ratio, INR) — додатковий спосіб подання результатів протромбінового тесту, рекомендований для контролю терапії непрямими антикоагулянтами комітетом експертів Всесвітньої організації охорони здоров’я (ВООЗ), Міжнародним комітетом з вивчення тромбозів і гемостазу й Міжнародним комітетом зі стандартизації в гематології.
МНВ розраховується за формулою [8]:
де ISI (International Sensitivity Index of thromboplastin), він же МІЧ (міжнародний індекс чутливості) — показник чутливості тромбопластину, стандартизований щодо міжнародного стандарту.
МНВ — математична корекція, за допомогою якої проводилася стандартизація протромбінового часу, що дозволяє порівнювати результати, отримані в різних лабораторіях.
МНВ — спосіб вираження результатів дослідження протромбінового часу, рекомендований ВООЗ для уніфікації отриманих результатів протромбінового часу з урахуванням активності використовуваного лабораторією тромбопластину (що має різну чутливість).
Протромбіновий час характеризує першу (протромбіноутворення) і другу (тромбіноутворення) фази плазмового гемостазу й відбиває активність протромбінового комплексу (факторів VII, V, X і власне протромбіну — фактора II). Збільшення протромбінового часу свідчило про схильність до гіпокоагуляції; зменшення — про схильність до гіперкоагуляції. Порівняння результатів досліджень із використанням різних тромбопластинів було важливим завданням практичної медицини. Різні тромбопластини розрізняють за ISI, що додається до опису кожного набору. У 1983 р. ВООЗ разом із Міжнародним товариством тромбозу і гемостазу ухвалили тромбопластин із мозку людини як референтний і встановили, що ISI цього тромбопластину дорівнює 1,0 (міжнародний референтний препарат ВООЗ). Усі інші комерційні тромбопластини калібруются за ним, і для кожного визначається своя чутливість за формулою:
INR — це спроба математично скоригувати різницю, яку дають тромбопластини з різною чутливістю, тобто звести результат до даних, отриманих із референтним тромбопластином.
Активований частковий тромбопластиновий час (АЧТЧ) був показником вимірювання ефективності внутрішнього (шлях контактної активації) і загального шляху згортання. Крім виявлення порушень у процесі згортання крові, АЧТЧ також використовується для контролю ефективності лікування гепарином — основним антикоагулянтом. Тест використовується в поєднанні з тестом протромбінового часу, який вимірює зовнішній шлях згортання.
З метою профілактики тромбозів через 6 годин після оперативного втручання вводилася профілактична доза беміпарину (Цибор) 25 000 ОД. Введення виконувалось протягом 7 діб.
Беміпарин натрію — це низькомолекулярний гепарин, отриманий у результаті деполімеризації гепарину натрію, що був виділений зі слизової оболонки кишечника свиней. Середня молекулярна вага (МВ) беміпарину становить приблизно 3600 дальтон. Частка молекулярних ланцюгів із МВ менше від 2000 дальтон становить менше від 35 %. Частка молекулярних ланцюгів із МВ від 2000 до 6000 дальтон коливається між 50 і 75 %. Частка молекулярних ланцюгів із МВ понад 6000 дальтон становить менше від 15 %. Активність антифактора Ха беміпарину становить від 80 до 120 МО антифактора Ха на 1 мг сухої речовини, а активність антифактора ІІа становить від 5 до 20 МО антифактора ІІа на 1 мг сухої речовини. Співвідношення активності антифактора Ха/антифактора Іа — приблизно 8. В експериментах на тваринах доведені протизгортальна ак-тивність і помірний геморагічний ефект беміпарину [3, 7]. Застосування беміпарину підтверджує його протизгортальну активність і при дотриманні рекомендованого дозування незначно подовжує час тесту на згортання крові [3, 7].
Транексамова кислота є синтетичним антифібринолітиком, отриманим з амінокислоти лізину. Під час фібринолізу плазміноген прилипає до рецепторів лізину на поверхні молекули фібрину і згодом перетворюється на плазмін активатором тканинного плазміногену. Плазмін розщеплює фібрин на великі компоненти, що потім розкладаються на більш розчинні компоненти. Баланс у фібринолітичній системі підтримується за рахунок утворення комплексу між плазміногеном і фібрином і подальшої активації плазміногену. Якщо є надлишок розчинного фібрину, відбувається посилення крововиливу.
Транексамова кислота підтримує стабільність згустків фібрину, прилипаючи до сайтів зв’язування лізину й конкурентно пригнічуючи активацію плазміногену, що запобігає утворенню плазміну. При високих концентраціях препарат неконкурентно пригнічує існуючий плазмін [1, 3, 4]. Дослідження in vitro показали, що ефективність транексамової кислоти до 10 разів вище, ніж амінокапронової кислоти — іншого похідного лізину. Діє переважно в тканинах із високою концентрацією тканинного плазміну й тканинних факторів tPA1 і tPA2. У людей транексамова кислота продовжує тромбіновий час, але не час коагуляції.
Одночасне застосування транексамової кислоти й беміпарину (з урахуванням механізмів дії на різні фактори загортальної й притизгортальної систем і відсутності протипоказань щодо сумісного застосування цих препаратів) було обґрунтованим. З огляду на різні механізми дії і точки прикладання слід вважати комбінацію транексамовой кислоти й беміпарину повністю виправданою фармакокінетично.
Для оцінки ефективності й безпеки такого поєднання препаратів у пацієнтів із септичними незрощеннями кісток гомілки при виконанні втручання дослідження показників гомеостазу було проведено на 1-шу, 3-тю і 7-му добу, оцінювали клінічні дані. Такі терміни відповідають гострому, найбільш небезпечному періоду.
Обговорення
Система гомеостазу є багатофакторною, буферною; усі її ланки взаємопов’язані. Тому обґрунтованим є розгляд найбільш поширених у загальній медичній практиці показників гомеостазу крові.
Одним з найінформативніших показників є кількість тромбоцитів. Динаміка кількості тромбоцитів була такою: (332,0 ± 31,6) ´ 109/л — перед втручанням; (356,0 ± 21,7) ´ 109/л — на 3-тю добу і (296,0 ± 33,4) ´ ´ 109/л — на 7-му добу (рис. 1) при нормі (180–320) ´ ´ 109/л.
Показники суттєво не змінювалися, характеристика лінії тенденції свідчила про малу вірогідність впливу терапії на цей показник.
Рівень розчинних фібрин-мономерних комплексів є маркером тромбінемії при внутрішньосудинному згортанні крові. Динаміка РФМК була такою. Простежувалася тенденція до зниження до 5,30 ± ± 0,41 мг/100 мл на 7-му добу з 6,90 ± 0,24 мг/100 мл на 1-шу добу (норма 3,0–4,5 мг/100 мл). Вірогідність впливу терапії на динаміку показника була високою (рис. 2) — R2 = 0,9494.
Динаміка МНВ статистично вірогідно не відрізнялася, спостерігалася тенденція до збільшення показника на 7-му добу: 1-ша доба — 1,20 ± 0,24; 3-тя доба — 1,10 ± 0,12; 7-ма доба — 1,90 ± 0,11 (рис. 3).
Протромбіновий час практично не змінювався: 1-ша доба — 16,20 ± 1,24 с, 3-тя доба — 16,10 ± 0,97 с і 7-ма доба — 17,90 ± 1,12 с (рис. 4).
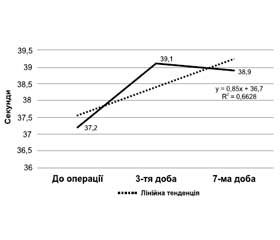
Коливання показників активованого часткового тромбопластинового часу були незначними. На 1-му добу вони становили 37,20 ± 1,24 с, на 3-тю — 39,10 ± 0,97 с і на 7-му — 38,90 ±1,12 с (рис. 5).
Отримані дані трактуються нами так. Динаміка більшості обстежених показників статистично не відрізнялася, але спостерігалися тенденція до зсуву показників до рекомендованої безпечної зони і навіть статистично вірогідне зниження рівня РФМК при R2 = 0,9494.
Відзначено позитивні клінічні ефекти. Ускладнень не зафіксовано.
Вираженої крововтрати під час операції не було. Водночас не спостерігалось і тромбоемболічних ускладнень.
Прояви альтерації в післяопераційному періоді були менш виражені, швидше зменшувався набряк. Кількість ранового виділення і час загоєння післяопераційної рани знижувалися.
У прооперованих хворих не спостерігалися рецидиви запалення протягом 3–8 місяців.
Висновки
1. Комбінація беміпарину (Цибор) і транексамової кислоти виправдана фармакокінетично.
2. Поєднання препаратів є безпечним.
3. Не виявлено суттєвої динаміки показників гомеостазу крові, що обумовлено, ймовірно, його буферними властивостями.
4. Клінічні дані свідчать про високу ефективність застосованої комбінації препаратів.
Конфлікт інтересів. Не заявлений.
1. Suchkov I.A., Sebastian J.M.-G., Schellong T., Falciani G.M. Comparison of Once-Daily Bemiparin with Twice-Daily Enoxaparin for Acute Deep Vein Thrombosis: A Multicenter, Open-Label, Randomized Controlled Trial. Clinical Drug Investigation. February 2018. Vol. 38. Is. 2. Р. 181-189.
2. Ozaslan E., Ozkan M, Cicin I. et al. Effectiveness and Safety of LMWH Treatment in Patients With Cancer Diagnosed With Non-High-Risk Venous Thromboembolism: Turkish Observational Study (TREBECA). Clin. Appl. Thromb Hemost. 2018 Sep. № 24(6). Р. 973-979. DOI: 10.1177/1076029617753538.
3. Muñoz-Atienza V., Gil-Rendo А., Amo-Salas M., Núñez-Guerrero P., Martín-Fernández J. Extended use of bemiparin as thromboprophylaxis during bariatric surgery: results of anti-factor Xa activity measurements. Surgery for obesity and related diseases. Official journal of American society of metabolic and bariatric surgery. March 2018. Vol. 14. Is. 3. Р. 354-360.
4. URL: www.coagulometers.ru
5. URL: www.trombozu.net
6. Кизилова Н.И. Клинико-лабораторная диагностика системы гемостаза, принципы и схемы исследования. Новосибирск, 2007. 35 с.
7. Величко Э.В., Хачукаева А.С., Хабадзе З.С. и др. Место бемипарина в современной клинической практике. Трудный пациент. 2017. № 10–11. Т. 15. С. 11-14.
8. Назаренко Г.И., Кишкун А.А. Клиническая оценка результатов лабораторных исследований. М., 2006. 124 с.
9. Пестрикова Т.Ю., Юрасова Е.А., Юрасов И.В., Князева Т.П., Ткаченко В.А. Профилактика тромбоэмболий. Рациональный подход к ведению пациенток в послеоперационном периоде (обзор литературы). Consilium Medicum. 2018. Т. 6. № 20. С. 53-56.

/16-1.jpg)
/16-2.jpg)
/17-1.jpg)
/18-1.jpg)