Журнал «Травма» Том 20, №5, 2019
Вернуться к номеру
Дослідження впливу клітинних технологій на розвиток остеоартрозу колінного суглоба в експерименті
Авторы: Ткачук П.В., Страфун С.С.
ДУ «Інститут травматології та ортопедії НАМН України», м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Актуальність. Для лікування прогресуючих дистрофічних змін колінного суглоба при остеоартрозі запропоновано використання автологічних клітинних матеріалів. Мета: дослідження структурних змін менісків та епіфіза ушкодженої остеоартрозом великогомілкової кістки після застосування клітинних препаратів. Матеріали та методи. В експериментах кроликам моделювали остеоартроз, через 1 місяць у порожнину колінного суглоба вводили тромбоцитарну плазму, автологічний аспірат кісткового мозку і гомогенізованої жирової тканини.Через 2,5 місяця після операції досліджували структурні зміни менісків і проксимального епіфіза великогомілкової кістки. Ушкодження та відновлення оцінювали за морфологічними критеріями: зміни структури меніска, ушкодження епіфізарного хряща великогомілкової кістки, зміни щільності субхондральної кісткової тканини. Результати. Аналіз гістологічних досліджень показав зменшення ушкодження хряща тіла менісків після введення всіх трьох препаратів, часткову зупинку зміни щільності кісткової тканини після застосування тромбоцитарної плазми й аспірату кісткового мозку, а прогресуючі дегенеративні зміни суглобової поверхні спостерігалися лише у групі з плазмою. Через 1,5 місяця після введення аспіратів, отриманих із кісткового мозку та жирової тканини, відбулась інтеграція введених клітин із синовіальною оболонкою та меніском: розвиток ретикулярної тканини у групі з аспіратом кісткового мозку, формування ніжної сполучної тканини з адипоцитами у групі з аспіратом жирової тканини. Висновки. Про життєздатність клітин уведених аспіратів свідчить реорганізація та їх часткова інтеграція у синовіальній порожнині, зокрема через активацію ангіогенезу.
Актуальность. Для лечения прогрессирующих дистрофических изменений коленного сустава при остеоартрозе предложено использование аутологических клеточных материалов. Цель: исследование структурных изменений менисков и эпифиза поврежденной остеоартрозом большеберцовой кости после применения клеточных технологий. Материалы и методы. В экспериментах кроликам моделировали остеоартроз, через 1 месяц в полость коленного сустава вводили тромбоцитарную плазму, аутологический аспират костного мозга и гомогенизированной жировой ткани. Через 2,5 месяца после операции исследовали структурные изменения менисков и проксимального эпифиза большеберцовой кости. Повреждение и восстановление оценивали по морфологическим критериям: изменение структуры мениска, повреждение эпифизарного хряща большеберцовой кости, изменение плотности субхондральной костной ткани. Результаты. Анализ гистологических исследований показал уменьшение повреждения хряща тела менисков после применения всех трех вводимых средств, частично останавливалось изменение плотности костной ткани после применения тромбоцитарной плазмы и аспирата костного мозга, а прогрессирующие дегенеративные изменения суставной поверхности были выявлены только в группе с плазмой. Через 1,5 месяца после введения аспиратов, полученных из костного мозга и жировой ткани, выявлена интеграция введенных клеток с синовиальной оболочкой и мениском: развитие ретикулярной ткани в группе с аспиратом костного мозга, формирование нежной соединительной ткани с адипоцитами в группе с аспиратом жировой ткани. Выводы. О жизнеспособности клеток введенных аспиратов свидетельствует реорганизация и их частичная интеграция в синовиальной полости, в том числе через активацию ангиогенеза.
Background. For the treatment of progressive degenerative changes of the knee joint in osteoarthritis, the use of autologous cellular materials has been proposed. The purpose of the study was to investigate the structural changes of the meniscus and the epiphysis of the tibia affected by osteoarthritis after the use of cellular technologies. Materials and methods. The experimental osteoarthritis was modeled in rabbits; after 1 month, platelet plasma, autologous bone marrow aspirate, and homogenized adipose tissue were injected into the knee cavity. Structural changes in the meniscus and proximal tibial epiphysis were studied 2.5 months after surgery. Damage and recovery were evaluated by morphological criteria: changes in the meniscus structure, damage to the tibial epiphyseal cartilage, changes in the density of subchondral bone tissue. Results. Analysis of histological studies showed a decreased damage to the meniscus body cartilage after the injection of all three cellular technologies, partially reduced changes in bone density after the use of platelet plasma and bone marrow aspirate, and progressive degenerative changes of the articular surface were observed only in the plasma group. In 1.5 months after injection of bone marrow and adipose tissue aspirates, the integration of the introduced cells with the synovial membrane and meniscus occurred: development of reticular tissue in the bone marrow aspirate group, formation of connective tissue with adipocytes in group with homogenized fat tissue. Conclusions. The viability of the cells of the injected aspirates is evidenced by the reorganization and their partial integration in the synovial cavity, in particular through the activation of angiogenesis.
модель остеоартрозу; експеримент; тромбоцитарна плазма; аспірат кісткового мозку; гомогенізована жирова тканина
модель остеоартроза; эксперимент; тромбоцитарная плазма; аспират костного мозга; гомогенизированная жировая ткань
osteoarthritis model; experiment; platelet rich plasma; bone marrow aspirate; homogenized adipose tissue
Дана робота є фрагментом НДР «Розробка системи хірургічного лікування та реабілітації хворих з ушкодженнями ліктьового суглоба та їх наслідками» (номер державної реєстрації 0119U001024).
Вступ
Остеоартроз колінного суглоба — це дегенеративне захворювання, що включає ушкодження менісків та зміни суглобового хряща і може потребувати тотальної артропластики [1]. Проте хірургічне лікування не у всіх випадках може бути застосовано або є недостатньо ефективним. Консервативне лікування в першу чергу спрямоване на полегшення симптомів захворювання, блокування болю, запалення [2]. Внутрішньосуглобові ін’єкції кортикостероїдів забезпечують лише короткочасне поліпшення стану пацієнта [3]. Існує потреба у покращенні інвазивних методів лікування. Для цього запропоновано застосування автологічних клітинних матеріалів: тромбоцитарної плазми, мезенхімальних клітин кісткового мозку та жирової тканини. Найпростішим і рутинним методом є отримання збагаченої тромбоцитарної плазми з крові. При введенні приготованої плазми утворюється фібриновий каркас, який сприяє міграції клітин та регенерації тканин кісток і сухожилків [4, 5].
Аспірат із кісткового мозку є доступним джерелом мезенхімальних стовбурових клітин [6], однак кількість таких клітин у аспіраті менше 0,01 %, тому запропоновано вводити концентрат аспірату [7]. Вважається, що позитивні результати лікування після введення концентрату кісткового мозку пов’язані із здатністю мезенхімальних клітин виділяти фактори росту (PDGF, TGF–b) і активувати відновні процеси [8]. Як просту в одержанні альтернативу розглядають мезенхімальні клітини з жирової тканини. Однак вони є морфогенетично стійкішими порівняно з клітинами, які було одержано з кісткового мозку [9]. Кожен із підходів запропоновано для лікування остеартрозу, і навіть отримано деякі позитивні результати, проте порівняння їх дії, наслідків введення та структурних основ відновних процесів не описане [10, 11].
Мета роботи: дослідити структурні зміни менісків та епіфіза ушкодженої остеоартрозом великогомілкової кістки після застосування клітинних технологій.
Матеріали та методи
Експерименти проведено на 24 кролях лінії шиншила вагою 3–4 кг. В експерименті тварин розподілили на 5 дослідних груп: контроль — інтактні тварини (n = 4); група 1 — артроз (n = 5); група 2 — артроз + тромбоцитарна плазма (n = 5); група 3 — артроз + аспірат кісткового мозку (n = 5); група 4 — артроз + аспірат жирової тканини (n = 5).
Модель остеоартрозу полягала у механічному ушкодженні суглобової поверхні великогомілкової кістки, перетині великогомілкової зв’язки і коагуляції судин капсули. Модель характеризується прогресуючим розвитком дегенеративних змін гіалінового хряща і резорбції субхондральної кісткової тканини епіфіза кістки, змінами мікроциркуляції суглобової капсули меніска суглоба [12]. Через місяць після операції у дослідних групах 2, 3 і 4 у порожнину колінного суглоба вводили розроблені (запропоновані) суспензії клітинних технологій.
Методика отримання тромбоцитарної плазми. Збагачену тромбоцитами плазму отримували з донорської венозної крові. Забір донорської крові проведено у ДУ «ІТО НАМН України» відповідно до ліцензії Міністерства охорони здоров’я України. Венозну кров здорових осіб збирали у стерильні пластикові пробірки об’ємом 10 мл (кожна містила антикоагулянт — 3,8% цитрат натрію) та центрифугували при 400 g упродовж 15 хвилин (t = 4 °С), як це описано у стандартному протоколі [13]. Для введення здійснювали забір шару тромбоцитарної плазми над еритроцитарною масою. Концентрація тромбоцитів — 0,8–1 • 106 1/мл. Об’єм введення у суглоб — 0,5 мл.
Методика отримання кісткового аспірату. Кістковим троакаром діаметром 10 G та шприцом 5 мл із проксимального відділу стегна кролика виконували аспірацію автологічного кісткового мозку в об’ємі 2 мл. Аспірат кісткового мозку з цитратом декстрози (1 : 8) АЦД–А (Бакстер С.А., США/Бельгія) центрифугували 16 хвилин при 740 g та здійснювали забір 1,0 мл надеритроцитарної фракції. Клітинний концентрат уводили у синовіальну порожнину колінного суглоба.
Методика отримання аспірату жирової тканини. У кроликів здійснювали забір 1 мл автологічної жирової клітковини з великого сальника через 1 см доступ до черевної порожнини, після чого забрану жирову тканину подрібнювали та гомогенізували шляхом 10–кратного пропускання через 1–мм канюлю. Об’єм уведення у суглоб становив 0,5 мл.
Через 2,5 місяця після моделювання остеоартрозу тварин виводили з експерименту шляхом швидкої декапітації. Колінний суглоб було виділено для гістологічного дослідження. Зразки фіксували у 10% розчині нейтрального формаліну. Після фіксації виділяли епіфіз великогомілкової кістки, дистальний епіфіз стегнової кістки, капсулу і меніск суглоба. Фрагменти кісток демінералізували у розчині OsteoFast 2 (BioGnost Ltd., Хорватія). Після відмивання усі зразки заливали у парафін (Leica Surgipath Paraplast Regular) за стандартною методикою. Парафінові зрізи забарвлювали гематоксиліном з еозином, толуїдиновим синім та досліджували на мікроскопі Olympus BX 51.
Структурні зміни колінного суглоба оцінювали за шкалою, що описано у публікації J. Fitzgerald (2008), та морфометрично [14]. Згідно з градацією шкали на кожен досліджений зразок присвоювали бал за такими критеріями: зміни клітинної морфології хряща (0–4 бали), рівень забарвлення матриксу хряща (0–3), регулярність поверхні (0–3), товщина хряща (0–2) та інтеграція з нативним хрящем (0–2). Максимальна кількість балів за шкалою — 14, мінімальна — 0, що відповідає повній деструкції хрящової поверхні епіфіза кістки. Досвід застосування шкали
J. Fitzgerald щодо оцінки прогресуючих змін у суглобі описано у публікації [15]. Морфометрична оцінка полягала у вимірюванні товщини перифокального хряща у сагітальній проекції епіфіза великогомілкової кістки та вимірюванні відносної щільності епіфізарної кісткової тканини. Кількісні вимірювання проведено за допомогою програмного забезпечення Carl Zeiss (AxioVision SE64 Rel.4.9.1). Міжгрупову різницю оцінювали за непараметричним критерієм Краскела — Уолліса у програмі Origin Labversion 8.0. Дані подано у вигляді медіани з меншим та більшим квартилем (M [Q1–Q3]). Різницю вважали статистично вірогідною при P < 0,05.
Результати та обговорення
Макроскопічні зміни
Через 2,5 місяця після моделювання остеоартрозу проведено комплексний аналіз структурних утворень колінного суглоба — капсула суглоба, меніски, епіфізарний хрящ великогомілкової кістки, зокрема субхондральна кісткова тканина. При макроскопічному дослідження капсула суглоба була візуально збільшеною, пружною, з новоутвореними судинами. При розрізі капсули у зразках із запаленням реєстрували вихід ексудативної рідини. У деяких зразках груп 3 і 4 виявлено збільшення ніжної сполучної тканини з внутрішньої поверхні капсули. У табл. 1 наведено результати кількісної оцінки морфологічних змін суглоба з урахуванням гістологічних змін епіфізарного хряща. В усіх досліджених зразках встановлено деформаційні зміни суглобової поверхні епіфіза, зокрема повну деструкцію й оголення епіфізарної поверхні великогомілкової кістки в 1 зразку групи 3. Статистично значущої різниці між групами порівняння за шкалою J. Fitzgerald не встановлено, виявлено тенденцію до зменшення ушкодження матриксу хряща у групах 2 і 4. Далі проведено комплексний аналіз морфологічних змін меніска і суглобового хряща великогомілкової кістки.
Структурні зміни менісків суглоба
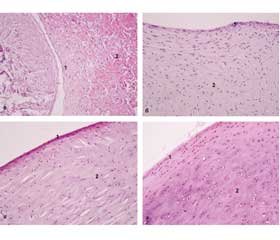
Меніски колінного суглоба було виділено в усіх дослідних тварин груп 1–4. На макроскопічному рівні відзначено дегенеративні зміни: зменшення товщини меніска, порушення фіксації, набряк сполучної тканини на рівні передніх і задніх рогів меніска (рис. 1). Аналіз гістопрепаратів ушкоджених менісків дозволив визначити основні структурні зміни. Так, ушкодження домінували з внутрішньої поверхні латерального і медіального меніска, відзначено фрагментарне ушкодження після моделювання патології. Верхня, нижня і латеральна поверхні тіла менісків більшою мірою були структурно збережені. Тіло менісків через 2,5 місяця після моделювання остеоартрозу все ще зберігало матрикс гіалінового хряща, але у зразках групи 1 і зразках груп 3 і 4 із морфологічно підтвердженим запальним інфільтратом виявлено набряк клітинних лакун, редукцію щільності хондроцитів у тілі меніска, появу порожніх лакун, а при тотальному ушкодженні епіфізарного хряща запалення поєднувалось з геморагічним просоченням (рис. 2а).
У цілому в дослідних групах 2–4 відзначено дещо кращий ступінь збереження структури тіла менісків і деякі ознаки дії клітинних аспіратів на відновний процес (рис. 2б–г). Так, у групі 2 виявлено ділянки проліферації клітин синовіальної оболонки, що вказує на регенерацію під дією тромбоцитарною плазми (рис. 3б). У групі 3 із внутрішньої і нижньої поверхонь меніска і з поверхні синовіальної оболонки встановлено новоутворену ретикулярну тканину, що, ймовірно, походить з аспірату кісткового мозку, який було введено через 1,5 місяця після ушкодження (рис. 3в). На рівні рогів меніска відзначено проліферативні зміни у сполучній тканині й ознаки ангіогенезу. У групі 4 також встановлено наслідки введення аспірату жирової тканини (рис. 3г). Із внутрішньої поверхні меніска встановлено збільшення пухкої сполучної тканини і появу осередків адипоцитів. Важливо зазначити, що аспірат кісткового мозку і жирової тканини заповнювали проміжок між меніском і суглобовою поверхнею, а також морфологічно поєднувались з синовіальною оболонкою. Відбувалась інтеграція клітин внесених аспіратів з оболонкою меніска і капсулою, що можна розглядати як прояв регенеративних процесів.
Структурні зміни суглобового хряща великогомілкової кістки
На гістологічному рівні досліджено епіфізарний хрящ і субхондральну кісткову тканину. Епіцентр механічного ушкодження був позбавлений хряща, а перифокальна поверхня характеризувалась зменшенням товщини. Дистрофічні зміни призвели до зменшення щільності ізогенних груп хондроцитів у хрящі, появи порожніх мікролакун, зменшення забарвлення хондромукоїда (рис. 4). Зміни встановлено як у поверхневих, так і у глибоких шарах хряща. Перші, ймовірно, пов’язані з деформаційним ушкодженням, а другі виникли через реорганізацію субепіфізарної кістки. Поява порожніх лакун або лакун із судинами вказувала на розвиток остеоартрозу.
Зміни у субхондральній кістці полягали у зменшенні щільності кісткових трабекул, появі порожніх лакун, що є свідченням як резорбції, так і посттравматичної деформації. У зразках із вираженим запальним інфільтратом щільність кісткового мозку була зменшеною (до 20 % порівняно з 66,1 % у контролі) і частково заміщена фіброзною тканиною. Різницю між групами порівняння встановлено морфометрично. У табл. 2 наведено результати морфометричних досліджень епіфіза великогомілкової кістки. У всіх дослідних групах мало місце зменшення товщини гіалінового хряща у перифокальній зоні, тобто відбувалось прогресуюче збільшення епіцентру ушкодження. При цьому щільність субхондральної кісткової тканини вірогідно зменшилась у 1,7 раза (Р < 0,05). Комплексний аналіз показників у групах 2–4 засвідчив пригнічення (запобігання) розвитку дистрофічних змін у хрящі та кістковій тканині після введення тромбоцитарної плазми і лише часткове запобігання ушкодженню кісткової тканини після введення аспірату кісткового мозку. Введення аспірату жирової тканини не викликало прогресування структурних порушень (можна розглядати лише як тенденцію до позитивної дії на рівні щільності кісткової тканини епіфіза великогомілкової кістки).
Отже, на основі комплексного аналізу структурних змін у капсулі колінного суглоба, менісків, стану синовіальної порожнини, епіфіза ушкодженої остеоартрозом великогомілкової кістки зроблено заключення про позитивний вплив введення у синовіальну порожнину автологічних клітинних препаратів з метою запобігання прогресуючим деструктивним порушенням. Дія тромбоцитарної плазми, аспірату кісткового мозку і жирової тканини пов’язана з відновлюючим впливом на синовіальну оболонку і меніски колінного суглоба, що ймовірно сприяє затримці або запобіганню прогресуючому ушкодженню епіфізарного хряща колінного суглоба.
Висновки
1. Введення тромбоцитарної плазми та автологічних аспіратів позитивно позначилось на збереженні морфології менісків. Через 1,5 місяця після введення автологічних аспіратів відбувається інтеграція введених клітин із синовіальною оболонкою та меніском: розвиток ретикулярної тканини у групі з аспіратом кісткового мозку, формування ніжної сполучної тканини з адипоцитами у групі з аспіратом жирової тканини.
2. Реорганізація і часткова інтеграція автологічних тканин у синовіальній порожнині є свідченням їх життєздатності та потенційної регенерації, на що вказує ангіогенез.
3. Деформаційне ушкодження великогомілкової кістки спричинило прогресуючі зміни на рівні суглобового хряща і субхондральної кістки, але пригнічення розвитку структурних змін у кістці відбувалось у хрящі при застосуванні тромбоцитарної плазми й аспірату кісткової тканини, а дистрофічних змін хряща — лише після введення плазми.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Parkes M.J., Callaghan M.J., O'Neill T.W., Forsythe L.M., Lunt M., Felson D.T. Sensitivity to change of patient–preference measures for pain in patients with knee osteoarthritis: data from two trials. Arthritis care & research, 2016. 68(9). 1224–31.
2. Howard R.G., Samuels J., Gyftopoulos S., Krasnokutsky S., Leung J., Swearingen C.J., Pillinger M.H. Presence of gout is associated with increased prevalence and severity of knee osteoarthritis am on goldermen: results of a pilot study. Journal of clinical rheumatology: practical reports on rheumatic & musculoskeletal diseases. 2015. 21(2). 63–71.
3. Davis T., Loudermilk E., DePalma M., Hunter C., Lindley D., Patel N. et al. Prospective, multicenter, randomized, crossover clinical trial comparing the safety and effectiveness of cooled radiofrequency ablation with corticosteroid injection in the management of knee pain from osteoarthritis. Region alanes the sia and pain medicine. 2018. 43(1). 84–91.
4. Oryan A., Alidadi S., Moshiri A. Platelet–rich plasma for bone healing and regeneration. Expert Opin. Biol. Ther. 2016. 16(2). 213–32.
5. Zhou Y., Zhang J., Wu H., Hogan M.V., Wang J.H. The differential effects of leukocyte–containing and pure platelet–rich plasma (PRP) ontendonstem/progenitorcells — implications of PRP application for the clinical treatment of tendoninjuries. Stemcell research & therapy. 2015. 6(1). 173.
6. Chahla J. Dean C.S., Moatshe G., Pascual–Garrido C., Serra Cruz R., La Prade R.F. Concentrated bone marrow aspirate for the treatment of chondralin juries and osteoarthritis of the knee: a systematic review of out comes. Orthopaedic journal of sports medicine. 2016. 4(1). Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4714134/
7. Martin D.R., Cox N.R., Hathcock T.L., Niemeyer G.P., Baker H.J. Isolation and characterization of multipotential mesenchymal stem cells from feline bone marrow. Exp. Hematol. 2002. 30. 879–86.
8. Indrawattana N., Chen G., Tadokoro M., Shann L.H., Ohgushi H., Tateishi T., Tanaka J., Bunyaratvej A. Growth factor combination for chondrogenic induction from human mesenchymal stem cell. Biochem. Biophys. Res. Commun. 2004. 320. 914–19.
9. Strioga M., Viswanathan S., Darinskas A., Slaby O., Michalek J. Sameornotthesame? Comparisonofadipose tissue–derived versusbone marrow–derived mesenchymal stem and stromal cells. Stem. Cells. Dev. 2012. 21. 2724–52.
10. Shin Y.S., Yoon J.R., Kim H.S., Lee S.H. Intra–articular injection of bone marrow–derived mesenchymal stem cells leading to better clinical outcomes without difference in MRI outcomes from baseline in patients with knee osteoarthritis. Knee surgery & related research. 2018. 30(3). 206–14. doi:10.5792/ksrr.17.201
11. Pak J., Lee J.H., Pak N., Pak Y., Park K.S., Jeon J.H., Jeong B.C., Lee S.H. Cartilage Regeneration in Humans with Adipose Tissue–Derived Stem Cells and Adipose Stromal Vascular Fraction Cells: Updated Status. Int. J. Mol. Sci. 2018. 19(7). 2146.
12. Tkachuk P.V., Strafun S.S., Savosko S.I., Makarenko O.M. Vivchennya strukturnikh osoblivostej pri eksperimental’nomu khroni chnomu osteoartrozi kolinnogo sugloba v kroliv [Study of structural features in the experimental chronic knee osteoarthritis in rabbits]. Trauma. 2018. 19(6). 71–6. (Ukrainian).
13. Anitua E., Andia I., Ardanza B., Nurden P., Nurden A.T. Autologous platelets as a source of proteins for healing and tissuere generation. Thromb. Haemost. 2004. 91(1). 4–15.
14. Fitzgerald J., Rich C., Burkhardt D., Allen J., Herzka A.S., Little C.B. Evidence for articular cartilage regeneration in MRL/MpJ mice. Osteoarthritis Cartilage. 2008. 16(11). 1319–26.
15. Tkachuk P.V., Strafun S.S., Savosko S.I., Makarenko O.M. Structural disturbances of the knee joint while mode–ling osteoarthritis [Strukturni porushennya kolinnogo sugloba pri modelyuvanniosteoartrozu]. Trauma. 2019. 20(1). 73–8. (Ukrainian).

/22-2.jpg)
/22-1.jpg)
/23-1.jpg)
/24-1.jpg)
/25-1.jpg)
/24-2.jpg)