Журнал «Травма» Том 20, №5, 2019
Вернуться к номеру
Сравнительный анализ напряженно-деформированного состояния системы «кость — имплантат» накостного остеосинтеза пластиной PHILOS с различными имплантатами из полилактида
Авторы: Корж Н.А. (1), Макаров В.Б. (1), Липовский В.И. (2), Танькут А.В. (1)
1 - ГУ «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко НАМН Украины», г. Харьков, Украина
2 - Днепровский национальный университет им. О. Гончара, г. Днепр, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Актуальність. Переломи проксимального відділу плечової кістки (ПВПК) становлять 5–6 % усіх пошкоджень довгих кісток скелета людини. З метою збільшення жорсткості фіксації хірургічне лікування накістковими пластинами допов-
нюють різними ало- або автотрансплантатами, імплантатами, а також кістковим цементом (тип В і С за AO/ОТА). Авторами як альтернативний імплантат для заміщення дефектів спонгіозної кістки і підтримки кісткових фрагментів головки плечової кістки пропонується використовувати полілактид (PLA) Ingeo™ Biopolymer 4032D. Мета роботи: провести порівняльний аналіз напружено-деформованого стану системи «кістка — імплантат» накісткового остеосинтезу пластиною PHILOS із солідними і пористими 3D-імплантатами з PLA. Матеріали та методи. Для математичного моделювання і порівняльного вивчення напружено-деформованого стану системи «кістка — імплантат» у разі накісткового остеосинтезу змодельована пластина з кутовою стабільністю PHILOS (з нержавіючої сталі), трьохфрагментарний перелом ПВПК з використанням або 2 солідних, або 2 пористих імплантатів PLA з ґратчастими порожнинами. Як об’єкт для побудови плечової кістки використана композитна модель № 3404 лівої плечової кістки фірми Sawbones (Europe AB, Мальме, Швеція), для всіх матеріалів у моделюванні — ізотропна лінійна модель з однаковими фізико-механічними характеристиками для всіх матеріалів. Як інструмент дослідження застосовувався метод кінцевих елементів, реалізований пакетом прикладних програм Ansys. Результати. Порівняльна оцінка впливу форми імплантатів PLA для двох розрахункових схем виконана за допомогою порівняння еквівалентних напружень за Мізесом і полів деформацій для моделей, різних елементів з’єднання і частин системи «кістка — імплантат». Встановлено, що перерозподіл полів напружень в елементах моделі не призводить до її руйнування. Моделі та всі їх елементи задовольняють вимогам міцності. Заміна циліндричного солідного 3D-імплантата на модифікований пористий 3D-імплантат для підтримки суглобової поверхні головки плечової кістки в умовах остеопорозу при остеосинтезі трьохфрагментарного перелому ПВПК накістковою пластиною PHILOS не знижує жорсткості фіксації. Висновки. Порівняльний аналіз напружено-деформованого стану системи «кістка — імплантат» накісткового остеосинтезу пластиною PHILOS з солідними і пористими 3D-імплантатами з PLA показав, що зміна форми імплантатів у розглянутому діапазоні навантаження не впливає на жорсткість системи. Поля деформацій і напружень для розглянутих моделей практично збігаються між собою. У пластині PHILOS та у модифікованих пористих 3D-імплантатах PLA відбувається зменшення напружень на 5 та 4 МПа відповідно. Заміна циліндричної солідної форми 3D-імплантатів PLA на модифіковану пористу є доцільною, тому що дозволяє збільшити площу контакту імплантата PLA з кісткою, а його порожнини можливо використовувати для наповнення плазмою, насиченою тромбоцитами.
Актуальность. Переломы проксимального отдела плечевой кости (ПОПК) составляют 5–6 % всех повреждений длинных костей скелета человека. С целью увеличения жесткости фиксации хирургическое лечение накостными пластинами дополняют различными алло- или аутотрансплантатами, имплантатами, а также костным цементом (тип В и С по AO/ОТА). Авторами в качестве альтернативного имплантата для замещения дефектов спонгиозной кости и поддержки костных фрагментов головки плечевой кости предлагается использовать полилактид (PLA) Ingeo™ Biopolymer 4032D. Цель работы: провести сравнительный анализ напряженно-деформированного состояния системы «кость — имплантат» накостного остеосинтеза пластиной PHILOS с солидными и пористыми 3D-имплантатами из PLA. Материалы и методы. Для математического моделирования и сравнительного изучения напряженно-деформированного состояния системы «кость — имплантат» при проведении накостного остеосинтеза смоделирована пластина с угловой стабильностью PHILOS (из нержавеющей стали), трехфрагментарный перелом ПОПК с использованием или 2 солидных, или 2 пористых имплантатов PLA с решетчатыми полостями. В качестве объекта для построения плечевой кости использована композитная модель № 3404 левой плечевой кости фирмы Sawbones (Europe AB, Мальме, Швеция), для всех материалов при моделировании — изотропная линейная модель с одинаковыми физико-механическими характеристиками для всех материалов. В качестве инструмента исследования применялся метод конечных элементов, реализованный пакетом прикладных программ Ansys. Результаты. Сравнительная оценка влияния формы имплантатов PLA для двух расчетных схем выполнена при помощи сравнения эквивалентных напряжений по Мизесу и полей деформаций для моделей и различных элементов соединения и частей системы «кость — имплантат». Установлено, что перераспределение полей напряжений в элементах модели не приводит к ее разрушению. Модели и все ее элементы удовлетворяют требованиям прочности. Замена цилиндрического солидного 3D-имплантата на модифицированный пористый 3D-имплантат для поддержания суставной поверхности головки плечевой кости в условиях остеопороза при остеосинтезе трехфрагментарного перелома плечевой кости накостной пластиной PHILOS не снижает жесткости фиксации. Выводы. Сравнительный анализ напряженно-деформированного состояния системы «кость — имплантат» накостного остеосинтеза пластиной PHILOS с солидными и пористыми 3D-имплантатами из PLA показал, что изменение формы имплантатов в рассматриваемом диапазоне нагружения не влияет на жесткость системы. Поля деформаций и напряжений для рассмотренных моделей практически совпадают между собой. В пластине PHILOS и в модифицированных пористых 3D-имплантатах PLA происходит уменьшение напряжений на 5 и 4 МПа соответственно. Замена цилиндрической солидной формы 3D-имплантатов PLA на модифицированную пористую является целесообразной, так как позволяет увеличить площадь контакта имплантата PLA с костью, а его полости возможно использовать для наполнения плазмой, насыщенной тромбоцитами.
Background. Proximal humerus fractures account for 5–6 % of all injuries of the long bones of the human skeleton. In order to increase fixation stiffness, surgical treatment using bone plates is supplemented with various allo- or autografts, implants, as well as bone cement (type B and C according to AO/OTA). The authors suggest the use of Ingeo™ Biopolymer 4032D polylactide (PLA) as an alternative implant for replacing spongy bone defects and supporting bone fragments of the humeral head. The purpose was to conduct a comparative analysis of the stress-strain state of the bone-implant system in bone osteosynthesis using PHILOS plate with solid and porous 3D PLA implants. Material and methods. For mathematical modeling and comparative study of the stress-strain state of bone-implant system during bone osteosynthesis, a plate with angular stability PHILOS (stainless steel), a three-fragment proximal humerus fractures using either 2 solid or 2 porous PLA implants were modeled with lattice cavities. A composite model # 3404 of the left humerus manufactured by Sawbones (Europe AB, Malmö, Sweden) was used as an object for constructing the humerus. For all materials, the simulation used an isotropic linear model with the same physical and mechanical characteristics for all materials. The finite element method implemented by the Ansys application package was used as a research tool. Results. A comparative assessment of the influence of the shape of PLA implants for two calculation models was performed by comparing the equivalent von Mises stresses and deformation fields for models and various elements of the joint and parts of the bone-implant system. It was found that the redistribution of stress fields in the elements of the model does not lead to its destruction. Models and all its elements satisfy the requirements of strength. Replacing a cylindrical solid 3D implant with a modified porous 3D implant to maintain the articular surface of the humeral head under conditions of osteoporosis during osteosynthesis of a three-fragment humerus fracture with PHILOS bone plate does not reduce fixation stiffness. Conclusions. A comparative analysis of the stress-strain state of the bone-implant system in bone osteosynthesis using PHILOS plate with solid and porous 3D PLA implants showed that a change in the implant shape in the considered loading range does not affect the rigidity of the system. The deformation and stress fields for the considered models practically coincide. The stresses in PHILOS plate and in modified porous 3D PLA implants are reduced by 5 and 4 MPa, respectively. Replacing the cylindrical solid form of 3D PLA implants with a modified porous one is appropriate, since it allows us to increase the contact area of the PLA implant with the bone, and its cavities can be filled with platelet-rich plasma.
перелом; проксимальний відділ плечової кістки; система «кістка — імплантат»; накістковий остеосинтез; імплантат
перелом; проксимальный отдел плечевой кости; система «кость — имплантат»; накостный остеосинтез; имплантат
fracture; proximal humerus; bone-implant system; bone osteosynthesis; implant
Введение
Переломы проксимального отдела плечевой кости (ПОПК) составляют 5–6 % всех повреждений длинных костей скелета человека [1–4]. Среди остеопоротических переломов переломы ПОПК являются третьим по частоте повреждением [5]. По данным разных авторов [1–6], 80–85 % переломов ПОПК встречаются у людей старше 50 лет, а значительное увеличение частоты переломов ПОПК наблюдается у пациентов от 60 до 90 лет, с соотношением женщин и мужчин 70 : 30 [1–3]. Последние 50 лет количество переломов ПОПК, по данным авторов [1–6], в разных странах увеличилось в 3 раза. Лечение этой распространенной травмы является не только сложной задачей, но и дискутабельной с точки зрения выбора метода. У 80 % пациентов проводят консервативное лечение, в то же время трех- и четырехфрагментарные переломы ПОПК (тип В и С по AO/ОТА) [7] являются показанием к выполнению хирургического вмешательства. В большинстве исследований, проведенных в последние годы, показано, что хирургическое лечение накостными пластинами с различными алло- или аутотрансплантатами, имплантатами, а также костным цементом используют большинство ортопедических хирургов во всем мире у пациентов старше 55–60 лет, а в ряде случаев (тип С по AO/ОТА) выполняют первичное эндопротезирование плечевого сустава [8–15].
С целью хирургического лечения метафизарных и метадиафизарных переломов плечевой кости авторами [16–19] использовались имплантаты из углеродного материала на основе полиакрилонитрила и вискозы. Доказано, что механические свойства этого углеродного композитного материала близки к костной ткани. Разработанный авторами [17] комбинированный метод остеосинтеза предусматривает возможность использования как металлических, так и углеродных имплантатов, что способствует повышению надежности остеосинтеза без значительного повышения жесткости системы «кость — имплантат».
Прогресс в синтезе новых биополимеров с появлением трехмерной печати позволил рассматривать их в качестве альтернативных имплантатов для замещения дефектов спонгиозной кости и армирования.
На основании экспериментальных результатов [20] авторы предлагают использовать полилактид (PLA) Ingeo™ Biopolymer 4032D в качестве поддерживающего имплантата при проведении накостного остеосинтеза пластинами с угловой стабильностью типа PHILOS для предупреждения вторичного смещения фрагментов головки плечевой кости и перфорации ее фрагментов винтами. Имплантаты из PLA обладают высокой биосовместимостью и выраженными остеоинтегративными свойствами, которые обеспечивают формирование вокруг биоматериала зрелой костной ткани и постепенное врастание костной ткани. В работе [21] выполнено экспериментальное исследование, в котором оценивались: 1) жесткость системы «кость — фиксатор» для различных случаев нагружения; 2) значения наибольшей силы, при которой происходит разрушение кости для наиболее неблагоприятного случая нагружения и соответствующей деформации; 3) величина энергии деформирования, затрачиваемой для разрушения кости, по зонам и виду разрушения модели «кость — фиксатор». Установлено, что наилучшим методом фиксации смоделированного трехфрагментарного перелома ПОПК является накостный металлоостеосинтез пластиной с угловой стабильностью PHILOS из нержавеющей стали с дополнительным армированием фрагмента головки 2 солидными имплантатами из PLA. В то же время возможности современных аддитивных технологий позволяют создавать структурные пористые имплантаты из PLA. Солидные имплантаты из PLA в виде сплошного цилиндра не являются оптимальными, так как имеют постоянную площадь поверхности, которая со временем растворения имплантата уменьшается, но, несмотря на это, увеличивает время рассасывания PLA в кости пациента. Поэтому предлагается использовать имплантат PLA в виде цилиндра с закруглением одного конца цилиндра радиусом, равным половине диаметра, и имеющего внутри решетчатые полости. Аддитивные технологии (3D-печать) позволяют изготовить имплантат данной формы, что увеличивает площадь контакта имплантата PLA. Вопросы биомеханического анализа распределения напряжений в системе «кость — имплантат» при использовании предлагаемого структурного пористого имплантата PLA остаются актуальными и требуют дальнейшего изучения.
Цель работы — провести сравнительный анализ напряженно-деформированного состояния системы «кость — имплантат» накостного остеосинтеза пластиной PHILOS с солидными и пористыми 3D-имплантатами из PLA.
Материалы и методы
Для математического моделирования и сравнительного изучения напряженно-деформированного состояния системы «кость — имплантат» при проведении накостного остеосинтеза смоделирована пластина с угловой стабильностью PHILOS (из нержавеющей стали), трехфрагментарный перелом ПОПК с использованием или 2 солидных, или 2 пористых имплантатов PLA с решетчатыми полостями. На рис. 1 представлены фрагменты 3D-модели системы «кость — имплантат» с различными имплантатами PLA.
В качестве объекта для построения плечевой кости использована композитная модель № 3404 левой плечевой кости фирмы Sawbones (Europe AB, Мальме, Швеция) [22]. Как и в работе [23], для всех материалов при моделировании использована изотропная линейная модель со следующими физико-механическими характеристиками: для кортикальной кости (модуль Юнга Е = 12,65 ГПа, коэффициент Пуассона ν = 0,3, плотность ρ = 1640 кг/м3, допускаемое напряжение [σ] = 157 МПа), для спонгиозной кости (Е = 47 МПа, ν = 0,48, ρ = 200 кг/м3, [σ] = 3,9 МПа), для имплантата PLA (Е = 1,28 Гпа, ν = 0,36, ρ = 1252 кг/м3, [σ] = 70 МПа) и для стали EN14301 (Е = 200 ГПа, ν = 0,28, ρ = 7800 кг/м3, [σ] = 220,0 МПа).
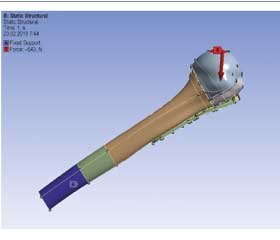
В качестве инструмента исследования использован метод конечных элементов, реализованный пакетом прикладных программ Ansys [24]. Для анализа использован следующий расчетный случай: все модели были наклонены на 52,5º к вертикали, к суставной поверхности (рис. 2) приложена распределенная нагрузка с результирующей силой в 543 Н. Конец кости зафиксирован. Рассматриваемый расчетный случай определяет условия, которые повторяют физиологические нагрузки на проксимальную часть плечевой кости при отведении на 90º, что отражено в работе [25].
Для решения задачи выполнено построение конечно-элементной сетки с размером стороны тетраэдра в 1 мм. На рис. 3 представлена конечно-элементная модель системы «кость — имплантат» при проведении накостного металлоостеосинтеза пластиной с угловой стабильностью PHILOS и 3,5-мм блокируемыми кортикальными и спонгиозными винтами из нержавеющей стали с цилиндрическими имплантатами PLA. В модели с модифицированными пористыми имплантатами PLA дополнительно учтено влияние плазмы крови в виде заданного внутри полостей модифицированного цилиндра давления, равного 8 КПа.
Результаты и обсуждение
Сравнительная оценка влияния формы имплантатов PLA для двух расчетных схем выполнена при помощи сравнения эквивалентных напряжений по Мизесу и полей деформаций для моделей и различных элементов соединения и частей системы «кость — имплантат». Распределение эквивалентных напряжений по Мизесу в моделях представлено на рис. 4.
Распределение эквивалентных напряжений по Мизесу во фрагменте большего бугорка плечевой кости представлено на рис. 5.
Распределение эквивалентных напряжений по Мизесу в головке плечевой кости представлено на рис. 6.
Распределение эквивалентных напряжений по Мизесу в цилиндрических солидных 3D-имплантатах PLA и модифицированных цилиндрических пористых 3D-имплантатах PLA представлено на рис. 7.
Сравнительный анализ представленных результатов математического моделирования системы «кость — имплантат» при проведении накостного металлоостеосинтеза пластиной с угловой стабильностью PHILOS и 3,5-мм блокируемыми кортикальными и спонгиозными винтами из нержавеющей стали с цилиндрическими солидными 3D-имплантатами PLA и модифицированными пористыми 3D-имплантатами PLA показал, что изменение формы и структуры 3D-имплантатов PLA в рассматриваемом диапазоне нагружения не влияет на жесткость системы.
Сравнительный анализ показал, что происходит уменьшение напряжений в системе «кость — имплантат» с модифицированным пористым 3D-имплантатом PLA для следующих элементов: 1) в пластине PHILOS напряжения уменьшились на 5 МПа; 2) по периферической поверхности (кортикальной кости) головки плечевой кости в области большого бугорка напряжения уменьшились на 9 МПа; 3) напряжения в спонгиозной кости на уровне хирургической шейки плечевой кости уменьшились на 0,3 МПа; 4) напряжения в спонгиозной кости головки плечевой кости уменьшились на 0,12 МПа; 5) в модифицированных пористых 3D-имплантатах PLA по сравнению с цилиндрическими солидными 3D-имплантатами PLA напряжения уменьшились на 4 МПа.
Установлено увеличение напряжений в системе «кость — имплантат» с модифицированным пористым 3D-имплантатом PLA для следующих элементов: 1) винты — на 6 МПа; 2) в нижней части кортикальной кости — на 0,1 МПа; 3) в кортикальной кости большего бугорка — на 1,2 МПа; 4) в спонгиозной кости эпиметафизарной части — на 0,4 МПа.
Установлено, что перераспределение полей напряжений в элементах модели не приводит к ее разрушению. Модели и все ее элементы удовлетворяют требованиям прочности. Замена цилиндрического солидного 3D-имплантата на модифицированный пористый 3D-имплантат для поддержания суставной поверхности головки плечевой кости в условиях остео-
пороза при остеосинтезе трехфрагментарного перелома плечевой кости накостной пластиной PHILOS не снижает жесткости фиксации. По нашему мнению, использование модифицированного пористого 3D-имплантата PLA является более целесообразным, так как позволяет увеличить площадь контакта 3D-имплантата PLA, а его полости возможно использовать для наполнения плазмой, насыщенной тромбоцитами.
Согласно рекомендациям AO/OTA, а также многочисленным исследованиям, при хирургическом лечении переломов ПОПК у пациентов с остеопорозом типа В и С необходимо использовать либо костный цемент, либо алло- или аутотрансплантаты для заполнения дефектов спонгиозной кости головки и повышения жесткости фиксации [10–14]. Ряд исследователей доказали высокую эффективность использования композитных углеродных материалов, применяемых для лечения метафизарных и метадиафизарных переломов плечевой кости. Так, результаты исследований показали, что применение внутрикостного стержня их композитного углеродного материала увеличивает жесткость конструкции при увеличении внешней нагрузки, а при использовании для комбинированного остеосинтеза различных материалов (углерода и металла) дает возможность получить оптимальную жесткость конструкции с жесткостью кортикального слоя кости [16–19]. Определенные технические сложности использования данного комбинированного метода остеосинтеза при переломах ПОПК, а также появление новых доступных биополимеров и трехмерных технологий печати позволило авторам в качестве альтернативного имплантата предложить солидные и пористые 3D-имплантаты PLA для заполнения дефектов головки плечевой кости и поддержки фрагментов головки при проведении остеосинтеза накостной пластиной PHILOS.
Выводы
1. Сравнительный анализ напряженно-деформированного состояния системы «кость — имплантат» накостного остеосинтеза пластиной PHILOS с солидными и пористыми 3D-имплантатами из PLA показал, что изменение формы имплантатов в рассматриваемом диапазоне нагружения не влияет на жесткость системы. Поля деформаций и напряжений для рассмотренных моделей практически совпадают между собой.
2. В пластине PHILOS и в модифицированных пористых 3D-имплантатах PLA происходит уменьшение напряжений на 5 и 4 МПа соответственно.
3. Замена цилиндрической солидной формы 3D-имплантатов PLA на модифицированную пористую является целесообразной, так как позволяет увеличить площадь контакта имплантата PLA с костью, а его полости возможно использовать для наполнения плазмой, насыщенной тромбоцитами.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
1. Bergdahl C., Ekholm C., Wennergren D., Nilsson F., Moller M. Epidemiology and patho-anatomical pattern of 2,011 humeral fractures: data from the Swedish Fracture Register. BMC Musculoskeletal Disord. 2016. 17(1). 10. doi: 10.1186/s12891-016-1009-8.
2. Court-Brown C.M., Garg A., McQueen M.M. The epidemiology of proximal humeral fractures. Acta Orthop. Scand. 2001. 72(4). 365-371. doi: 10.1080/000164701753542023.
3. Court-Brown C.M., Caesar B. Epidemiology of adult fractures: a review. Injury. 2006. 37(8). 691-697. doi: 10.1016/j.injury.2006. 04.130.
4. Lill H., Ellwein A., Katthagen C., Voigt C. Osteoporotische Frakturen am proximalen humerus. Chirurg. 2012. 83(10). 858-865. doi: 10.1007/s00104-012-2337-3.
5. Calvo E., Morcillo D., Foruria A.M., Redondo-Santamarіa E., Osorio-Picorne F., Caeiro J.R. Nondisplaced proximal humeral fractures: high incidence among outpatient-treated osteoporotic fractures and severe impact on upper extremity function and patient subjective health perception. J. Shoulder Elbow. Surg. 2011. 20(5). 795-801. doi: 10.1016/j.jse.2010.09.008.
6. Palvanen M., Kannus P., Niemi S., Parkkari J. Update in the epidemiology of proximal humeral fractures. Clin. Orthop. Relat. Res. 2006. 442. 87-92. doi: 10.1097/01.blo.0000194672.79634.78.
7. Garnavos C., Kanakaris N.K., Lasanianos N.G., Tzortzi P., West R.M. New classification system for long-bone fractures supplementing the AO/OTA classification. Orthopedics. 2012. 35(5). Е709-719. doi: 10.3928/01477447-20120426-26.
8. Savin D.D., Zamfirova I., Iannotti J., Goldberg B.A., Youderian A.R. Survey study suggests that reverse total shoulder arthroplasty is becoming the treatment of choice for four-part fractures of the humeral head in the elderly. Int. Orthop. 2016. 40(9). 1919-1925. doi: 10.1007/s00264-016-3227-y.
9. Gerber C., Werner C.M., Vienne P. Internal fixation of complex fractures of the proximal humerus. J. Bone Joint Surg. 2004. 86-B(6). 848-855. doi: 10.1302/0301-620X.86B6.14577.
10. Howard L., Berdusco R., Momoli F., Pollock J., Liew A., Papp S., Lalonde K.A., Gofton W., Ruggiero S., Lapner P. Open reduction internal fixation vs non-operative management in proximal humerus fractures: a prospective, randomized controlled trial protocol. BMC Musculoskeletal Disord. 2018. 19(1). 10. doi: 10.1186/s12891-018-2223.
11. Matziolis D., Kaeaeb M., Zandi S.S., Perka C., Grei-ner S. Surgical treatment of two-part fractures of the proximal humerus: comparison of fixed-angle plate osteosynthesis and Zifko nails. Injury. 2010. 41(10). 1041-1046. doi: 10.1016/j.injury.2010.04.017.
12. Okike K., Lee O.C., Makanji H., Harris M.B., Vrahas M.S. Factors associated with the decision for operative versus non-operative treatment of displaced proximal hume-rus fractures in the elderly. Injury. 2013. 44(4). 448-455. doi: 10.1016/j.injury.2012.09.002.
13. McLaurin T.M. Proximal humerus fractures in the elderly are we operating on too many? Bull Hosp. Jt. Dis. N. Y. N. 2004. 62(1–2). 24-32.
14. Handoll H.H.G., Ollivere B.J., Rollins K.E. Interventions for treating proximal humeral fractures in adults. Cochrane Database Syst. Rev. 2012. 12. CD000434. doi: 10.1002/14651858.CD000434. pub3.
15. Handoll H.H., Keding A., Corbacho B., Brealey S.D., Hewitt C., Rangan A. Five-year follow-up results of the PROFHER trial comparing operative and non-operative treatment of adults with a displaced fracture of the proximal humerus. Bone Joint J. 2017. 99-B(3). 383-392. doi: 10.1302/0301-620X.99B3.BJJ-2016-1028.
16. Тяжелов А.А., Романенко К.К., Органов В.В., Рами М.А. Абу Хамде Самара. Проблемы и перспективы оперативного лечения переломов диафизов длинных костей конечностей на фоне остеопороза. ХІІІ з’їзд ортопедів-травматологів України. Донецьк, 2001. 294-296.
17. Пат. на корисну модель № 46958 UA, МПК (2009) А61В5/103. Спосіб хірургічного лікування метафізарних і метадіафізарних переломів довгих кісток / Тяжелов О.А., Климовицький В.Г., Карпінський М.Ю., Суббота І.А., Гончарова Л.Д., Хадрі Вадід. № u200907801. Заявл. 24.07.2009; Опубл. 11.01.2010. Бюл. № 1.
18. Климовицький В.Г., Хадрі Вадид, Гончарова Л.Д., Гурін І.В., Тяжелов О.А., Карпінський М.Ю., Суббота І.А. Обґрунтування використання нового імплантаційного матеріалу для фіксації метафізарних переломів. Травма. 2010. 11(1). 27-30.
19. Климовицький В.Г., Тяжелов О.А., Хадрі Вадид. Розробка моделі комбінованого остеосинтезу метафізарних переломів із використанням вуглецевих імплантатів. Травма. 2011. 12(1). 35-38.
20. Дєдух Н.В., Нікольченко О.А., Макаров В.Б. Перебудова кістки навколо полілактиду, імплантованого у діафіз стегнової кістки. Вістник проблем біології і медицини. 2018. 1(142). 275-279. doi: 10.29254/2077-4214-2018-1-1-142-275-279.
21. Макаров В.Б., Липовский В.И., Левадный Е.В., Бойко И.В., Лазаренко Г.О. Экспериментальное исследование жесткости фиксации трехфрагментарного перелома проксимального отдела плечевой кости. Ортопедия, травматология и протезирование. 2018. 4(613). 115-121. doi: 10.15674/0030-598720184115-121.
22. Sawbones: biomechanical test materials: A Division of Pacific Research Laboratories [web source]/Sawbones Europe AB, 2018. 16. Available from: http://www.sawbones.com.
23. Pan Y.A.N.G., Ying Z.H.A.N.G., Jian L.I.U., Jin X.I.A.O., Li Min M.A., Chang Rong Z.H.U. Biomechanical effect of medial cortical support and medial screw support on locking plate fixation in proximal humeral fractures with a medial gap: a finite element analysis. Acta Orthop. Traumatol. Turc. 2015. 49(2). 203-209. doi: 10.3944/AOTT.2015.14.0204.
24. Guide to ANSYS Programmable Features, ANSYS Inc., Canonburg, PA, Auguct 2005.
25. Poppen N.K., Walker P.S. Forces at the glenohumeral joint in abduction. Clin. Orthop. Relat. Res. 1978. 135. 165-170.

/64-1.jpg)
/64-2.jpg)
/64-3.jpg)
/65-1.jpg)
/65-2.jpg)
/65-3.jpg)