Международный эндокринологический журнал Том 15, №7, 2019
Вернуться к номеру
Варикозная болезнь и коморбидный сахарный диабет. Сообщение 1. Изменения показателей углеводного метаболизма в крови из локтевых и пораженных вен нижних конечностей
Авторы: Синяченко О.В., Ермолаева М.В., Пилипенко Р.В., Пилипенко В.В., Верзилов С.Н.
Донецкий национальный медицинский университет, г. Лиман, Украина
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. У деяких регіонах від варикозної хвороби вен нижніх кінцівок (ВХ) страждає до 1/4 дорослого населення, причому захворюваність щорічно збільшується. Чинником ризику поширеності й тяжкості перебігу ВХ є цукровий діабет 2-го типу (ЦД2). Вважається, що кожен п’ятий хворий із трофічними виразками шкіри гомілок внаслідок ВХ хворіє на ЦД2. Така коморбідна патологія завдає істотного медичного, соціального й економічного збитку хворим особам і суспільству загалом. Мета: вивчити характер перебігу ВХ та коморбідного ЦД2, оцінити клініко-патогенетичну значущість змін показників вуглеводного метаболізму. Матеріали та методи. Під наглядом перебували 162 хворі на ВХ (19 % чоловіків та 81 % жінок, вік яких у середньому становив 50 років), серед яких співвідношення II, III, IV, V і VI класів венозної недостатності становило 1 : 1 : 3 : 1 : 2. ЦД2 спостерігався в 14 % випадків, при цьому розподіл легкої, середньої тяжкості й тяжкої форми хвороби становив 1 : 2 : 4, а фаз компенсації, субкомпенсації і декомпенсації — 1 : 4 : 6. У крові з ліктьової вени й ураженої вени нижніх кінцівок біохімічними та імуноферментними методами (апарати Olympus-AU-640, Японія; «СФ46», Росія, PR2100-Sanofi diagnostic pasteur, Франція; BIO-RAD-D10, США) вивчено показники глюкози, глікованого гемоглобіну, інсуліну, С-пептиду, фруктозаміну. Результати. ВХ супроводжується змінами вуглеводного обміну, що має гендерні особливості, пов’язано з тяжкістю перебігу і клінічними проявами коморбідного ЦД2 (ангіопатія, нейропатія, артропатія), місцевою продукцією фруктозаміну ураженою веною, при цьому визначається ступінь тяжкості венозної недостатності, залежить від стану варикозної вени (просвіт стовбура, перенесений флеботромбоз) та артеріальної судинної системи. Висновки. ВХ і ЦД2 взаємно обтяжують перебіг один одного, а в патогенетичних побудовах венозної патології беруть участь місцеві зміни вуглеводного метаболізму.
Актуальность. В некоторых регионах варикозной болезнью вен нижних конечностей (ВБ) страдает до 1/4 взрослого населения, причем заболеваемость ежегодно увеличивается. Фактором риска распространенности и тяжелого течения ВБ является сахарный диабет 2-го типа (СД2). Считается, что каждый пятый больной с трофическими язвами кожи голеней вследствие ВБ страдает СД2. Такая коморбидная патология наносит существенный медицинский, социальный и экономический ущерб больным людям и обществу в целом. Цель: изучить характер течения ВБ и коморбидного СД2, оценить клинико-патогенетическую значимость изменений показателей углеводного метаболизма. Материалы и методы. Под наблюдением находились 162 больных ВБ (19 % мужчин и 81 % женщин, возраст которых в среднем составил 50 лет), среди которых соотношение II, III, IV, V и VI классов венозной недостаточности составило 1 : 1 : 3 : 1 : 2. СД2 отмечался в 14 % случаев, при этом распределение легкой, средней тяжести и тяжелой формы болезни составило 1 : 2 : 4, а фаз компенсации, субкомпенсации и декомпенсации — 1 : 4 : 6. В крови из локтевой вены и пораженной вены нижних конечностей биохимическими и иммуноферментными методами (аппараты Olympus-AU-640, Япония; «СФ46», Россия; PR2100-Sanofi diagnostic pasteur, Франция; BIO-RAD-D10, США) изучены показатели глюкозы, гликированного гемоглобина, инсулина, С-пептида, фруктозамина. Результаты. ВБ сопровождается изменениями углеводного обмена, что имеет гендерные особенности, связано с тяжестью течения и клиническими проявлениями коморбидного СД2 (ангиопатия, нейропатия, артропатия), местной продукцией фруктозамина пораженной веной, при этом определяется степень тяжести венозной недостаточности, зависит от состояния варикозной вены (просвет ствола, перенесенный флеботромбоз) и артериальной сосудистой системы. Выводы. ВБ и СД2 взаимно отягощают течение друг друга, а в патогенетических построениях венозной патологии участвуют местные изменения углеводного метаболизма.
Background. In some regions, up to 1/4 of the adult population suffer from varicose vein disease (VVD) of the lower limbs, and its incidence increases every year. A risk factor for the prevalence and severe course of VVD is type 2 diabetes mellitus (DM2). It is believed that every fifth patient with trophic ulcers of the skin of the lower legs suffers from DM2 due to VVD. Such comorbid pathology causes significant medical, social and economic damage to sick people and the society as a whole. The purpose was to study the nature of the course of VVD and comorbid diabetes, to assess the clinical and pathogenetic significance of the changes in carbohydrate metabolism. Materials and methods. Under the survey, there were 162 patients with VVD (19 % of men and 81 % of women with the average age of 50 years) among whom the ratio of classes II, III, IV, V and VI of venous insufficiency was 1 : 1 :3 : 1 : 2. DM2 occurred in 14 % of cases while the distribution of mild, moderate and severe forms of the disease was 1 : 2 : 4 and the ratio of the phases of compensation, subcompensation and decompensation was 1 : 4 : 6. In the blood from the cubital vein and the affected vein of the lower extremities, the levels of glucose, glycosylated hemoglobuin, insulin, C-peptide, fructosamine were studied by biochemical and enzyme immunoassays (devices Olympus-AU-640, Japan, SF46, Russia, PR2100, Sanofi Diagnostics Pasteur, France, BIO-RAD-D10, USA). Results. VVD is accompanied by the changes in carbohydrate metabolism that has gender characteristics and is associated with the severity and clinical manifestations of comorbid DM2 (angiopathy, neuropathy, arthropathy), local production of fructosamine by the affected vein, at the same time determining the severity of venous insufficiency, it depends on the state of the varicose vein (trunk lumen, previous phlebothrombosis) and arterial vascular system. Conclusions. VVD and DM2 aggravate the course of each other, and local changes in carbohydrate metabolism are involved in pathogenetic constructions of venous pathology.
цукровий діабет; варикозна хвороба; вуглеводний метаболізм
сахарный диабет; варикозная болезнь; углеводный метаболизм
diabetes mellitus; varicose veins; carbohydrate metabolism
Введение
Варикозная болезнь (ВБ) является наиболее актуальной проблемой cосудистой хирургии [1, 2], особенно у пациентов с наличием разнообразной коморбидной патологии [3]. Хронической венозной недостаточностью нижних конечностей страдает треть взрослого населения земного шара, а по некоторым данным — каждый второй житель Европы [4, 5], что наносит огромный экономический и медико-социальный ущерб не только пациентам, а и государствам в целом [6, 7].
Фактором риска возникновения и неблаго–приятного течения ВБ является коморбидный сахарный диабет 2-го типа (СД2) [8, 9], существенно ухудшающий качество жизни таких людей [10, 11]. Соотношение пациентов, страдающих СД2 и ВБ, по одним данным, составляет 1 : 2 [12], а по другим — 2 : 1 [13]. Течение хронических язв кожи голеней всегда усугубляется наличием СД2 [14, 15].
В патогенетических построениях варикозного расширения вен немаловажное значение отводится процессам инсулинорезистентности [16–18], а помимо высоких уровней в крови глюкозы (Gl), гликированного гемоглобина (HbA1c) и инсулина (INS) возрастают концентрации С-пептида (СР) и фруктозамина (FA), но роль перечисленных биомаркеров СД2 остается неизученной [19–21].
Цель: определить характер течения ВБ и коморбидного СД2, оценить клинико-патогенетическую значимость изменений показателей углеводного метаболизма в крови из локтевых вен и пораженных вен нижних конечностей.
Материалы и методы
Проведен ретроспективный анализ наблюдения за 162 пациентами с ВБ в возрасте от 31 до 72 лет (в среднем – 49,50 ± 0,61 года). Среди этих больных было 19,1 % мужчин и 80,9 % женщин в возрасте 56,60 ± 1,68 года и 47,80 ± 0,55 года соответственно (t = 6,27, p < 0,001). По классификации СЕАР (Clinical Etiology Anatomy Pathophysiology), выраженный тип венозной недостаточности (С4–С6) установлен в 72,6 % случаев. Средний диаметр ствола целевой вены был равен 6,40 ± 0,16 мм, причем в группе мужчин он оказался достоверно (на 32 %) большим (t = 5,01, p < 0,001). 12,4 % от числа больных ВБ перенесли флеботромбоз, 13,0 % имели приустьевое расширение, 9,3 % — неровный ход венозного ствола. В целом тяжесть течения ВБ у мужчин была большей, а классы венозной недостаточности С5 и С6 отмечены в 3,3 раза чаще, при этом С2 и С3 отсутствовали (χ2 = 349,45, p < 0,001).
Коморбидный СД2 обнаружен у 14,2 % от числа больных (основная группа), в том числе у мужчин с ВБ — в 5,5 раза чаще (соответственно в 41,9 и 7,6 % случаев; χ2 = 24,21, p < 0,001). Легкая форма СД2 диагностирована у 13,0 % больных, средней тяжести — у 30,4 %, тяжелая — у 56,5 %, фаза компенсации заболевания установлена в 8,7 % наблюдений, субкомпенсации — в 34,8 %, декомпенсации — в 56,5 %. Среди осложнений СД2 макроангиопатия имела место в 47,8 % случаев, ретинопатия и артропатия — каждая в 39,1 %, нейропатия — в 34,8%, энцефалопатия — в 21,7 %, нефропатия — в 17,4 %. Среди другой сопутствующей патологии ишемическая болезнь сердца диагностирована в 8,6 % наблюдений, первичная (эссенциальная) артериальная гипертензия — в 14,2 %, гонартроз — в 15,4 %, болезни органов системы пищеварения — в 16,7 %, болезни органов дыхания — в 4,9 %, хронические гепатиты — в 8,0 %, хроническая болезнь почек — в 6,8 %, болезни щитовидной железы — в 5,6 %.
Комплекс обследования был построен на клиническом, ультразвуковом, биохимическом (спектро–фотометрическом, хроматографическом), иммуно–ферментном и статистическом методах исследования. Больным выполняли ультразвуковую допплерографию сосудов (Aplia-XG-Toshiba, Япония, и Sono–Scape-S6, Китай). Исследовали основные биомаркеры СД2: уровни Gl, INS, HbA1/c, СР и FA, причем показатели INS, СР и FA оценивали одновременно в сыворотке крови из локтевой вены (s) и пораженной вены голеней (l). Подсчитывали тяжесть инсулинорезистентности НОМА (Homeostatic Model Assessment). Для определения уровней Gl, CP и FA использовали биохимические анализаторы Olympus-AU-640 (Япония) и BS200 (Китай), а также спектрофотометр «СФ46» (Россия). Определение концентрации INS в крови проводили иммуноферментным методом (ридер PR2100 Sanofi diagnostic pasteur, Франция), показатель HbA1c оценивали методом высокой жидкостной хроматографии на анализаторе BIO-RAD-D10 (США). Проведенное исследование одобрено комиссией по биоэтике Донецкого национального медицинского университета (протокол № 4 от 09.04.2019), больные представили письменное информированное согласие на участие в нем.
Статистическая обработка полученных результатов выполнена с помощью компьютерного вариационного, непараметрического, корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica-StatSoft, США). Оценивали средние значения (M), их стандартные ошибки (SE) и отклонения (SD), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (τ), критерии однофакторного дисперсионного анализа (D) и его однородности Брауна — Форсайта (BF), многофакторного анализа Уилкоксона — Рао (WR), различий Стьюдента (t) и Макнемара — Фишера (χ2), достоверность статистических показателей (р), а также подсчитывали прогностически позитивный результат модели (PPV).
Результаты и их обсуждение
У больных ВБ без коморбидного СД2 (группа сравнения) параметры INSs составили 12,20 ± 4,54 ± 0,39 мкЕ/мл (M ± SD ± SE), INSl — 11,10 ± 5,04 ± 0,43 мкЕ/мл, INSl/s — 86,80 ± 18,29 ± 1,55 %, Gl — 5,40 ± 0,39 ± 0,03 ммоль/л, HOMA — 2,90 ± 1,13 ± 0,10 o.e., HbA1c — 5,10 ± 0,44 ± 0,04 %, CPs — 1,80 ± 1,16 ± 0,10 нг/мл, CPl — 1,9 ± 1,2 ± 0,1 нг/мл, CPl/s — 108,70 ± 28,49 ± 2,42 %, FAs — 255,80 ± 25,65 ± 2,18 ммоль/л, FAl — 262,40 ± 29,05 ± 2,46 ммоль/л, FAl/s — 102,70 ± 6,69 ± 0,57 %. При сопоставлении с группой сравнения коморбидный СД2 при ВБ (основная группа) не сопровождается изменениями показателей INSl и CPl/s. При этом СД2 вызывает повышение концентрации в крови INSs на 80 % (t = 3,95, p < 0,001), Gl — на 82 % (t = 25,10, p < 0,001), уровня НОМА — в 3,2 раза (t = 6,10, p < 0,001), HBA1c — в 2,0 раза (t = 28,06, p < 0,001), CPs и CPl — каждый в 2,1 раза (t = 7,82, p < 0,001 и t = 8,31, p < 0,001 соответственно), FАs — на 16 % (t = 7,17, p < 0,001), FAl — на 23 % (t = 8,67, p < 0,001) и FAl/s — на 6 % (t = 3,53, p = 0,001) при уменьшении INSl/s на 11 % (t = 2,32, p = 0,022) (рис. 1). Только уровни фруктозаминемии в крови больных ВБ из локтевой вены и пораженной вены голеней достоверно отличались между собой, причем это касалось как случаев коморбидного СД2 (t = 2,01, p = 0,045), так и группы сравнения без такой эндокринной патологии (t = 2,74, p = 0,009).
Непараметрический корреляционный анализ Кендалла показал прямые связи тяжести СД2 и класса ВБ (τ = +0,310, p = 0,038), а фазы СД2 — с приустьевым варикозным расширением вены (τ = +0,339, p = 0,024). Кроме того, степень венозной недостаточности прямо коррелирует с наличием и тяжестью диабетической ретинопатии (τ = +0,306, p = 0,041) и нейропатии (τ = +0,306, p = 0,041), тромбозирование вены — с артериосклерозом ног (τ = +0,340, p = 0,023), нефропатией (τ = +0,314, p = 0,036) и нейропатией (τ = +0,441, p = 0,003), диаметр пораженной вены — только с макроангиопатией нижних конечностей (τ = +0,326, p = 0,029), a приустьевое расширение сосуда — с развитием энцефалопатии (τ = +0,339, p = 0,024).
Тяжесть течения СД2 оказывает влияние на класс ВБ (BF = 4,32, p = 0,028), развитие флеботромбоза (BF = 5,42, p = 0,030) и извитость венозного ствола пораженной вены (BF = 10,30, p = 0,004), фаза СД2 — только на формирование венозного тромбоза (BF = 5,39, p = 0,031) и форму пораженного сосуда (BF = 12,80, p = 0,002), а наличие диабетической энцефалопатии связано с приустьевым расширением вены (BF = 4,03, p = 0,040), что демонстрирует анализ Брауна — Форсайта.
На степень венозной недостаточности при ВБ не оказывают достоверного воздействия концентрации инсулинемии в локтевых венах и пораженных сосудах голеней, а класс СЕАР не влияет на содержание в этих объектах исследования фруктозаминемии, хотя отмечаются высокодостоверные (p < 0,001) прямые корреляционные связи Пирсона (соответственно r = +0,367 и r = +0,409). На рис. 2 представлены корреляции параметров INSl/s, CPl/s и FАl/s с классом ВБ.
Среди больных ВБ с СД2 степень венозной недостаточности прямо соотносится с показателем FAl/s, о чем свидетельствует корреляционный и дисперсионный анализ (соответственно r = +0,426, p = 0,025 и D = 2,99, p = 0,047). Необходимо отметить, что класс СЕАР при ВБ оказывает достоверное влияние на уровень у таких больных гликемии (D = 2,93, p = 0,044). С учетом выполненного вариационного, дисперсионного и корреляционного анализа сделано заключение, имеющее практическую направленность: при ВБ с коморбидным СД2 показатель FAl/s > 125 % (> M + SD больных основной группы) рекомендуется использовать для оценки тяжелого течения венозной недостаточности (PPV = 86,4 %).
Обсуждение
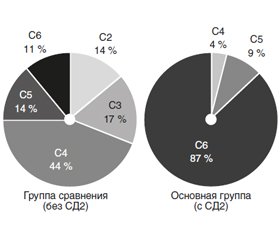
Нами проведен ретроспективный анализ наблюдения за 162 пациентами с ВБ в возрасте от 31 до 72 лет. При этом выраженный тип венозной недостаточности (С4–С6) установлен в 72,6 % случаев. Средний диаметр ствола целевой вены был равен 6,40 ± 0,16 мм, причем в группе мужчин он оказался достоверно (на 32 %) большим (t = 5,01, p < 0,001). 12,4 % от числа больных ВБ перенесли флеботромбоз, 13,0 % имели приустьевое расширение, 9,3 % — неровный ход венозного ствола. В целом тяжесть течения ВБ у мужчин была большей, а С5 и С6 классы венозной недостаточности отмечались в 3,3 раза чаще, при этом С2 и С3 отсутствовали (χ2 = 349,45, p < 0,001).
Как видно из рис. 3, тяжесть течения ВБ на фоне СД2 была намного большей (χ2 = 606,44, p < 0,001). По результатам выполненного многофакторного дисперсионного анализа Уилкоксона — Рао на интегральные показатели углеводного метаболизма оказывают влияние перенесенный флеботромбоз (WR = 9,66, p < 0,001) и наличие приустьевого расширения пораженной вены (WR = 5,44, p < 0,001). Как свидетельствует однофакторный анализ одно–родности дисперсии Брауна — Форсайта, одно–временно от перенесенного флеботромбоза, диаметра и приустьевого расширения пораженной вены зависят параметры INSs, INSl, Gl, CPs и CPl, при этом достоверные прямые корреляционные связи Пирсона c диаметром вены касаются показателей Gl (r = +0,420, p < 0,001), HOMA (r = +0,232, p = 0,003), HbA1c (r = +0,357, p < 0,001), CPs (r = +0,518, p < 0,001), CPl (r = +0,510, p < 0,001), FAs (r = +0,243, p = 0,002) и FAl (r = +0,261, p = 0,001). Взаимоотношений составляющих компонентов углеводного обмена с формой ствола пораженных вен не обнаружено.
Установлено, что изменения углеводного обмена при ВБ имеют гендерные особенности и связаны с тяжестью течения и клиническими проявлениями сопутствующего СД2, продукцией FA пораженной веной, что определяет степень тяжести венозной недостаточности. ВБ и СД2 взаимно отягощают течение друг друга, а в патогенетических построениях венозной патологии участвуют изменения углеводного обмена.
Выводы
ВБ сопровождается изменениями углеводного обмена, что имеет гендерные особенности, связано с тяжестью течения и клиническими проявлениями коморбидного СД2, местной продукцией FA пораженной веной, при этом определяется степень тяжести венозной недостаточности (показатели Gl, HOMA, HbA1c, CP, FA), зависит от состояния варикозной вены (просвета ствола, перенесенного флеботромбоза). ВБ и СД2 взаимно отягощают течение друг друга, а в патогенетических построениях венозной патологии участвуют местные изменения углеводного метаболизма, что диктует необходимость разработки соответствующей корригирующей терапии и у такой категории больных.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.

/537-1.jpg)
/537-2.jpg)
/538-1.jpg)