Международный эндокринологический журнал Том 15, №8, 2019
Вернуться к номеру
Прогнозування гормонально-метаболічних порушень у молодих жінок із надлишковою масою тіла та ожирінням: ефективність застосування штучних нейронних мереж
Авторы: Місюра К.В., Манська К.Г.
ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Актуальність дослідження обумовлена необхідністю створення методологічних підходів до формування груп ризику щодо розвитку метаболічного синдрому — основи виникнення хронічної неінфекційної патології з боку серцево-судинної системи у молодих жінок із надлишком маси тіла різного ступеня. Мета: створення моделей прогнозування розвитку метаболічного синдрому у жінок молодого віку із надлишковою масою тіла та ожирінням — представниць української популяції — з використанням класичних методів статистичного аналізу (дискримінантного аналізу, логістичної регресії) і штучної нейронної мережі та проведення порівняльного аналізу прогностичної точності створених моделей. Матеріали та методи. Обстежено 130 жінок, середній вік яких становив 28,64 ± 6,91 року, з екзогенно-конституційним надлишком маси тіла різного ступеня. Визначали індекс маси тіла, окружність талії. Методом біоімпедансного аналізу — склад тіла (жирову, відносну жирову, безжирову, активну клітинну масу тіла). Імуноферментним методом — рівні інсулін- та лептинемії. Розраховувався індекс НОМA-IR. Секреція мелатоніну оцінювалася за вмістом у сечі його метаболіту 6-сульфатоксимелатоніну за методом Друекса в модифікації Г.В. Зубкова; серотоніну — флуориметричним методом В.І. Кулинського та Л.С. Костюковської. Шляхом анкетування оцінювалась наявність порушень сну та харчової поведінки. Результати. За результатами комплексного лабораторно-інструментального обстеження із використанням методів дискримінантного аналізу, логістичної регресії та штучних нейронних систем створено чотири математичні моделі, що дозволяють за рівнями антропометричних показників, параметрів складу тіла, вуглеводного та ліпідного обміну, показників, що характеризують особливості секреції мелатоніну, оцінити ризик розвитку метаболічного синдрому у жінок молодого віку із надлишком маси тіла різного ступеня — представниць української популяції. Діагностичні характеристики усіх запропонованих моделей (чутливість, специфічність, точність, відношення шансів) досить високі, але найбільша діагностична інформативність визначена щодо моделі з застосуванням штучних нейронних систем, побудованої з використанням програми Statistica StatSoft. Висновки. Застосування такої моделі як інструменту визначення ризику розвитку метаболічного синдрому у конкретних жінок молодого віку із надлишком маси тіла різного ступеня в системі практичної охорони здоров’я дозволить поліпшити ризик-стратифікацію метаболічного синдрому, своєчасно проводити терапію для запобігання його ускладненням.
Актуальность. Актуальность исследования обусловлена необходимостью создания методологических подходов к формированию групп риска развития метаболического синдрома — основы возникновения хронической неинфекционной патологии со стороны сердечно-сосудистой системы у молодых женщин с избытком массы тела разной степени. Цель: создание моделей прогнозирования развития метаболического синдрома у женщин молодого возраста с избыточной массой тела и ожирением — представительниц украинской популяции — с использованием классических методов статистического анализа (дискриминантного анализа, логистической регрессии) и искусственной нейронной сети и проведение сравнительного анализа прогностической точности созданных моделей. Материалы и методы. Обследовано 130 женщин, средний возраст которых составил 28,64 ± 6,91 года, с экзогенно-конституциональным избытком массы тела разной степени. Определяли индекс массы тела, окружность талии. Методом биоимпедансного анализа — состав тела (жировую, относительную жировую, безжировую, активную клеточную массу тела). Иммуноферментным методом — уровни инсулин- и лептинемии. Рассчитывался индекс НОМA-IR. Секреция мелатонина оценивалась по содержанию в моче его метаболита 6-сульфатоксимелатонина (6-СОМТ) по методу Друэкса в модификации Г.В. Зубкова; серотонина — флуориметрическим методом В.И. Кулинского и Л.С. Костюковской. Путем анкетирования оценивалось наличие нарушений сна и пищевого поведения. Результаты. По результатам комплексного лабораторно-инструментального обследования с использованием методов дискриминантного анализа, логистической регрессии и искусственных нейронных систем созданы четыре математические модели, которые позволяют по уровню антропометрических показателей, параметров состава тела, углеводного и липидного обмена, показателей, характеризующих особенности секреции мелатонина, оценить риск развития метаболического синдрома у женщин молодого возраста с избытком массы тела разной степени — представительниц украинской популяции. Диагностические характеристики всех предлагаемых моделей (чувствительность, специфичность, точность, отношение шансов) достаточно высоки, но наибольшая диагностическая информативность определена по модели с применением искусственных нейронных систем, построенной с применением программы Statistica StatSoft. Выводы. Использование такой модели в качестве инструмента определения риска развития МС у конкретных женщин молодого возраста с избытком массы тела разной степени в системе практического здравоохранения позволит улучшить риск-стратификацию метаболического синдрома, своевременно проводить терапию для предотвращения его осложнений.
Background. The relevance of the study is due to the need to create methodological approaches to the formation of risk groups for the development of metabolic syndrome — the basis of chronic non-infectious pathology of the cardiovascular system in young women with excess body weight of varying degrees. The purpose was to create models for predicting the development of metabolic syndrome in young women with overweight and obesity — representatives of the Ukrainian population using classical methods of statistical analysis (discriminant analysis, logistic regression) and artificial neural networks and comparative analysis of the prognostic accuracy of the created models. Materials and methods. One hundred and thirty women with average age of 28.64 ± 6.91 years were examined. They had exogenous constitutional excess body weight of varying degrees. Body mass index and waist circumference were determined. The method of bioimpedance analysis was used to evaluate body composition (fat, relative fat, fat-free, active cell body mass); enzyme immunoassay — to determine the levels of insulin- and leptinemia. The HOMA-IR was calculated. The secretion of melatonin was assessed by the level of its metabolite 6-sulfatoxymelatonin in urine by Druex method modified by G.V. Zubkov; serotonin — by the fluorimetric method of V.I. Kulinsky and L.V. Kostyukovska. The presence of sleep and eating disorders was assessed by questionnaires. Results. According to the results of a comprehensive laboratory and instrumental examination using methods of discriminant analysis, logistic regression and artificial neural networks, four mathematical models were created that allow us to assess the risk of metabolic syndrome in young women with excess body weight of varying degrees — representatives of the Ukrainian population by the levels of anthropometric indicators, parameters of body composition, carbohydrate and lipid metabolism, indicators that characterize the features of melatonin secretion. Conclusions. Diagnostic characteristics of all proposed models (sensitivity, specificity, accuracy, odds ratio) are quite high, but the greatest diagnostic informativeness is determined for the model using artificial neural networks built in the program Statistica StatSoft. The use of such a model as a tool for determining the risk of developing the metabolic syndrome in specific young women with excess body weight of varying degrees in the practical healthcare system will improve the risk-stratification of the metabolic syndrome and provide timely therapy to prevent its complications.
ожиріння; метаболічні порушення; математична модель прогнозування; дискримінантний аналіз; логістична регресія; штучні нейронні системи
ожирение; метаболические нарушения; математическая модель прогнозирования; дискриминантный анализ; логистическая регрессия; искусственные нейронные системы
obesity; metabolic disorders; mathematical predictive model; discriminant analysis; logistic regression; artificial neural networks
Вступ
Згідно з результатами скринінгу надлишкової маси тіла (надлМТ) та ожиріння (ОЖ) серед дорослого населення м. Харкова — представників української популяції (2014–2015 рр.), визначено, що надлишок маси тіла різного ступеня мають 66 % із них, в тому числі 33 % — ОЖ. Важливим результатом цього дослідження стало визначення того факту, що значна частина пацієнтів із надлишком ваги — жінки репродуктивного віку [1], що підтверджується й іншими дослідниками, за даними яких ОЖ реєструється у третини жіночого населення України [2–4]. Вагітність, післяпологовий період, аборт, порушення менструального циклу — важливі фактори ризику ОЖ у цієї категорії населення: вони призводять до ОЖ у 11, 7, 5 та 6 % випадків відповідно [5]. Зрозуміло, що ці фактори ризику характерні для жінок молодого, репродуктивного віку. Тобто ця категорія населення має значний ризик розвитку і прогресування надлишкової маси тіла різного ступеня і потребує особливої уваги при проведенні профілактичних заходів.
Основним завданням профілактичних заходів щодо ОЖ у світі вважається попередження розвитку гормонально–метаболічних і гемодинамічних ускладнень надлишкового накопичення жирової тканини — основи розвитку тяжких інвалідизуючих патологій. Як відомо, разом із зростанням частоти ОЖ в популяції реєструється збільшення поширеності і коморбідних йому хронічних неінфекційних патологій з боку серцево–судинної, ендокринної, нервової, дихальної систем. Їх наявність не тільки погіршує якість життя хворого, але й призводить до його ранньої інвалідизації і передчасної смерті [6–9]. Смертність серед хворих з вираженим ОЖ віком 25–30 років у 12 разів вище, ніж у однолітків з нормальною масою тіла, а віком від 35 до 44 років — у 6 разів [10], що надає проблемі ОЖ не тільки медичну, але й соціальну значущість [11]. Вирішити проблему ОЖ і коморбідних йому патологій можливо тільки при створенні комплексної персоніфікованої системи ранньої профілактики цього захворювання та його ускладнень. Основа для дій у цьому напрямку подана у «Стратегії вирішення проблеми ОЖ в Європейському регіоні», що розроблена ВООЗ вже декілька років тому [12]. Однак в Україні до сього–дні не створено ні національної, ні регіональних програм комплексної профілактики розвитку ОЖ та їх ускладнень [13–15].
Згідно із рекомендаціями експертів, починати їх розробку потрібно із визначення факторів ризику (з урахуванням популяційних особливостей кожного з регіонів) патології та створення алгоритмів виділення із усього загалу груп ризику розвитку ОЖ та ускладнень, що виникають внаслідок надлишкового накопичення жирової тканини в організмі [16].
Щодо останнього пункту. Загальновідомо, що серед пацієнтів із хронічною неінфекційною патологією з боку серцево–судинної та ендокринної систем більшість мають надлМТ або ОЖ [17]. Водночас далеко не в усіх людей з надлишковою масою тіла розвивається цукровий діабет (ЦД) 2–го типу та ішемічна хвороба серця. Зазвичай до групи їх ризику входять особи з так званим метаболічним синдромом (МС), що поєднує різні обмінні порушення та/або захворювання: абдомінальне ОЖ, порушену толерантність до глюкози, підвищений рівень тригліцеридів у плазмі, інсулінорезистентність, гіперглікемію, дисліпідемію, артеріальну гіпертензію, наявність хронічного субклінічного запалення і передтромботичний стан [18, 19].
Незважаючи на велику кількість досліджень, присвячених МС, в Україні не існує методології виділення із усього загалу молодих жінок із надлМТ та ОЖ тих, які мають ризик раннього розвитку цього патологічного кластеру з урахуванням популяційних особливостей. Одна з причин цього — відсутність методу його прогнозування.
На сучасному етапі розвитку медичної науки для прогнозування патологічного стану або нозологічної одиниці використовується метод математичного моделювання, що дозволяє отримати більш точні кількісні оцінки прогнозу шляхом побудови тієї чи іншої відповідної моделі. Навіть вважається, що ступінь розробленості математичних методів в науковій дисципліні натепер є об’єктивною характеристикою глибини знань щодо предмету, який вивчається [20].
Одними із найбільш часто використовуваних (класичних) методів статистичного аналізу на сьогодні є дискримінантний аналіз і логістична регресія.
Дискримінантний аналіз — це розділ статистичного аналізу, призначений для прийняття рішення про розпізнавання образів [21]. За його допомогою на підставі визначених ознак (незалежних змінних) пацієнт може бути зарахований до однієї з двох (або до однієї з кількох) груп, наприклад до групи пацієнтів із МС або здорових пацієнтів.
Логістична регресія, або логіт–регресія (англ. logit model), — це статистичний метод, що застосовується для передбачення ймовірності виникнення деякої події за значеннями певних ознак [21, 22].
Методи дискримінантного аналізу та логістичної регресії — класичні статистичні методи багатовимірного аналізу, досить інформативні інструменти прогнозування. Але вони базуються на лінеаризації залежностей між вихідними (залежними) і вхідними (незалежними) параметрами. А це часто не забезпечує високої точності створених математичних моделей: метаболічні процеси в організмі — багатофакторні системи, що з більшим ступенем інформативності характеризуються нелінійними функціями.
Крім того, на сучасному етапі розвитку медицини, при значному накопиченні інформації щодо етіології, патогенезу, маркерів різних патологічних станів і захворювань, прийняття вірного рішення щодо прогнозу перебігу та наслідків станів, процесів та захворювань неможливо без аналізу великої кількості даних. Для такого аналізу натепер застосовуються інформаційні технології (ІТ): розвивається електронна медицина [23].
Один із напрямків застосування ІТ в рамках медичної науки — нейромоделювання з побудовою штучних нейронних систем (ШНС), або, як їх ще називають, — штучних нейронних мереж, що здатні з високою інформативністю моделювати складні багатофакторні біологічні процеси, у тому числі й метаболічні.
Висока інформативність ШНС щодо моделювання складних процесів на даному етапі розвитку медицини все частіше обумовлює їх використання при створенні сучасних моделей різних біологічних та медичних станів. Побудова ШНС – один із напрямків розробки створення системи штучного інтелекту, концепція якої полягає в тому, щоб гранично близько змоделювати роботу людської нервової системи, її здатність до навчання і коригування помилок. Основна відмінна риса будь–якої нейронної мережі — здатність самостійно навчатися і функціонувати на підставі минулого досвіду, припускаючи з кожним разом все меншу кількість помилок [24–26].
Навчання — одна з головних переваг нейронних мереж перед традиційними алгоритмами, що до цього використовувалися в ІТ. Системи ШНС навчаються виконанню задач (поступово покращують свою продуктивність щодо них), розглядаючи приклади, загалом без спеціального програмування під задачу [27].
ШНС ґрунтується на сукупності з’єднаних вузлів, що називають штучними нейронами (аналогічно до біологічних нейронів у головному мозку тварин). Кожне з’єднання (аналогічне синапсові) між штучними нейронами може передавати сигнал від одного до іншого. Штучний нейрон, що отримує сигнал, може обробляти його та потім сигналізувати приєднаним до нього штучним нейронам [28].
Технічно навчання полягає в знаходженні коефіцієнтів зв’язків між нейронами. В процесі навчання нейронна мережа здатна виявляти складні залежності між вхідними і вихідними даними, а також робити узагальнення. Це означає, що навчена на обмеженій множині даних мережа здатна узагальнювати отриману інформацію і використовуватися з достатньою інформативністю при аналізі даних, що навіть не застосовувалися в процесі навчання [28].
ШНС окрім медичної науки широко використовують при вирішенні різноманітних задач: комп’ю–терне бачення, розпізнавання мовлення, машинний переклад, соціально–мережеве фільтрування тощо [27].
Для створення ШНС використовуються пакети програм як із нейромережевого моделювання (NeuroSolutions, NeuroXL, emergent Neural Network Simulation System, Neural Designer), так і з інтелектуального аналізу даних (data mining) (SAS Enterprise Miner, IBM SPSS Statistics, Statisticа StatSoft, Deductor, SQL Server Busness Intelligence Development Studio, R, Python тощо) [29]. Найбільш розвинені і прості для користування інтерфейси (засіб зручної взаємодії користувача з інформаційною системою) мають пакети програм IBM SPSS Statistics 20, що включає модуль Neural Networks, і Statisticа StatSoft 10 з модулем «авто–матизовані нейронні мережі» [30].
В галузі медичної науки та охорони здоров’я у світі накопичено вже досить багато прикладів ефективного застосування нейронних мереж [31–34]. Переважна більшість із них належить закордонним дослідникам і стосується можливостей використання ШНС для вирішення діагностичних завдань, у тому числі й у хворих з ендокринною патологією [35]. Але повідомлень про створення математичної моделі розвитку МС у жіночого населення України молодого віку, у тому числі із застосуванням ШНС, в літературі не знайдено, що обумовило роботу в цьому напрямку.
Метою дослідження стало створення моделей прогнозування розвитку метаболічного синдрому у жінок молодого віку із надлишковою масою тіла та ожирінням — представниць української популяції — з використанням класичних методів статистичного аналізу (дискримінантного аналізу, логістичної регресії) і штучної нейронної мережі та проведення порівняльного аналізу прогностичної точності створених моделей.
Матеріали та методи
В ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України» в 2011–2019 рр. проведено комплексне дослідження ней–рогормональних та метаболічних особливостей перебігу первинного ОЖ у жінок молодого віку — представниць української популяції.
До обстеження було залучено після підписання інформованої згоди 130 жінок — мешканок м. Харкова, середній вік яких становив 28,64 ± 6,91 року, із екзогенно–конституційним надлишком маси тіла різного ступеня, без тяжкої супутньої патології, які не отримували медикаментозну терапію на момент обстеження та мали ті чи інші порушення сну.
У всіх обстежених вимірювалася маса тіла (МТ), окружність талії і визначався ІМТ.
За величиною ІМТ згідно з класифікаційними критеріями ВООЗ (1997) [36] було сформовано 4 групи обстежених:
— група 1 — жінки з надлМТ (n = 20);
— група 2 — жінки з ОЖ I ступеня (n = 29);
— група 3 — жінки з ОЖ II ступеня (n = 23);
— група 4 — жінки з ОЖ III ступеня (n = 33).
Контрольну групу становили 25 практично здорових жінок з нормальною масою тіла.
Наявність абдомінального типу ОЖ і його вираженість оцінювали згідно з критеріями IDF.
Порушення сну діагностувалось методом анкетування шляхом бальної оцінки суб’єктивних характеристик сну [37].
Клінічне дослідження проводилось у весняно–літній період із дотриманням передбачених у таких випадках заходів безпеки для здоров’я пацієнта, захисту його прав, людської гідності та морально–етичних норм відповідно до принципів Гельсінської декларації прав людини [38], Конвенції Ради Європи про права людини і біомедицини, відповідних законів України, дозволу комісії із біоетики (протокол засідання комісії з питань етики при Державній установі «Інститут проблем ендокринної патології ім. В.Я. Данилевського Національної академії медичних наук України» від 24 жовтня 2019 року № 8).
Лабораторне дослідження включало визначення концентрації глюкози плазми капілярної крові глюкозооксидазним методом за допомогою експрес–аналізатора «Biosen C line» [39].
Секреція мелатоніну оцінювалася за вмістом у сечі його метаболіту 6–сульфатоксімелатоніну (6–СОМТ) за методом Друекса в модифікації Г.В. Зубкова [40]. Збиралася добова сеча з розподілом на денну та нічну фракції (з 8:00 до 20:00 та з 20:00 до 8:00 відповідно), кожна фракція — в окрему ємність. Для аналізу враховувався діурез фракційно (день — ніч) та разом за добу. Безпосередньо для проведення самого аналізу використовувалося не менше 20 мл від кожної фракційної проби. Збір сечі здійснювався з попередньою підготовкою. До дня її збору з раціону не менше ніж за 3 доби виключалися всі фарбуючі продукти (буряк, помідори, морква, чай чорний, какао, кава, шоколад), а також банани (як додаткове джерело триптофану).
Визначення концентрації серотоніну у цільній крові виконано флуориметричним методом В.І. Кулинського та Л.С. Костюковської [41].
Імуноферментні обстеження (метод твердофазного імуноферментного аналізу) включали визначення в крові рівнів циркулюючих інсуліну — із використанням комерційної тест–системи INSULIN ELISA KIT виробництва фірми Monobind (США) та лептину — із застосуванням реактивів на апараті ІmmunnoCHEM 2000; оцінку ліпідного обміну — за рівнями загального холестерину (ЗХС), холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ), тригліцеридів (ТГ) — за допомогою наборів ТОВ НВП «Філісіт–Діагностика» (Україна), «ЛВЩ–холестерин–Ново» (Росія). Розрахунок вмісту в крові холестерину ліпопротеїдів низької щільності (ХС ЛПНЩ), коефіцієнту атерогенності (КА) проводився за загальноприйнятими формулами (Колб В.Г., Камишніков В.С., 1982). Рівень вільних жирних кислот (ВЖК) у крові визначався за методом Данкомба (Duncombe W.C., 1963).
Для визначення ІР проводили розрахунок індексу НОМА (НОМА–ІR) за формулою: HOMA–IR = G0 × Ins0/22,5, де G0 — рівень глюкози в крові натще (ммоль/л), Ins0 — рівень інсуліну в крові натщесерце (мкОД/мл) [42]. Значення HOMA–IР 2,77 і більше розцінювали як наявність ІР (критерії IDF) [43].
Для оцінки структури тіла застосовували біоелектричний імпедансний метод за допомогою моніторного комплексу «КМ–АР–01 Діамант» (ЗАО «Діамант») згідно з інструкцією до експлуатації. Оцінювали такі параметри, як жирова маса (ЖМ) (кг); відносна жирова маса (ВЖМ) — ЖМ/маса тіла (%); безжирова маса (БЖМ) — маса тіла – ЖМ (кг); співвідношення БЖМ/ЖМ; активна клітинна маса (АКМ) — маса всіх клітин, в яких відбуваються метаболічні процеси (кг); співвідношення АКМ/ЖМ.
Визначення характеру харчової поведінки проводили методом анкетування із використанням Голландського опитувальника ХП (Denmark Eating Behavior Questionnaire — DEBQ) [44].
Після проведення комплексного обстеження для створення прогностичних моделей розвитку МС у молодих жінок із надлишком маси тіла різного ступеня за фактом наявності МС (критерії IDF 2005 р.) із усіх 130 обстежених пацієнток було сформовано дві групи: 1) жінки із МС (69 осіб); 2) жінки без МС (61 особа).
Для створення прогностичних моделей на основі отриманих при обстеженні результатів застосовано дискримінантний аналіз, логістичну регресію та створено дві ШНС.
Як відомо, основною метою дискримінантного аналізу є побудова функцій класифікації (класифікаційних функцій) [21]. Функція класифікації визначалася для кожної із груп, на які розподілені пацієнти (групи пацієнтів із МС або здорових осіб).
Zi = bi0 + bi1 x1 + bi2 x2 + bi3 x3 + …, (1)
де x1, x2, x3, … — незалежні змінні, що досліджуються; bi0, bi1, bi2, bi3, … — коефіцієнти функцій класифікації; Zi — функція класифікації групи «i».
При необхідності віднесення пацієнтів до групи здорових осіб або до групи осіб із МС визначалися дві функції класифікації — Z1 і Z2.
Отримані значення класифікаційних функцій Z1 і Z2 порівнювалися. Функція з максимальним значенням визначала приналежність пацієнта до групи з наявністю МС або групи здорових осіб.
Як зазначалось вище, логістична регресія, або логіт–регресія, — це статистичний метод, що застосовується для передбачення ймовірності виникнення деякої події за значеннями певних ознак [21, 22], для чого вводиться так звана залежна змінна y, що має лише одне з двох значень — зазвичай це числа 0 (подія не відбулася) і 1 (подія відбулася), і безліч незалежних змінних (які ще називаються ознаками, предикторами або регресорами) — x1, x2, xn, на основі значень яких обчислюється ймовірність прийняття того чи іншого значення.
Модель логістичної регресії записується рівнянням:
де Р — ймовірність розвитку події, що нас цікавить; e — основа натурального логарифма; y — лінійна комбінація предикторів (дискримінантна функція).
Дискримінантна функція:
y = b0 + b1 x1 + b2 x2+ b3 x3 + …, (3)
де x1, x2, x3, — незалежні змінні; b0, b1, b2, b3, … — постійні коефіцієнти дискримінантної функції.
Для створення ШНС у процесі роботи було використано пакет програм IBM SPSS Statistics 22, що включає модуль Neural Networks, і пакет Statisticа StatSoft 10 з модулем «автоматизовані нейронні мережі» в режимі автоматизованої генерації архітектури мережі на основі процедури «багатошаровий перцептрон» (в англійському інтерфейсі — Multilayer Perceptron).
Для дослідження інформативності опрацьованих моделей розраховано чутливість (відсоток пацієнток, у яких розвинувся МС при попередньо прогнозованому високому ризику), специфічність (відсоток ймовірністі негативного результату при негативному прогнозі), точність (зважене середнє значення поміж чутливістю та специфічністю).
Результати
В процесі аналізу отриманих при комплексному дослідженні результатів на першому етапі було побудовано математичну модель прогнозування МС у молодих жінок із надлишком маси тіла різного ступеня за допомогою методу дискримінантного аналізу.
Спочатку були відібрані незалежні змінні (x1, x2, x3, …) (із усього загалу визначено в процесі даного обстеження молодих жінок біохімічні, гормональні і антропометричні параметри), що мають найбільш значущі характеристики щодо моделі дискримінантної функції.
Як вже зазначалось вище, при виконанні роботи досліджувалося понад 30 параметрів, що досить інформативно характеризують гормонально–метаболічний статус молодих жінок із надлишком маси тіла різного ступеня. За даними літератури та результатами попередніх етапів обстеження з них були відібрані показники, що мають найбільшу інформативність і відіграють важливу роль у розвитку метаболічних порушень у цієї категорії населення, а саме: ІМТ, ОТ, ЖМ, ВЖМ, АКМ, АКМ/ЖМ, БЖМ, БЖМ/ЖМ, САТ, ДАТ, НОМА–IR, рівень у сироватці крові цукру натще, серотоніну, лептину, ВЖК, ЗХС, ТГ, ОХС, ХС ЛПВЩ, ХС ЛПНЩ, KA, вміст у сечі метаболіту мелатоніну 6–СОМТ (у нічній, денній і добовій фракціях), кількість балів, набраних жінками при опитуванні щодо особливостей ХП із застосуванням Голландського опитувальника ХП.
Для виділення факторів, що детермінують появу МС в аналізованій групі хворих, було застосовано дискримінантний аналіз (метод покроковий, з поступовим включенням змінних, що мають найбільше значення статистики F і рівня толерантності 0,01).
Аналіз незалежних змінних дискримінантної функції оцінювався за такими критеріями: лямбда Уїлкса, частна лямбда, тест F–виключення, рівень значущості р. Значення толерантності незалежної змінної обчислювалося як 1 – R2, де R — значення множинної кореляції з усіма іншими змінними, що були включені в модель. Результати визначення й аналізу незалежних змінних, що були відібрані для подальшої побудови дискримінантної функції, надані в табл. 1.
На наступному етапі аналізу було визначено коефіцієнти функцій класифікації (b0, b1, b2, b3, …) (табл. 2).
У подальшому на основі визначених незалежних змінних і коефіцієнтів функцій класифікацій були побудовані функції класифікації (формули 4, 5), за допомогою яких об’єкти (пацієнти) відносяться (класифікуються) до існуючих груп (осіб із МС та без нього).
Функції класифікації подані у вигляді формул:
Z1 = –21,757 + 0,600 × Х1 – 0,816 × Х2 + 0,027 × Х3 – 0,526 × Х4 – 0,277 × Х5, (4)
де Z1 — функція класифікації для групи молодих жінок без наявності МС; Х1 — ОТ, см; Х2 — КА; Х3 — денна фракція 6–СОМТ, нмоль/день; Х4 — HOMA–IR; Х5 — ВЖМ, %.
Z2 = –34,528 + 0,686 × Х1 – 0,065 × Х2 + 0,058 × Х3 – 0,387 × Х4 – 0,265 × Х5, (5)
де Z2 — функція класифікації для групи молодих жінок із наявністю МС; Х1 — ОТ, см; Х2 — КА; Х3 — денна фракція 6–СОМТ, нмоль/день; Х4 — HOMA–IR; Х5 — ВЖМ, %.
Функції класифікації обчислюються за обома формулами (4 та 5). Отримані значення класифікаційних функцій Z1 і Z2 порівнюють. Функція з максимальним значенням буде визначати приналежність пацієнта до групи. Загальна оцінка інформативності та статистичної значущості побудованої моделі щодо наявності або відсутності МС у молодих жінок з надлМТ та ОЖ надана в табл. 3.
Лямбда Уїлкса використовується для перевірки гіпотези про рівність середніх дискримінантних груп. Значення лямбди змінюється від 1 (відсутність дискримінації) до 0 (повна дискримінація). В даному дослідженні значення лямбди Уїлкса дорівнює 0,449, що свідчить про те, що середні значення в підгрупах відрізняються.
Значення лямбди Уїлкса та ксі–квадрату при визначеному числі ступенів свободи і р = 0,0001 вказує на те, що побудована модель дискримінантного аналізу наявності або відсутності МС є значущою.
Завданням наступного етапу стало створення прогностичної моделі розвитку МС у міських мешканок молодого віку — представниць української популяції — із надлишком маси тіла різного ступеня із використанням методу логістичної регресії.
Для цього вводилася так звана залежна змінна y, що мала лише одне з двох значень — зазвичай це числа 0 (подія не відбулася) і 1 (подія відбулася), і безліч незалежних змінних (ознак, предикторів або регресорів) — x1, x2, xn, на основі значень яких обчислюється ймовірність прийняття того чи іншого значення залежної змінної.
Для визначення постійних коефіцієнтів дискримінантної функції (b0, b1, b2, b3, …) було застосовано ітераційний метод Розенброкка (табл. 4).
Статистичну значущість визначених коефіцієнтів перевірено за допомогою методу хі–квадрату Вальда, а всієї моделі — за допомогою критерію ксі–квадрату, значення якого 72,747 вказує на те, що модель є достовірною з вірогідністю помилки 0,01 % (p = 0,0001) (табл. 4).
Використавши формулу (3) та коефіцієнти, що були визначені за методом логістичної регресії, отримано дискримінантну функцію:
у = –10,4539 + 0,0769 × Х1 + 0,6664 × Х2 + 0,0288 × Х3 + 0,1605 × Х4 – 0,0222 × Х5,
де Х1 — ОТ, см; Х2 — КА; Х3 — денна фракція 6–СОМТ, нмоль/день; Х4 — НОМА–IR; Х5 — ВЖМ, %.
На основі значення дискримінантної функції y, отриманого за формулою (3), є можливість розрахувати за формулою (2) прогностичний індекс Р розвитку МС для конкретної пацієнтки.
Згідно з методом логістичної регресії значення прогностичного індексу Р більше за 0,5 (Р > 0,5) вказує на наявність ризику виникнення МС, а менше за 0,5 (Р < 0,5) — на його відсутність (табл. 5).
Далі в роботі проводилась побудова штучних нейронних мереж. Вхідними даними для побудови мереж приймалися: ОТ, см; КА; денна фракція 6–СОМТ, нмоль/день; HOMA–IR; BЖМ, % (незалежні змінні), і залежна змінна, що є ознакою наявності або відсутності МС.
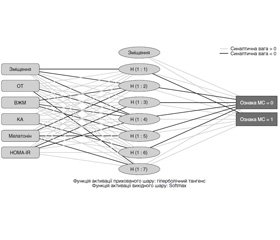
З використанням пакета програм IBM SPSS Statistics 22 була створена на базі архітектури багатошарового перцептрону (multilayer perceptron (MLP)) нейронна мережа. Інформація про склад побудованої мережі надана в табл. 6, а схема мережі — на рис. 1.
Результати класифікації з використанням побудованої та навчаної нейронної мережі на навчальній та контрольній вибірках подані в табл. 7.
Далі в роботі була побудована також на базі архітектури MLP нейронна мережа з використанням пакета програм Statistica StatSoft.
Архітектура нейронної мережі в програмах Statistica StatSoft 10 генерувалася в автоматизованому режимі з визначенням функцій активації для прихованих і вихідних нейронів: число вхідних нейронів відповідало кількості незалежних параметрів, а число прихованих нейронів визначалося в діапазоні від 3 до 30; функції активації для процедури багатошарового перцептрона підбиралися зі списку, що містив тотожню, логістичну, гіперболічну й експонентну функції.
Для оцінки якості прогнозування вхідний набір спостережень був розбитий випадковим чином на наступні підвибірки: навчальна — 70 %, тестова — 15 %, контрольна — 15 %. Навчання проводилося на 50 згенерованих нейронних мережах різної архітектури з вибором 5 кращих мереж по продуктивності навчання (табл. 8).
Найкращу продуктивність із п’яти нейронних мереж показала мережа з архітектурою MLP 5–19–2 (табл. 8).
Результати класифікації з використанням ней–ронної мережі MLP 5–19–2 на навчальній, тестовій та контрольній вибірках подані в табл. 9.
З метою аналізу чутливості, специфічності, точності та відношення шансів побудованих математичних моделей розвитку МС були проаналізовані дані всіх пацієнтів досліджуваних груп. Результати надані в табл. 10.
Підтвердженням високої інформативності побудованих з використанням пакета програм IBM SPSS Statistics 22 і Statistica StatSoft 10 моделей є показник площі під ROC–кривою AUC, що дорівнює 0,974 і 0,987 відповідно (рис. 2, 3).
Тобто всі чотири моделі розвитку МС у молодих жінок із надлишком маси тіла різного ступеня — представниць української популяції — створені в процесі даного дослідження за допомогою методів логістичної регресії та дискримінантного аналізу, нейронного моделювання, характеризуються відмінною чутливістю, специфічністю і точністю. Однак характеристики моделі з використанням ней–ронної мережі, побудованої в Statistica StatSoft з архітектурою MLP 5–19–2 (табл. 9), виявилися найкращими, тому розрахунок прогнозу розвитку МС у даної категорії населення рекомендується проводити із застосуванням останньої.
Застосування її у практиці виглядає таким чином. В пакета програм Statistica StatSoft 10 є можливість зберігати побудовану нейронну мережу на комп’ютері у вигляді окремого файлу з метою подальшої роботи з нею. При завантаженні файла з побудованою і протестованою мережею MLP 5–19–2 користувач має можливість оцінити стан метаболічних порушень для нових пацієнтів. Для цього він вводить у програму для одного або групи пацієнтів значення параметрів: OT, см; КА; денна фракція 6–СОМТ, нмоль/день; HOMA–IR; BЖМ, %. Значення параметрів можуть уводитись безпосередньо в програмі або загружатися з файла, заздалегідь підготовленого, наприклад, в програмі Excel. Далі, після натискання кнопки «оk», програма миттєво видає результати діагностики: «МС», «немає МС».
Також важливим для практичного застосування є те, що побудована для оцінки стану і прогнозування розвитку МС у молодих жінок штучна нейронна мережа може бути використана для автоматичного відтворення в різних власних програмних продуктах, а також у діагностичних і експертних системах профілактичних програм. Для цього в пакетів SPSS Statistics 22 і Statistica StatSoft 10 є можливість експорту вихідних кодів синтаксису команд побудованої нейронної мережі.
Обговорення
Пріоритетним результатом комплексного дослідження нейрогормональних і метаболічних особливостей перебігу первинного ОЖ у жінок молодого віку — представниць української популяції, проведеного в ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України» в 2011–2019 рр., стало створення цілої низки методів прогнозування розвитку МС у даної категорії населення, що потребує на сьогодні активного проведення профілактичних заходів. Розроблені математичні моделі можуть бути використані в практичній медицині для діагностики МС при наданні медичної допомоги населенню на усіх її рівнях, починаючи з первинної ланки. Застосування прогностичного показника дозволить не тільки поліпшити ризик–стратифікацію МС, але і своєчасно проводити терапію для запобігання прогресуванню МС і його ускладнень.
Дані методи можуть бути також використані при розробці методологічних підходів до створення Державної програми профілактики хронічної неінфекційної патології серед населення України — обов’язкового заходу щодо вирішення цієї медичної та соціальної проблеми при одночасному заощадженні фінансових витрат на охорону здоров’я.
При проведенні даної роботи вперше в Україні для вирішення такого завдання було застосовано метод штучного інтелекту: з метою створення методу прогнозування МС у молодих жінок із надлишком маси тіла побудовано штучні нейронні системи, що, як довели результати роботи, мають кращі діагностичні характеристики, ніж моделі, створені за допомогою «класичних» методів медичної статистики (дискримінантного аналізу та логістичної регресії).
Оскільки нейронні мережі базуються на моделюванні роботи і функціонування мозку, на сьогодні вони є одним із пріоритетних напрямків досліджень в галузі штучного інтелекту і розробки на їх базі експертних систем. Побудовані в роботі математичні моделі і штучні нейронні мережі при подальшому їх тестуванні і розвитку можуть становити основу розробки експертних систем в галузі діагностики і прогнозування метаболічних порушень у жінок молодого віку при надлишковій масі тіла й ОЖ. Створення таких продуктів — необхідна умова для запровадження в Україні електронної медицини — медицини XXI століття.
Висновки
1. Доведено, що для прогнозування метаболічного синдрому у молодих жінок — представниць української популяції найбільш інформативним є комплексне визначення таких параметрів, як окружність талії, відносна жирова маса, коефіцієнт атерогенності, індекс НОМА, рівень денної фракції екскреції з сечею метаболіту мелатоніну 6–сульфатоксімелатоніну.
2. При проведенні дослідження розроблено математичні моделі прогнозування розвитку МС за допомогою методів дискримінантного аналізу, логістичної регресії та нейронного моделювання, що характеризуються достатньою чутливістю, специфічністю і точністю.
3. Найбільш високі діагностичні характеристики щодо розрахунку прогнозу розвитку метаболічного синдрому у молодих жінок із надлишком маси тіла різного ступеня показали моделі, створені за допомогою нейронного моделювання.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.

/594-1.jpg)
/595-1.jpg)
/596-1.jpg)
/597-1.jpg)
/597-2.jpg)
/598-1.jpg)
/598-2.jpg)
/599-1.jpg)