Международный эндокринологический журнал Том 15, №8, 2019
Вернуться к номеру
Статеві й вікові особливості змін імунологічних показників у хворих на рак щитоподібної залози і хворих на токсичний зоб після радіойодотерапії
Авторы: Захарченко Т.Ф., Гулеватий С.В., Волинець І.П.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета: провести порівняльний аналіз цитотоксичної активності NK-клітин і метаболічної активності нейтрофілів (НФ) до і після радіойодотерапії (РЙТ) у хворих на диференційований рак щитоподібної залози (ДРЩЗ) залежно від статі, віку, наявності віддалених метастазів і у хворих на токсичний зоб (ТЗ) залежно від статі. Матеріали та методи. Визначили імунологічні показники в трьох групах тиреоїдектомованих хворих із ДРЩЗ. У групу 1 ввійшли 48 осіб (30 жінок, 18 чоловіків) молодого віку (від 11 до 39 років) без віддалених метастазів ДРЩЗ. Групу 2 становили 40 хворих (23 жінки, 17 чоловіків) молодого віку (від 16 до 40 років) із віддаленими метастазами ДРЩЗ. Групу 3 становили 55 хворих (30 жінок, 25 чоловіків) старшого віку (від 41 до 75 років) із віддаленими метастазами ДРЩЗ. Середня кількість курсів РЙТ у жінок групи 1 становила 1,10 ± 0,04, у чоловіків — 1,50 ± 0,24, у жінок групи 2 — 5,4 ± 0,7, у чоловіків — 6,3 ± 0,8. У хворих старшого віку (група 3) середня кількість курсів РЙТ у жінок становила 5,4 ± 0,3, у чоловіків — 5,5 ± 0,7. Визначали імунологічні показники в 30 хворих (22 жінки, 8 чоловіків) із ТЗ віком від 23 до 67 років. Хворі на ТЗ отримали курс РЙТ. Імунологічне дослідження проводили напередодні й у ранній термін (5 чи 6 діб) після РЙТ. Цитотоксичну активність NК-клітин проти індикаторних клітин-мішеней визначали, використовуючи спектрофотометрію. Метаболічну активність НФ досліджували в стандартному тесті відновлення нітросинього тетразолію. Результати. У ранній термін після РЙТ активність NK-клітин знижується в чоловіків молодого віку групи 1. У чоловіків молодого віку групи 2 активність NК-клітин після РЙТ знижується більшою мірою, ніж у групі 1. Активність NК-клітин у чоловіків старшого віку (група 3) і до, і після РЙТ істотно нижча, ніж у жінок, і значно нижча, ніж у чоловіків молодого віку. Після РЙТ метаболічна активність НФ у хворих на ДРЩЗ чоловіків і жінок збільшується в групі 1 і в чоловіків групи 2. У жінок групи 1 цей показник значно більший, ніж у чоловіків. У чоловіків і жінок групи 2 метаболічна активність НФ після РЙТ істотно менша, ніж у хворих групи 1. У хворих на ТЗ осіб чоловічої статі активність NK-клітин напередодні РЙТ нижча, а метаболічна активність НФ значно вища, ніж у жінок. Після РЙТ збільшення активності NК-клітин у хворих на ТЗ більшою мірою відбувається в осіб жіночої статі, а метаболічної активності НФ — в осіб чоловічої статі. Висновки. Порівняльний аналіз результатів дослідження раннього впливу 131І на цитотоксичну активність NK-клітин і метаболічну активність НФ виявив особливості змін цих показників у хворих на ДРЩЗ залежно від віку, статі, наявності віддалених метастазів, у хворих на ТЗ — залежно від статі.
Цель: провести сравнительный анализ цитотоксической активности NK-клеток и метаболической активности нейтрофилов (НФ) до и после радиойодтерапии (РЙТ) у больных дифференцированным раком щитовидной железы (ДРЩЖ) в зависимости от пола, возраста, наличия отдаленных метастазов и у больных токсическим зобом (ТЗ) в зависимости от пола. Материалы и методы. Определили иммунологические показатели в трех группах тиреоидэктомированных больных ДРЩЖ. В группу 1 вошли 48 человек (30 женщин, 18 мужчин) молодого возраста (от 11 до 39 лет) без отдаленных метастазов ДРЩЖ. Группу 2 составили 40 больных (23 женщины, 17 мужчин) молодого возраста (от 16 до 40 лет) с отдаленными метастазами ДРЩЖ. Группу 3 составили 55 больных (30 женщин, 25 мужчин) старшего возраста (от 41 до 75 лет) с отдаленными метастазами ДРЩЖ. Среднее количество курсов РЙТ у женщин группы 1 составило 1,1 ± 0,04, у мужчин — 1,5 ± 0,24, у женщин группы 2 — 5,4 ± 0,7, у мужчин — 6,3 ± 0,8. У больных старшего возраста (группа 3) среднее количество курсов РЙТ у женщин составляло 5,4 ± 0,3, у мужчин — 5,5 ± 0,7. Определили иммунологические показатели у 30 больных (22 женщины, 8 мужчин) ТЗ в возрасте от 23 до 67 лет. Больные ТЗ получили курс РЙТ. Иммунологическое исследование проводили накануне и в ранние сроки (5 или 6 суток) после РЙТ. Цитотоксическую активность NК-клеток против индикаторных клеток-мишеней определяли, используя спектрофотометрию. Метаболическую активность НФ исследовали в стандартном тесте восстановления нитросиним тетразолием. Результаты. В ранние сроки после РЙТ активность NK-клеток снижается у мужчин молодого возраста группы 1. У мужчин молодого возраста группы 2 активность NК-клеток после РЙТ снижается в большей степени, чем в группе 1. Активность NК-клеток у мужчин старшего возраста (группа 3) и до, и после РЙТ существенно ниже, чем у женщин, и значительно ниже, чем у мужчин молодого возраста. После РЙТ метаболическая активность НФ у больных ДРЩЖ мужчин и женщин увеличивается в группе 1 и у мужчин в группе 2. У женщин группы 1 этот показатель значительно больше, чем у мужчин. У мужчин и женщин группы 2 метаболическая активность НФ после РЙТ существенно меньше, чем у больных группы 1. У лиц мужского пола, больных ТЗ, активность NK-клеток накануне РЙТ ниже, а метаболическая активность НФ значительно выше, чем у женщин. После РЙТ увеличение активности NК-клеток у больных ТЗ в большей степени происходит у лиц женского пола, а метаболической активности НФ — у лиц мужского пола. Выводы. Сравнительный анализ результатов исследования раннего влияния 131І на цитотоксическую активность NK-клеток и метаболическую активность НФ установил особенности изменений этих показателей у больных ДРЩЖ в зависимости от возраста, пола, наличия отдаленных метастазов, у больных ТЗ — в зависимости от пола.
Background. The purpose: to carry out a comparative analysis of the cytotoxic activity of natural killer (NK) cells and the metabolic activity of neutrophils before and after radioiodine therapy (RIT) in patients with differentiated thyroid cancer depending on gender, age, the presence of distant metastases and in persons with toxic goiter (toxic goiter) depending on gender. Materials and methods. Immunological parameters were evaluated in three groups of thyroidectomized patients with thyroid cancer. Group 1 included 48 people (30 women, 18 men) of young age (from 11 to 39 years) without distant metastases of thyroid cancer. Group 2 consisted of 40 patients (23 women, 17 men) of young age (from 16 to 40 years) with distant metastases of thyroid cancer. Group 3 consisted of 55 patients (30 women, 25 men) of older age (from 41 to 75 years) with distant metastases of thyroid cancer. The average number of RIT courses in women of group 1 was 1.10 ± 0.04, in men — 1.50 ± 0.24, in women of group 2 — 5.4 ± 0.7, in men — 6.3 ± 0.8. In older patients (group 3), the average number of RIT courses was 5.4 ± 0.3 in women, and 5.5 ± 0.7 in men. Immunological parameters were evaluated in 30 patients (22 women, 8 men) with toxic goiter aged 23 to 67 years. Patients with toxic goiter received a course of RIT. Immunological study was carried out the day before RIT and 5 or 6 days after it. The cytotoxic activity of NK cells against indicator target cells was determined using spectrophotometry. The metabolic activity of neutrophils was studied in a standard test for the reduction of nitroblue tetrazolium. Results. In the early stages after RIT, the activity of NK cells decreased in young men of group 1. In young men of group 2, the activity of NK cells after RIT decreased to a greater extent than in group 1. The activity of NK cells in older men of group 3 both before and after RIT was significantly lower than that of women and significantly lower than that of young men. After RIT, the metabolic activity of neutrophils increased in men and women with thyroid cancer in group 1 and in men of group 2. In women of group 1, this indicator was significantly higher than in men. In men and women of group 2, the metabolic activity of neutrophils after RIT was significantly lower than in patients of group 1. In male patients with toxic goiter, the activity of NK cells the day before RIT was lower, and the metabolic activity of neutrophils was much higher than in women. After RIT, an increase in the activity of NK cells in toxic goiter patients occurs to a greater extent in females, and in the metabolic activity of neutrophils — in males. Conclusions. A comparative analysis of the results of studying the early effect of 131I on the cytotoxic activity of NK cells and the metabolic activity of neutrophils revealed the peculiarities of changes in these parameters in patients with thyroid cancer depending on age, gender, the presence of distant metastases, and in patients with toxic goiter — depending on gender.
рак щитоподібної залози; віддалені метастази; токсичний зоб; радіойодотерапія; активність NK-клітин; метаболічна активність нейтрофілів; вік; чоловіча стать
рак щитовидной железы; отдаленные метастазы; токсический зоб; радиойодтерапия; активность NK-клеток; метаболическая активность нейтрофилов; возраст; мужской пол
thyroid cancer; distant metastases; toxic goiter; radioiodine therapy; NK cell activity; metabolic activity of neutrophils; age; male gender
Вступ
Частота захворюваності на доброякісну й злоякісну патологію щитоподібної залози (ЩЗ) пов’я–зана з ендокринними чинниками, хоча механізми участі статевих гормонів у розвитку тиреопатій остаточно не з’ясовано.
Диференційований рак щитоподібної залози (ДРЩЗ) у жінок трапляється частіше (у 2–4 рази), ніж у чоловіків, але загальна виживаність у жінок вища [1]. Середній вік чоловіків, які захворіли на тиреоїдний рак, вищий, ніж у жінок. При проведенні гендерного аналізу у 2005–2016 рр. найвищий приріст злоякісних новоутворень ЩЗ у віковій структурі відзначався серед жінок віком 30–34 роки й чоловіків віком 40–44 років [2]. З віком частота папілярного РЩЗ у жінок стабілізується, а в чоловіків — збільшується. Ризик раку ЩЗ після постановки діагнозу доброякісних захворювань, у першу чергу аденоми ЩЗ, значно вищий у чоловіків, ніж у жінок, і в більш ранні періоди спостереження [3].
На сьогодні існує декілька міжнародних прогностичних класифікацій перебігу ДРЩЗ, що визначають групи низького й високого ризику прогресування хвороби і смерті. Багатофакторний аналіз показав, що вік хворих до 16 років і понад 45 років, розмір і екстратиреоїдне поширення первинної пухлини, зниження гістологічного диференціювання, інвазія в судини, віддалені метастази й чоловіча стать належать до незалежних прогностичних чинників погіршення прогнозу ДРЩЗ [4]. У чоловіків із папілярним РЩЗ діагностується більша кількість метастазів лімфатичних вузлів і віддалених метастазів, ніж у жінок [5, 6]. Розмір спорадичних пухлинних утворень, папілярного, фолікулярного РЩЗ, а також реґіонарних метастазів був значно більшим у пацієнтів чоловічої статі. Метааналіз виявив, що мутація BRAF V600E пов’язана з метастазами в лімфовузли, екстратиреоїдним поширенням, розміром пухлини, мультифокальністю, відсутністю капсули, папілярним РЩЗ, а також із чоловічою статтю [7]. Утім, стать і гістологічний тип пухлини є найбільш дискутабельними критеріями.
Естрогени й андрогени в різних співвідношеннях продукуються й метаболізуються і в жіночому, і в чоловічому організмі. На метаболізм статевих гормонів впливає дисфункція ЩЗ. В осіб обох статей із гіпертиреозом і гіпотиреозом відбуваються відповідні зміни концентрації глобуліну, що зв’язує статеві гормони (SHBG), і статевих стероїдів. Так, наприклад, у чоловіків із первинним гіпотиреозом у сироватці крові знижується рівень SHBG, циркулюючого загального тестостерону. Приблизно в 60 % чоловіків із гіпотиреозом концентрація вільного тестостерону знижується [8].
Естрогени є потужним стимулятором росту як для нормальних, так і для пухлинних клітин ЩЗ і належать до факторів ризику розвитку РЩЗ. У ракових клітинах ЩЗ експресуються специфічні рецептори естрогенів. В організмі хворих на РЩЗ відповідь на естрогени залежить від різних підтипів цих рецепторів (ERα і ERβ) які, у свою чергу, впливають як на проліферацію, так і на апоптоз пухлинних клітин [9].
Автоімунні захворювання ЩЗ (тиреоїдит Хашимото, хвороба Грейвса) також частіше вражають осіб жіночої статі. У жінок гіпертиреоз діагностують у 5 разів частіше, ніж у чоловіків. Останнім часом кількість захворювань на дифузний токсичний зоб (ДТЗ, хвороба Грейвса) у чоловіків відносно жінок зросла і становить 1 : 5 проти 1 : 12, що відзначалося раніше. Середній вік чоловіків із виявленим ДТЗ менший, ніж у жінок (43,2 ± 1,8 і 47,3 ± 1,8 року відповідно). Тривалість хвороби в чоловіків до радикального лікування значно коротша, ніж у жінок (2 роки проти 7 років відповідно). Пізня діагностика ДТЗ у чоловіків призводить до більш вираженої офтальмопатії, тяжких ускладнень з боку серцево-судинної системи, статевої функції. У чоловіків тиреотоксикоз відрізняється більш агресивним перебігом, поширенням дифузно гіперплазованої ЩЗ за грудину й трахею, появою фокусів злоякісного росту [10]. У хворих на ДТЗ знайдений вузол ЩЗ діагностувався як карцинома частіше в чоловіків, ніж у жінок (21,2 проти 16,1 % відповідно) [11].
Тиреоїдні гормони чинять модулюючий вплив на метаболізм статевих гормонів. Гіпертиреоз у чоловіків, як і в жінок, підвищує в сироватці крові рівень SHBG і знижує при цьому швидкість метаболічного кліренсу статевих стероїдів. Однак тиреотоксикоз по-різному впливає на метаболізм статевих гомонів в осіб обох статей. Так, у жінок тиреотоксикоз збільшує в плазмі крові вміст як жіночих статевих гормонів (естрогенів), так і чоловічих (тестостерону й андростендіону). Хоча в жінок при цьому збільшується і коефіцієнт конверсії андростендіону до естрону й тестостерону до естрадіолу. У чоловіків із тиреотоксикозом концентрація вільного тестостерону зазвичай залишається нормальною або збільшеною, а от концентрація загального й вільного естрадіолу часто буває збільшеною. Також у чоловіків виявлено збільшений синтез прогестерону попри його підвищену конверсію в тестостерон [8].
Результати лікування антитиреоїдними препаратами хвороби Грейвса важко передбачити. Після лікування антитиреоїдними препаратами довгострокова ремісія відзначалась тільки в 56,5 % пацієнтів із хворобою Грейвса. Особливо це стосується осіб чоловічої статі, що зазвичай асоціюється з гіршою відповіддю на тиреостатики, ніж жіноча [10]. Припинення тиреостатичної терапії призводить до швидкого рецидивування хвороби в чоловіків [11].
Радіойодотерапія (РЙТ) є ефективним методом лікування ДРЩЗ і тиреотоксикозу. У хворих на ДРЩЗ після тиреоїдектомії застосовують 131I з активністю від 100 до 200 мКі на одне введення для абляції залишку тиреоїдної тканини, виявлення й лікування регіонарних і віддалених метастазів. Хворі з високим ступенем ризику рецидиву або прогресування ДРЩЗ потребують більш агресивного режиму спостереження й лікування радіойодом. Порівняно з лікуванням карциноми ЩЗ активність 131І для терапії тиреотоксикозу є набагато меншою (від 10 до 22 мКі). Значущими незалежними прогностичними чинниками для РЙТ хвороби Грейвса є величина активності 131I, розмір зоба, а також тяжкість гіпертиреозу й стать. Пацієнтам із більш тяжким гіпертиреозом і середніми або великими розмірами зоба показане призначення 131I вищої активності. Для лікування ДТЗ зазвичай достатньо застосувати один курс РЙТ, однак пацієнти чоловічої статі менш схильні відповісти на одну дозу радіойоду, ніж жінки.
Лімфоїдна система є надзвичайно радіочутливою. Певні популяції і субпопуляції лімфоцитів вважаються маркерами радіаційного ураження. Нейтрофіли, макрофаги, DCs є більш резистентними до опромінення, ніж лімфоцити.
Метою дослідження було провести порівняльний аналіз цитотоксичної активності NK-клітин (natural killer cells) і метаболічної активності нейтрофілів до і після радіойодотерапії у хворих на диференційований рак щитоподібної залози залежно від статі, віку, наявності віддалених метастазів, у хворих на токсичний зоб — залежно від статі.
Матеріали та методи
Обстежено групи хворих на диференційований рак щитоподібної залози і хворих на токсичний зоб, які проходили радіойодотерапію у відділенні радіонуклідної діагностики й терапії (блок для лікування радіофармацевтичними препаратами у відкритому вигляді) ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» і ДУ «Національний інститут раку».
Робота виконана в рамках НДР «Визначити особливості змін системи імунітету у хворих на токсичний зоб і карциному щитоподібної залози за умов лікування радіойодом».
Протягом дослідження дотримувались принципів біоетики: основних положень Конвенції Ради Європи про права людини й біомедицину (від 04.04.1997), GCP (1996), Гельсінської декларації Всесвітньої медичної асоціації про етичні принципи проведення наукових медичних досліджень за участю людини (1964–2000 рр.) і наказу МОЗ України № 281 від 01.11.2000. Усі обстежені особи власноруч і добровільно підписали інформовану згоду про участь у дослідженні. Дослідження схвалене комісією з біомедичної етики ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України» (протокол № 6 від 24.01.2019).
Визначали функцію імунологічних показників у трьох групах тиреоїдектомованих хворих на ДРЩЗ. У групу 1 увійшли 48 осіб (30 жінок, 18 чоловіків) молодого віку (середній вік жінок — 29,9 ± 1,1 року, чоловіків — 26,8 ± 2,4 року) без віддалених метастазів ДРЩЗ. Групу 2 становили 40 хворих (23 жінки, 17 чоловіків) молодого віку (середній вік жінок — 30,0 ± 1,1 року, чоловіків — 27,0 ± 1,0 року) з віддаленими метастазами ДРЩЗ. Групу 3 становили 55 хворих (30 жінок, 25 чоловіків) старшого віку (середній вік жінок — 51,4 ± 1,3 року, чоловіків — 53,0 ± 1,6 року) з віддаленими метастазами ДРЩЗ. Середня кількість курсів РЙТ у жінок групи 1 становила 1,10 ± 0,04, у чоловіків — 1,50 ± 0,24, у жінок групи 2 — 5,4 ± 0,7 курсу, у чоловіків — 6,3 ± 0,8. У хворих старшого віку групи 3 середня кількість курсів РЙТ у жінок становила 5,4 ± 0,3, у чоловіків — 5,5 ± 0,7. Хворі на ДРЩЗ отримували радіойод-131 з активністю від 3700 до 6070 МБк.
Також визначали імунологічні показники у 30 хворих (22 жінки, 8 чоловіків) на токсичний зоб (2 хворих — багатовузловий токсичний зоб (ТЗ), решта — ДТЗ). Середній вік жінок з ТЗ — 45,5 ± 2,7 року, чоловіків — 52,8 ± 2,1 року. Хворі на ТЗ отримали курс РЙТ активністю від 380 до 784 МБк. Імунологічне дослідження проводили напередодні й у ранній термін (5 або 6 діб) після РЙТ. Цитотоксичну активність NК-клітин проти індикаторних клітин-мішеней визначали, використовуючи спектрофотометрію [12]. Метаболічну активність НФ досліджували в стандартному тесті відновлення нітросинім тетразолієм.
Cтатистичне опрацювання одержаних даних проводили з використанням комп’ютерних програм Microsoft Excel, BioStat і критерію (t) Стьюдента. Результати оцінювали за рівнем значущості (p < 0,05).
Результати
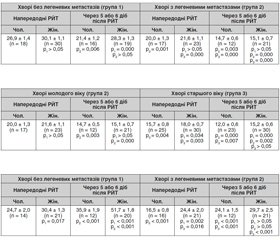
Результати дослідження активності NK-клітин напередодні РЙТ у хворих на ДРЩЗ без віддалених метастазів (група 1) і з віддаленими метастазами (група 2) молодого віку показали відсутність істотної різниці в осіб жіночої і чоловічої статі, хоча рівні активності NK-клітин у групі 2 значно нижчі (табл. 1).
У ранній термін після РЙТ активність NK-клітин у чоловіків групи 1 знижується на 20 % (p = 0,006), на той час як у жінок вона залишається без змін. У групі 2 активність NK-клітин у цей термін після РЙТ істотно (p < 0,001) знижується незалежно від статі. Ступінь зниження активності NК-клітин у чоловіків групи 2 більший (на 27 %), ніж у чоловіків групи 1 (на 20 %).
Результати дослідження активності NК-клітин у хворих на ДРЩЗ із наявністю легеневих метастазів, які лікувались радіойодом, залежно від віку і статі подані в табл. 2. Як видно з даних табл. 2, активність NK-клітин у групі 3 старшого віку і напередодні РЙТ, і після РЙТ значно нижча в осіб чоловічої статі, ніж жіночої.
Порівняльний аналіз одержаних результатів залежно від віку встановив, що активність NК-клітин напередодні РЙТ у чоловіків і жінок, хворих на ДРЩЗ, групи 3 значно (p < 0,01) нижча, ніж у групі 2. У ранній термін після РЙТ активність NК-клітин у групі 3 додатково знижується: у чоловіків — істотніше, ніж у жінок (на 24 і 16 % відповідно). Активність NК-клітин після РЙТ у чоловіків групи 3 на 18 % нижча (p < 0,01), ніж у групі 2, а в жінок групи 3 вона майже не відрізняється. Натомість активність NК-клітин після РЙТ у чоловіків і жінок групи 2 знижується майже однаково (27 і 30 % відповідно).
Результати дослідження метаболічної активності НФ напередодні РЙТ у хворих на ДРЩЗ групи 1 і групи 2 молодого віку показали нижчий показник НФ в осіб чоловічої статі у групі 1 (на 19 %) і у групі 2 (на 32 %), ніж у осіб жіночої статі, а також значно (p < 0,001) меншу активність НФ у чоловіків і жінок групи 2 порівняно з групою 1 (табл. 3).
Після РЙТ метаболічна активність НФ у хворих на ДРЩЗ чоловіків і жінок значно збільшується в групі 1 і в чоловіків групи 2. У жінок групи 1 цей показник збільшується значніше, ніж у чоловіків (на 41 та 31 % відповідно). Після РЙТ метаболічна активність НФ у чоловіків групи 2 збільшується на 32 % (p < 0,001), на той час як у жінок вона не зазнає істотних змін. Метаболічна активність НФ після РЙТ у хворих на ДРЩЗ чоловіків і жінок у групі 2 істотно менша, ніж у групі 1.
Дослідження активності NK-клітин напередодні РЙТ у хворих на ТЗ осіб чоловічої і жіночої статі виявило, що активність NK-клітин у чоловіків на 19 % нижча (p < 0,001), ніж у жінок (табл. 4).
Результати дослідження активності NК-клітин після РЙТ у хворих на ТЗ чоловіків і жінок виявили значне зростання показника. Підвищення активності NК-клітин у хворих на ТЗ після РЙТ більшою мірою відбувається за рахунок осіб жіночої статі (на 44 % — у жінок, на 32 % — у чоловіків).
Дослідження метаболічної активності НФ напередодні РЙТ у хворих на ТЗ обох статей показало, що в чоловіків показник активності НФ вищий (p = 0,006), ніж у жінок (табл. 5).
У ранній термін після РЙТ метаболічна активність НФ периферичної крові у хворих на ТЗ підвищується в чоловіків і залишається високою в жінок. Показник активності НФ після РЙТ у чоловіків істотно (p = 0,003) вищий, ніж у жінок.
Обговорення
Основною функцією NK-клітин і НФ як елементів вродженого імунітету є здійснення імунологічного нагляду, раннє знищення інфікованих і пухлинних клітин в організмі тощо. У хворих на ДРЩЗ зазнає змін здебільшого імунна система, що характеризується недостатністю протипухлинного імунітету, активізацією запального процесу [12, 13].
Звертаючись до джерел літератури, можна відзначити наявність окремих суперечливих публікацій стосовно впливу РЙТ на кількісні показники NК-клітин у хворих на ДРЩЗ і відсутність таких стосовно активності NК-клітин, зокрема, у хворих різної статі [14]. У дослідженнях, проведених нами раніше, було показано, що у хворих старшого віку з віддаленими метастазами ДРЩЗ або без них до і після РЙТ в умовах відміни L-тироксину активність NK-клітин нижча, ніж у хворих молодого віку. Тільки у хворих старшого віку відбувалось додаткове зниження активності NК-клітин після РЙТ незалежно від наявності віддалених метастазів ДРЩЗ. У хворих молодого віку без віддалених метастазів ДРЩЗ не показано значної зміни NК-клітин відносно вихідного значення [12].
Результати дослідження виявили майже однаковий показник активності NK-клітин у чоловіків і жінок напередодні РЙТ, що може зумовлюватись збільшенням рівня естрадіолу (Е2), зниженням концентрації загального й вільного тестостерону в чоловіків, а в жінок — зниженням рівня зв’язаного естрадіолу й тестостерону і збільшенням рівня вільних фракцій цих гормонів в умовах гіпотиреозу [8, 15].
У ранній термін після РЙТ активність NK-клітин у чоловіків молодого віку без віддалених метастазів ДРЩЗ знижується, на той час як у жінок вона залишається без змін. Відмінність цього показника в осіб різної статі, можливо, пояснюється дещо більшою середньою кількістю курсів РЙТ, отриманих особами чоловічої статі (1,50 ± 0,24 курсу — чоловіки, 1,10 ± 0,04 курсу — жінки). У хворих із легеневими метастазами активність NK-клітин після РЙТ істотно знижується незалежно від статі. Хоча середня кількість курсів РЙТ у чоловіків більша (6,3 ± 0,8 курсу в чоловіків, 5,4 ± 0,7 курсу в жінок). Ступінь зниження активності NК-клітин у чоловіків із легеневими метастазами більший (на 27 %), ніж у чоловіків без наявності таких (на 20 %). У хворих із легеневими метастазами старшого віку активність NК-клітин після РЙТ додатково знижується: у чоловіків — істотніше, ніж у жінок. При цьому середня кількість курсів РЙТ у чоловіків і жінок практично однакова (5,5 ± 0,7 і 5,4 ± 0,3 курсу відповідно). Очевидно, в даному випадку має значення гормональний стан організму.
Результати дослідження не суперечать літературним даним, які засвідчили, що в чоловіків, хворих на ДРЩЗ, у віддаленому періоді після РЙТ виявлено нижчі рівні показників клітинного й гуморального імунітету (CD3+-лімфоцити, IgA, IgM, IL-6, циркулюючі імунні комплекси) і вищі рівні CD71+ клітин і IL-1, ніж у жінок [6].
У фізіології тиреоцитів ферменти NADPH-оксидази продукують велику кількість активних форм кисню, що необхідні для біосинтезу гормонів і можуть сприяти високій швидкості спонтанної мутації, виявленої в цій тканині. Естрогени регулюють різні механізми генерації активних форм оксигену (АФО), які впливають на синтез гормонів ЩЗ. Так, наприклад, ЩЗ дорослих самиць щурів виробляла більше перекису водню (Н2O2) і мала менше ферментного антиоксидантного захисту порівняно із залозами самців. Однак гіперпродукція АФО може пошкоджувати клітинні компоненти, особливо ДНК, і таким чином сприяти злоякісній трансформації тиреоїдних клітин [16].
У літературі відсутні відомості щодо впливу статевих гормонів на показники метаболічної активності НФ у хворих на ДРЩЗ. Існують дані, що фізіологічні дози естрадіолу й прогестерону в жінок збільшують вироблення реакційно-здатних кисневих інтермедіатів (ROI) нейтрофілами [17]. У дослідженні in vitro додавання естрадіолу й тестостерону негативно корелювало з базальною продукцією АФО нейтрофілами здорових чоловіків. При цьому внесення тестостерону позитивно асоціювалося зі стимульованою продукцією АФО [18].
Дослідження, проведені нами раніше, показали, що у хворих на ДРЩЗ молодого віку і вихідні показники функції НФ, і показники після РЙТ залежать від наявності легеневих метастазів. У хворих без віддалених метастазів вихідний показник не відрізняється від показника норми, а у хворих з їх наявністю він значно знижений. У хворих із віддаленими метастазами ДРЩЗ вихідне значення функції НФ майже на 30 % нижче від показника у хворих без них. Після курсу РЙТ метаболічна активність НФ зростає більшою мірою в групі без віддалених метастазів ДРЩЗ [12].
В осіб молодого віку чоловічої статі напередодні РЙТ виявлено нижчу метаболічну активність НФ, ніж у жіночої, незалежно від наявності легеневих метастазів ДРЩЗ. Відмінність показника активності НФ у чоловіків і жінок, можливо, зумовлена різним гормональним та імунологічним станом пацієнтів.
У ранній термін після РЙТ метаболічна активність НФ у хворих на ДРЩЗ чоловіків і жінок збільшується в групі без віддалених метастазів і в чоловіків із віддаленими метастазами. У жінок без віддалених метастазів цей показник значно більший, ніж у чоловіків. Виявлення активації НФ після РЙТ у хворих на ДРЩЗ узгоджується з результатами дослідження інших авторів щодо збільшення продукції АФО й зниження рівня антиоксидантів [19]. Можна зробити припущення, що значна активація НФ після РЙТ у хворих без віддалених метастазів ДРЩЗ більшою мірою відбувається за рахунок жіночої статі. Зростання оксигенозалежної активності НФ після РЙТ, можливо, пов’язане з реакцією на опромінення в цих хворих.
Після РЙТ активність НФ у чоловіків молодого віку нижча, ніж у жінок, незалежно від наявності віддалених метастазів ДРЩЗ. У чоловіків і жінок із віддаленими метастазами ДРЩЗ цей показник після РЙТ істотно менший, ніж у хворих без віддалених метастазів ДРЩЗ, що пов’язано, очевидно, з більшою виснаженістю функції НФ, адже кількість отриманих курсів РЙТ у перших більша.
В основі розуміння гендерних відмінностей як непластичних, так і автоімунних тиреоїдних розладів лежить модуляція гормонами репродуктивної системи функції імунних клітин через експресію на них специфічних рецепторів до естрогенів (ERα і ERβ), андрогенів і прогестерону.
Автоімунні захворювання ЩЗ (тиреоїдит Хашимото, хвороба Грейвса), які частіше вражають осіб жіночої статі, пов’язують з дією естрогенів і наявністю в жінок значної кількості автоагресивних клонів Т-лімфоцитів. У чоловіків же під час внутрішньо–утробного розвитку імуносупресивна дія тесто–стерону сприяє негативній імунологічній селекції клонів, здатних реагувати з антигенами власного організму. У здорових жінок порівняно з чоловіками виявлено нижчий рівень клітин із супресорною властивістю, що може бути однією з причин більшої схильності жінок до автоімунних захворювань [20].
При автоімунному тиреоїдиті Хашимото й хворобі Грейвса NK-клітини, нейтрофіли, Т-регуляторні лімфоцити (Treg) та інші входять до складу клітинних інфільтратів ЩЗ. Субпопуляції активованих NK-клітин (CD3–CD16+CD56+) і NKТ-клітин (CD3+CD16+CD56+) можуть бути учасниками автоімунної відповіді, у тому числі в ЩЗ, і проявляти деструктивну дію [21]. NK- і NKТ-клітини, Treg-лімфоцити належать до імунорегуляторних субпопуляцій. Продукуючи цитокіни, ці клітини реципрокно впливають одні на одних, що дає змогу опосередковано оцінити їхній стан. Зменшення супресорної функції Treg-лімфоцитів може призвести до активації NK-клітин, і навпаки. Однак активність NK-клітин у хворих на ТЗ, зокрема у представників різної статі, не з’ясовано.
Дослідження, проведені нами раніше, показали, що у хворих на ТЗ активність NK-клітин напередо–дні РЙТ знижена на 25 % порівняно з групою донорів. У ранній термін після РЙТ активність NK-клітин підвищується на 41 % відносно вихідного значення й перевищує показник у донорів [22].
У хворих на ТЗ осіб чоловічої статі активність NK-клітин напередодні РЙТ значно нижча, ніж у жінок, що може бути пов’язано з різним рівнем статевих гормонів в умовах гіпертиреозу (відміна антитиреоїдних препаратів перед РЙТ) і впливом їх на клітини імунної системи.
Як свідчать дані літератури, у чоловіків із ТЗ у плазмі крові збільшується концентрація і чоловічих, і жіночих гормонів, а в жінок — жіночих гормонів у результаті збільшення естрогенів і конверсії андро–стендіону в естрон і тестостерону в естрадіол [8].
Вплив статевих гормонів на клітини імунної системи залежить від їх концентрації, але питання остаточно не з’ясовано. У здорових чоловіків кількість Treg-лімфоцитів вища, ніж у жінок [20]. Фізіологічні дози естрадіолу, прогестерону пригнічують функцію Т-супресорів, а тестостерону — індукують їх у культурі лімфоцитів периферичної крові [23]. Введення естрогену (17-бета-естрадіол) мишам збільшує кількість CD4+CD25+ регуляторних Т-клітин і рівень експресії на них FoxP3 протеїну [24]. Високі дози 17-бета-естрадіолу викликають значне зниження активності NK-клітин у мишей, опосередковане ER-бета-рецептором [25].
Підвищення активності NК-клітин у хворих на ТЗ після РЙТ відбувається більшою мірою за рахунок осіб жіночої статі. Одним з пояснень цієї відмінності може бути вплив радіойоду на рівень Treg-клітин, який, очевидно, є нижчим у жінок. А зниження рівня Treg-клітин може призвести до активації NK-клітин. За даними літератури, у пацієнтів з автоімунними захворюваннями ЩЗ знижується кількість і активність супресорних Treg-лімфоцитів [26]. У пацієнтів з хворобою Грейвса незабаром після РЙТ виявлено зміни кількості Treg- і NKT-лімфоцитів, зниження супресорної функції Treg-лімфоцитів [27]. Результати дослідження активності NK-клітин у хворих на ТЗ під впливом РЙТ збігаються з даними літератури, що засвідчили підвищення цього показника після проведення РЙТ у пацієнтів із хворобою Грейвса [28].
Важливим чинником патогенезу автоімунних захворювань ЩЗ є оксидативний стрес, опосередкований АФО. Гіперактивовані НФ через секрецію в позаклітинний простір токсичних продуктів — активних форм оксигену здатні викликати інтратиреоїдне запалення й включити програму апоптозу тироцитів і клітин інфільтрату ЩЗ. У пацієнтів, які страждають від хвороби Грейвса, виникає оксидативний стрес, що може збільшити в них клінічні прояви тиреоїдасоційованої автоімунної офтальмопатії [29, 30]. Однак роль НФ в імунопатогенезі автоімунних захворювань ЩЗ, зокрема ДТЗ, і участь цих клітин в оксидативному стресі всього організму залишається нез’ясованою.
Дослідженням, проведеним нами раніше, було показано, що у хворих на ТЗ метаболічна активність НФ периферичної крові напередодні РЙТ збільшена на 20 % порівняно з нормою. У ранній термін після РЙТ активність НФ у хворих на ТЗ вірогідно не змінюється порівняно з вихідним значенням (напередодні РЙТ) і залишається збільшеною [22].
У чоловіків із ТЗ метаболічна активність НФ напередодні РЙТ вища, ніж у жінок, хоча особи обох статей могли перебувати в стані гіпертиреозу, що впливав на активність НФ, оскільки перед РЙТ хворим на ТЗ тиреостатики відмінялися для кращого захоплення радіойоду. Виявлення більшої метаболічної активності НФ у чоловіків із ТЗ напередо–дні РЙТ зумовлено можливим збільшенням у них в умовах гіпертиреозу рівня як тестостерону, так і естрадіолу. З іншого боку, тиреоїдні гормони стимулюють активність НФ [29, 30].
Результати дослідження впливу РЙТ на метаболічну активність НФ у хворих із ТЗ виявили збільшення цього показника здебільшого за рахунок осіб чоловічої статі. Одержані результати узгоджуються з літературними даними, які стверджують, що після введення 131І у пацієнтів з хворобою Грейвса порушується окисно-відновний баланс [30]. Разом з тим існує думка, що інтенсивність оксидативного стресу у хворих із гіпертиреозом залежить не стільки від впливу радіойоду, скільки від стану обміну речовин і щитоподібної залози [31].
Висновки
1. Порівняльний аналіз результатів дослідження раннього ефекту 131І на цитотоксичну активність NK-клітин і метаболічну активність НФ у хворих на ДРЩЗ виявив особливості змін цих показників залежно від віку, статі, наявності віддалених метастазів.
2. У ранній термін після РЙТ активність NK-клітин у чоловіків молодого віку без віддалених метастазів ДРЩЗ знижується, на той час як у жінок вона залишається без змін. У чоловіків молодого віку з наявністю легеневих метастазів активність NК-клітин після РЙТ знижується більше, ніж за їх відсутності. Активність NК-клітин у чоловіків старшого віку з наявністю легеневих метастазів і до, і після РЙТ істотно нижча, ніж у жінок, і значно нижча, ніж у чоловіків молодого віку.
3. Після РЙТ метаболічна активність НФ у хворих на ДРЩЗ чоловіків і жінок збільшується у групі без віддалених метастазів і в чоловіків із віддаленими метастазами. У жінок без віддалених метастазів цей показник значно більший, ніж у чоловіків. Після РЙТ метаболічна активність НФ у чоловіків із віддаленими метастазами збільшується на 32 %, на той час як у жінок вона не зазнає істотних змін. У чоловіків і жінок із віддаленими метастазами ДРЩЗ метаболічна активність НФ після РЙТ істотно менша, ніж у хворих без віддалених метастазів ДРЩЗ.
4. Порівняльний аналіз результатів дослідження раннього ефекту 131І на цитотоксичну активність NK-клітин і метаболічну активність НФ у хворих на ТЗ виявив особливості змін цих показників залежно від статі.
5. Активність NK-клітин напередодні і після РЙТ у хворих на ТЗ у осіб чоловічої статі нижча, ніж у жінок. Після РЙТ збільшення активності NК-клітин у хворих на ТЗ більшою мірою відбувається у осіб жіночої статі.
6. Метаболічна активність НФ напередодні РЙТ у хворих чоловіків із ТЗ значно вища, ніж у жінок. Після РЙТ збільшення метаболічної активності НФ у хворих на ТЗ здебільшого відбувається за рахунок осіб чоловічої статі.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
- Jonklaas J, Nogueras-Gonzalez G, Munsell M, et al. The impact of age and gender on papillary thyroid cancer survival. J Clin Endocrinol Metab. 2012;97(6):E878-87. doi: 10.1210/jc.2011-2864.
- Tkachenko VI, Rimar YaYu. Morbidity and prevalence of malignant neoplasms of the thyroid gland in Ukraine and Kyiv region after the Chernobyl Nuclear Power Plant accident. Mìžnarodnij endokrinologìčnij žurnal. 2019;15(2):152-157. doi: 10.22141/2224-0721.15.2.2019.166109.
- Kitahara CM, K Rmendiné Farkas D, Jørgensen JOL, Cronin-Fenton D2, Sørensen HT. Benign Thyroid Diseases and Risk of Thyroid Cancer: A Nationwide Cohort Study. J Clin Endocrinol Metab. 2018;103(6):2216-2224. doi: 10.1210/jc.2017-02599.
- Cheng F, Chen Y, Zhu L, et al. Risk Factors for Cervical Lymph Node Metastasis of Papillary Thyroid Microcarcinoma: A Single-Center Retrospective Study. Int J Endocrinol. 2019;2019:8579828. doi: 10.1155/2019/8579828.
- Kim MJ, Lee SG, Kim K. et al. Current trends in the features of male thyroid cancer: Retrospective evaluation of their prognostic value. Medicine (Baltimore). 2019;98(19):e15559. doi: 10.1097/MD.0000000000015559.
- Khmara IM. Immunity indices and their dynamics in patients with differentiated forms of thyroid cancer in the course of complex medical rehabilitation. Mediko-biologicheskie problemy zhiznedeiatel’nosti. 2009;1:112-120. (in Russian).
- Li C, Lee KC, Schneider EB, Zeiger MA. BRAF V600E mutation and its association with clinicopathological features of papillary thyroid cancer: a meta-analysis. J Clin Endocrinol Metab. 2012;97(12):4559-70. doi: 10.1210/jc.2012-2104.
- Kumar A, Shekhar S, Dhole B. Thyroid and male reproduction. Indian J Endocrinol Metab. 2014;18(1):23-31. doi: 10.4103/2230-8210.126523.
- Rahbari R, Zhang L, Kebebew E. Thyroid cancer gender disparity. Future Oncol. 2010;6(11):1771-9. doi: 10.2217/fon.10.127.
- Magri F, Zerbini F, Gaiti M, et al. Gender influences the clinical presentation and long-term outcome of Graves’ disease. Endocr Pract. 2016;22(11):1336-1342. doi: 10.4158/EP161350.OR.
- Romanchishen AF, Volert VA, Vabalaite KV, Atabaev AP. Clinical characteristics of a diffuse toxic goiter in men. Endocrine surgery. 2013;7(4):14-20. doi: 10.14341/serg2013414-20. (in Russian).
- Zakharchenko TF, Zamotayeva GA, Gulevaty SV, Volynets IP, Dzhuzha DO. Dynamics of indicators activity of innate immunity in patients with distant metastases differentiated thyroid carcinoma of different age groups after radioiodine therapy. Problems of Endocrine Pathology. 2015;2:35-41. (in Ukrainian).
- Gogali F, Pateracis G, Rassidakis GZ. et al. Phenotypical analysis of lymphocytes with suppressive and regulatory properties (tregs) and NK cells in papillary carcinoma of thyroid. J Clin Endocrinol Metab. 2012 May;97(5):1474-82. doi: 10.1210/jc.2011-1838.
- Tofani A, Sciuto R, Cioffi RP, et al. Radioiodine-induced changes in lymphocyte subsets in patients with differentiated thyroid carcinoma. Eur J Nucl Med. 1999 Aug;26(8):824-9. doi: 10.1007/s002590050455.
- Luchytsky VYe, Luchytsky YeV, Zubkova GA, et al. Levels of gonadotropic and sexual hormones in men with thyroid cancer in the dynamics of treatment. Endokrynologia. 2016;21(2):125-130. (in Ukrainian).
- Faria CC, Peixoto MS, Carvalho DP, Fortunato RS. The emerging role of estrogens in thyroid redox homeostasis and carcinogenesis. Oxid Med Cell Longev. 2019 Jan 9;2019:2514312. doi: 10.1155/2019/2514312.
- Molloy EJ, O’Neill AJ, Grantham JJ, et al. Sex-specific alterations in neutrophil apoptosis: the role of estradiol and progesterone. Blood. 2003 Oct 1;102(7):2653-9. doi: 10.1182/blood-2003-02-0649.
- Sato S, Takahashi I, Komame H, et al. Association of sex steroid hormones with neutrophil function in the general population. Hirosaki Med J. 2016;67:13-27.
- Rosário PW, Batista KC, Calsolari MR. Radioiodine-induced oxidative stress in patients with differentiated thyroid carcinoma and effect of supplementation with vitamins C and E and selenium (antioxidants). Arch Endocrinol Metab. 2016;60(4):328-32. doi: 10.1590/2359-3997000000128.
- Afshan G, Afzal N, Qureshi S. CD4+CD25(hi) regulatory T cells in healthy males and females mediate gender difference in the prevalence of autoimmune diseases. Clin Lab. 2012;58(5-6):567-71.
- Zhang Y, Lv G, Lou X. et al. NKG2A expression and impaired function of NK cells in patients with new onset of Graves’ disease. Int Immunopharmacol. 2015;24(1):133-9. doi: 10.1016/j.intimp.2014.09.020.
- Zakharchenko TF, Gulevaty SV, Volynets IP. Comparative analysis of the activity of cells of innate immunity in patients with benign and malignant disorders of thyroid glands after radiodine therapy. Mìžnarodnij endokrinologìčnij žurnal. 2019;15(3):210-216. doi: 10.22141/2224-0721.15.3.2019.172106. (in Ukrainian).
- Holdstock G, Chastenay BF, Krawitt EL. Effects of testosterone, oestradiol and progesterone on immune regulation. Clin Exp Immunol. 1982;47(2):449-56.
- Polanczyk MJ, Carson BD, Subramanian S, et al. Cutting edge: estrogen drives expansion of the CD4+CD25+ regulatory T cell compartment. J Immunol. 2004;173(4):2227-30. doi: 10.4049/jimmunol.173.4.2227.
- Curran EM, Berghaus LJ, Vernetti NJ, Saporita AJ, Lubahn DB, Estes DM. Natural killer cells express estrogen receptor-alpha and estrogen receptor-beta and can respond to estrogen via a non-estrogen receptor-alpha-mediated pathway. Cell Immunol. 2001;214(1):12-20. doi: 10.1006/cimm.2002.1886.
- Jiang TJ, Cao XL, Luan S. et al. Percentage and function of CD4+CD25+ regulatory T cells in patients with hyperthyroidism. Mol Med Rep. 2018;17(2):2137-2144. doi: 10.3892/mmr.2017.8154.
- Côté-Bigras S, Tran V, Turcotte S, Rola-Pleszczynski M, Verreault J, Rottembourg D. Impaired immune regulation after radioiodine therapy for Graves’ disease and the protective effect of Methimazole. Endocrine. 2016 Jun;52(3):587-96. doi: 10.1007/s12020-015-0832-2.
- Wenzel BE, Chow A, Baur R, Schleusener H, Wall JR. Natural killer cell activity in patients with Graves’ disease and Hashimoto’s thyroiditis. Thyroid. 1998;8(11):1019-1022. doi: 10.1089/thy.1998.8.1019.
- Marcocci C, Leo M, Altea MA. Oxidative stress in Graves’ disease. Eur Thyroid J. 2012;1(2):80-7. doi: 10.1159/000337976.
- Dogadin SA, Dudina MA, Savchenko AA. Respiratory burst activity in neutrophilic granulocytes in the onset of Graves’ disease. Problems of Endocrinology. 2017;63(1):4-8. doi: 10.14341/probl20176314-8. (in Russian).
- Owczarek T, Kowalczyk E, Poliwczak AR, Bała A, Broncel M. The evaluation of selected oxidative stress parameters in patients after radioiodine treatment of hyperthyroidism. Pol Merkur Lekarski. 2012;32(192):382-7.

/613-1.jpg)
/614-1.jpg)