Международный эндокринологический журнал Том 15, №8, 2019
Вернуться к номеру
Віддалені результати корекції метаболічних порушень при синдромі полікістозних яєчників після лікування метформіном
Авторы: Коритко О.О. (1), Паньків І.В. (2)
1 Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
2 ВДНЗУ «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Синдром полікістозних яєчників (СПКЯ) — поліморфне захворювання з надзвичайно варіабельною клінічною картиною та різними фенотипами, що відзначається у 5–10 % жінок репродуктивного віку. Протягом життя у жінок із СПКЯ в 10 разів підвищується ризик розвитку цукрового діабету (ЦД) 2-го типу, в 7 разів — артеріальної гіпертензії та ішемічної хвороби серця, в тому числі інфаркту міокарда, більш ніж удвічі — онкологічних захворювань яєчників, ендометрію, молочної залози. Мета дослідження — проведення аналізу динаміки показників інсулінорезистентності, дисліпідемії, порушеної толерантності до глюкози після лікування метформіном у пацієнток із СПКЯ з використанням показників індексів Caro та НОМА-IR. Матеріали та методи. Проаналізовані 26 історій хвороби пацієнток із СПКЯ, яким за період з 2012 по 2018 р. проводили терапію метформіном протягом шести місяців з моменту постановки діагнозу. Всім пацієнткам в 2018 р. було проведене дослідження ліпідного спектра крові, стандартний глюкозотолерантний тест і дослідження вмісту імунореактивного інсуліну в плазмі венозної крові. Оцінку стану вуглеводного обміну проводили за допомогою розрахункових показників індексів Caro та НОМА-IR. Результати. Результатом застосування метформіну у 26 жінок із СПКЯ й інсулінорезистентністю стало вірогідне зниження рівня імунореактивного інсуліну натще (з 21,4 ± 2,3 до 6,9 ± 0,8 мкОД/мл; р = 0,005) через 6 місяців, в той час як значущих змін рівня глікемії натще не спостерігалося. Відповідно, показник НОМА-IR знизився з 4,38 ± 1,26 до 1,17 ± 0,18 (р = 0,01), а індекс Caro підвищився з 0,24 ± 0,05 до 0,58 ± 0,14 (р = 0,02). Оцінка показників ліпідного обміну через 6 місяців після початку лікування метформіном підтвердила вірогідне зниження рівня холестерину з 5,4 ± 0,3 до 3,6 ± 0,5 ммоль/л (р = 0,01) і рівня тригліцеридів з 1,7 ± 0,2 до 0,8 ± 0,2 ммоль/л (р = 0,03). Обстеження, проведене у 2018 р. в цих же пацієнток, засвідчило збільшення маси тіла не тільки порівняно з показниками через 6 місяців після лікування метформіном, але і з початковими. Спостерігалося вірогідне підвищення рівня холестерину при обстеженні в 2018 р. до 6,7 ± 0,4 ммоль/л (р = 0,01 порівняно з показником після лікування метформіном). Висновки. Жінки із СПКЯ та інсулінорезистентністю, дисліпідемією мають найбільший ризик розвитку ЦД і серцево-судинної патології. Застосування метформіну розглядається як потенційно ефективний метод для подолання інсулінорезистентності, поліпшення гормональних, біохімічних параметрів і можливого зниження кардіоваскулярного ризику при СПКЯ.
Актуальность. Синдром поликистозных яичников (СПКЯ) — полиморфное заболевание с чрезвычайно вариабельной клинической картиной и различными фенотипами, которое встречается у 5–10 % женщин репродуктивного возраста. В течение жизни у женщин с СПКЯ в 10 раз повышается риск развития сахарного диабета (СД) 2-го типа, в 7 раз — артериальной гипертензии и ишемической болезни сердца, в том числе инфаркта миокарда, более чем вдвое — онкологических заболеваний яичников, эндометрия, молочной железы. Цель исследования — проведение анализа динамики показателей инсулинорезистентности, дислипидемии, нарушенной толерантности к глюкозе (НТГ) после лечения метформином у пациенток с СПКЯ с использованием показателей индексов Caro и НОМА-IR. Материалы и методы. Проанализированы 26 историй болезни пациенток с СПКЯ, которым в период с 2012 по 2018 г. проводилось лечение метформином в течение шести месяцев с момента постановки диагноза. У всех пациенток в 2018 г. были проведены исследование липидного спектра крови, стандартный глюкозотолерантный тест и исследование содержания иммунореактивного инсулина в плазме венозной крови. Оценку состояния углеводного обмена проводили с помощью расчетных показателей индексов Caro и НОМА-IR. Результаты. Результатом применения метформина у 26 женщин с СПКЯ и инсулинорезистентностью стало достоверное снижение уровня иммунореактивного инсулина натощак (с 21,4 ± 2,3 до 6,9 ± 0,8 мкЕД/мл, р = 0,005) через 6 месяцев, в то время как значимых изменений уровня гликемии натощак не наблюдалось. Соответственно, показатель НОМА-IR снизился с 4,38 ± 1,26 до 1,17 ± 0,18 (р = 0,01), а индекс Caro повысился с 0,24 ± 0,05 до 0,58 ± 0,14 (р = 0,02). Оценка показателей липидного обмена через 6 месяцев после начала лечения метформином подтвердила достоверное снижение уровня холестерина с 5,4 ± 0,3 до 3,6 ± 0,5 ммоль/л (р = 0,01) и уровня триглицеридов с 1,7 ± 0,2 до 0,8 ± 0,2 ммоль/л (р = 0,03). Обследование, проведенное в 2018 г. у этих же пациенток, показало увеличение массы тела не только по сравнению с показателями через 6 месяцев после лечения метформином, но и с начальными. Наблюдалось достоверное повышение уровня холестерина при обследовании в 2018 г. до 6,7 ± 0,4 ммоль/л (р = 0,01 по сравнению с показателем после лечения метформином). Выводы. Женщины с СПКЯ и инсулинорезистентностью, дислипидемией обладают наибольшим риском развития СД и сердечно-сосудистой патологии. Применение метформина рассматривается как потенциально эффективный метод для преодоления инсулинорезистентности, улучшения гормональных, биохимических параметров и возможного снижения кардиоваскулярного риска при СПКЯ.
Background. Polycystic ovary syndrome (PCOS) is a polymorphic disease with an extremely variable clinical picture and different phenotypes, which is observed in 5–10 % of women of reproductive age. During the life of women with PCOS, the risk of developing type 2 diabetes mellitus is increased by 10 times, arterial hypertension and coronary heart disease — by 7 times, including myocardial infarction, and there was more than double risk of ovarian, endometrial and breast cancer. The purpose of the study was to analyze the dynamics of parameters of insulin resistance (IR), dyslipidemia, impaired glucose tolerance after metformin treatment in PCOS patients using Caro index and HOMA-IR. Materials and methods. Twenty-six case histories of patients with PCOS who were treated with metformin for the period from 2012 to 2018 for six months from the date of diagnosis were analyzed. In 2018, all patients underwent blood lipids study, a standard glucose tolerance test, and immunoreactive insulin content study in venous blood plasma. Carbohydrate metabolism was evaluated using the Caro index and HOMA-IR. Results. Metformin use in 26 women with PCOS and insulin resistance resulted in a significant fasting immunoreactive insulin decrease (from 21.4 ± 2.3 μIU/ml to 6.9 ± 0.8 μIU/ml; p = 0.005) in 6 months, while significant changes in the level of fasting glycemia were not observed. Accordingly, HOMA-IR decreased from 4.38 ± 1.26 to 1.17 ± 0.18 (p = 0.01), and the Caro index increased from 0.24 ± 0.05 to 0.58 ± 0.14 (p = 0.02). Assessment of lipid metabolism 6 months after initiation of metformin treatment confirmed a significant decrease in cholesterol level — from 5.4 ± 0.3 mmol/l to 3.6 ± 0.5 mmol/l (p = 0.01), and triglyceride content — from 1.7 ± 0.2 mmol/l to 0.8 ± 0.2 mmol/l (p = 0.03). A survey conducted in 2018 in the same patients showed an increase in body weight not only compared with indicators 6 months after metformin treatment, but also with baseline. There was a significant increase in cholesterol to 6.7 ± 0.4 mmol/l (p = 0.01 compared with indicator after the metformin treatment) during the 2018 survey. Conclusions. Women with PCOS and insulin resistance, central obesity, dyslipidemia are at highest risk of developing diabetes and cardiovascular pathology. Metformin is considered a potentially effective method to overcome insulin resistance, improve hormonal, biochemical parameters and possibly reduce cardiovascular risk in PCOS.
синдром полікістозних яєчників; метформін; інсулінорезистентність; чинники ризику
синдром поликистозных яичников; метформин; инсулинорезистентность; факторы риска
polycystic ovary syndrome; metformin; insulin resistance; risk factors
Вступ
Синдром полікістозних яєчників (СПКЯ) — поліморфна патологія з надзвичайно варіабельною клінічною картиною і різними фенотипами, що ускладнюють діагностику. СПКЯ спостерігається у 5–10 % жінок репродуктивного віку [1], має вагоме соціальне значення, адже призводить до безпліддя, зниження якості життя, частого розвитку депресивних станів. Основне значення в патогенезі цього синдрому відводиться гіперінсулінемічній інсулінорезистентності (ІР) [2, 3]. Ще наприкінці 80-х років минулого століття розвиток СПКЯ пов’язували з ІР і компенсаторною гіперінсулінемією (ГІ) [4]. Однак і дотепер немає повної картини патогенезу цього багатокомпонентного синдрому.
Для оцінки ІР розроблена низка методів, серед яких золотим стандартом залишається метод еуглікемічного гіперінсулінемічного клемпа. І хоча він дозволяє найточніше визначати рівень ІР, рутинне застосування цього методу в клініці проблематичне. Тому були розроблені інші методи тестування, які й використовуються на сьогодні. Один із них — метод HOMA-IR (Homeostasis Model Assessent — Insulin Resistance) — ґрунтується на математичному моделюванні гомеостазу глюкози [5]. D. Мetthews (1985 р.) вивчив кореляційну залежність між клемп-методом і НОМА-IR і виявив високий ступінь кореляції (r = 0,83 для групи здорових і r = 0,92 для групи хворих на цукровий діабет (ЦД) 2-го типу). На думку F. Caro (1991 р.), вірогідним критерієм наявності ІР є зниження співвідношення концентрації глюкози крові натще (ммоль/л) і рівня імунореактивного інсуліну (ІРІ) натще (в мкОД/мл) нижче за 0,33.
Протягом життя у жінок із СПКЯ в 10 разів підвищується ризик розвитку ЦД 2-го типу, в 7 разів — артеріальної гіпертензії (АГ) та ішемічної хвороби серця (ІХС), в тому числі інфаркту міокарда, більш ніж удвічі — онкологічних захворювань яєчників, ендометрію, молочної залози [6]. Враховуючи численні метаболічні порушення при СПКЯ, постає багато питань щодо серцево-судинного ризику й інших віддалених наслідків для здоров’я у жінок з таким діагнозом [7].
Ожиріння і метаболічні розлади належать до визнаних чинників ризику розвитку ІХС в загальній популяції. Водночас це вагомі симптоми СПКЯ. Жінки із СПКЯ належать до групи підвищеного ризику розвитку ІХС, оскільки це захворювання в них розвивається раніше, ніж у здорових жінок. З урахуванням концепції про роль ІР у патогенезі СПКЯ як однієї зі складових метаболічного синдрому значний інтерес у лікуванні цієї патології становлять препарати групи метформіну як сенситайзери до інсуліну.
В одному з досліджень 26 жінкам із СПКЯ на тлі ожиріння був призначений метформін у дозі 1500 мг на день протягом восьми тижнів. По закінченні терміну терапії було виявлено вірогідне зниження рівнів інсуліну і тестостерону в крові. На додаток до цих результатів у трьох із 26 жінок настала вагітність [8].
Однак застосування метформіну у пацієнток з метаболічним синдромом (в тому числі при СПКЯ) дотепер залишається дискутабельним. Слід відзначити, що на конгресі ESHRE/ASRM-Sponsored PCOS (2008 р.) робоча група з клінічної практики не рекомендувала метформін як першу лінію лікування СПКЯ, за винятком жінок з порушенням толерантності до глюкози.
Мета дослідження — проведення аналізу динаміки показників інсулінорезистентності, дисліпідемії, порушеної толерантності до глюкози після лікування метформіном у пацієнток із СПКЯ з використанням показників індексів Caro та НОМА-IR.
Матеріали та методи
Нами проаналізовані 26 історій хвороби пацієнток із СПКЯ, яким за період з 2012 по 2018 р. проводили терапію метформіном протягом шести місяців з моменту постановки діагнозу. Діагноз СПКЯ був встановлений на підставі критеріїв Світового консенсусу Європейського товариства репродукції людини й ембріології, Американського товариства репродуктивної медицини (Роттердам, Нідерланди, 2003) [3].
Для визначення ступеня ожиріння у всіх хворих розраховували індекс маси тіла (ІМТ), при цьому ІМТ від 18,5 до 24,9 кг/м2 відповідав нормальній масі тіла, від 25 до 29,9 кг/м2 — надлишковій масі тіла, від 30 кг/м2 і більше — ожирінню. Критерієм включення до групи була інформація з даних історій хвороби про вміст ліпідів в сироватці крові, глюкози в рамках класичного перорального глюкозотолерантного тесту (ПГТТ), рівень інсуліну натще. Для медикаментозного лікування використовували метформін у дозі до 1500 мг на добу протягом шести місяців.
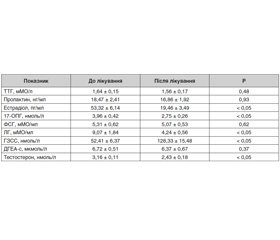
Гормональний статус вивчали шляхом визначення в крові базальних рівнів лютеїнізуючого гормона (ЛГ), фолікулостимулюючого гормона (ФСГ), пролактину (ПРЛ), тиреотропного гормона (ТТГ), 17-гідроксипрогестерону (17-ОПГ), естрадіолу (Е2), дегідроепіандростерон-сульфату (ДГЕА-с), глобуліну, що зв’язує статеві стероїди (ГЗСС), тестостерону.
Всім пацієнткам в 2018 р. було проведене дослідження ліпідного спектра крові (загальний холестерин, холестерин ліпопротеїнів низької щільності (ЛПНЩ), ліпопротеїнів високої щільності (ЛПВЩ), тригліцериди), стандартний ПГТТ з визначенням базальних рівнів глюкози і через 2 год та імунореактивного інсуліну (ІРІ) в плазмі венозної крові. Оцінку стану вуглеводного обміну проводили за допомогою розрахункових показників індексів Caro та НОМА-IR.
Проведення дослідження було схвалене комісією з біоетики Львівського національного медичного університету імені Данила Галицького (протокол № 9 від 18.09.2018 р.).
Статистичну обробку даних проводили з використанням пакета Statistica 10. У порівнюваних групах визначали середню арифметичну (М) і стандартну помилку середнього (m). Статистично значущим для всіх показників вважали критерій вірогідності р < 0,05.
Результати
26 жінок із СПКЯ та ІР віком 24,7 ± 4,3 року отримували препарати метформіну в дозі 1500 мг на добу протягом шести місяців. Препарат призначали за наростаючою схемою: перший тиждень — 500 мг, другий тиждень — 1000 мг, з третього тижня — 1500 мг на добу протягом шести місяців. На тлі лікування метформіном рекомендували дотримуватися раціонального збалансованого харчування. Через 6 місяців відзначали зниження ІМТ з 29,3 ± 1,8 до 27,1 ± 0,8, однак показник не досягнув рівня статистичної значущості.
Результатом застосування метформіну у 26 жінок із СПКЯ і ІР стало вірогідне зниження рівня ІРІ натще (з 21,4 ± 2,3 до 6,9 ± 0,8 мкОД/мл; р = 0,005) через 6 місяців, в той час як значущих змін рівня глікемії натще не спостерігалося. Відповідно, показник НОМА-IR знизився з 4,38 ± 1,26 до 1,17 ± 0,18 (р = 0,01), а індекс Caro підвищився з 0,24 ± 0,05 до 0,58 ± 0,14 (р = 0,02).
Оцінка показників ліпідного обміну через 6 місяців після початку лікування метформіном підтвердила вірогідне зниження рівня холестерину з 5,4 ± 0,3 до 3,6 ± 0,5 ммоль/л (р = 0,01) і рівня тригліцеридів з 1,7 ± 0,2 до 0,8 ± 0,2 ммоль/л (р = 0,03). Також спостерігалася тенденція до нормалізації рівнів ЛПНЩ і ЛПВЩ. Як бачимо, застосування метформіну у жінок із СПКЯ на тлі ІР призводить до нормалізації чутливості до інсуліну за рахунок як зменшення маси тіла, так і безпосередньої дії метформіну на вуглеводний обмін, а також до нормалізації ліпідного обміну.
При дослідженні гормонального статусу виявлено вірогідно значуще зниження значень ЛГ, тесто–стерону, 17-ОПГ; підвищення рівня ГЗСС (табл. 1). Також відзначається статистично значуще зниження естрадіолу через 6 місяців після лікування. Інші показники не зазнали вірогідно значущих змін на тлі лікування. У трьох жінок через 6–12 місяців настала бажана вагітність із позитивним завершенням.
Відомо, що метформін виявляє гіполіпідемічну дію як у хворих на ЦД 2-го типу, так і в осіб з нормальною толерантністю до глюкози, з ожирінням або без нього, що мають дисліпідемію і АГ [9, 10].
У 2018 р. цим же пацієнткам проведено динамічний контроль стану ІР, ліпідного спектра, даних вуглеводного обміну. Обстеження засвідчило збільшення маси тіла у пацієнток цієї групи не тільки порівняно з показниками через 6 місяців після лікування метформіном, але й з початковими. Крім того, результати обстеження підтвердили вірогідне підвищення рівня холестерину при обстеженні в 2018 р. до 6,7 ± 0,4 ммоль/л (р = 0,01 порівняно з показником після лікування метформіном). При цьому відзначалося вірогідне зниження рівня холестерину ЛПНЩ з 2,3 ± 0,2 до 0,9 ± 0,2 ммоль/л (р = 0,01) через 6 місяців застосування метформіну і відносне підвищення при обстеженні в 2018 р. до 3,2 ± 0,3 ммоль/л (p > 0,05), а також спостерігалося вірогідне підвищення рівня тригліцеридів до 2,8 ± 0,4 (р = 0,02).
Попереднє застосування метформіну упродовж шести місяців не впливало на рівні глікемії натще у пацієнток при обстеженні в 2018 р. порівняно з початковими даними (р = 0,07). Відзначено деяке підвищення ступеня вираженості ІР (згідно з індексами Caro і HOMA-IR) у пацієнток досліджуваної групи в 2018 р. порівняно з показниками в процесі лікування метформіном. Однак порівняно з вихідними даними ступінь ІР менш виражений. Так, спостерігалося підвищення вмісту ІРІ натще до 10,8 ± 2,4 мкОД/мл (р = 0,001). У 2018 р. індекс Caro статистично значуще знизився, індекс НОМА-IR — підвищився.
Обговорення
Встановлення значення ІР і компенсаторної ГІ у формуванні СПКЯ та його прогресуванні зумовило нову стратегію в лікуванні цієї патології — зниження або усунення ІР. Під впливом метформіну підвищується спорідненість рецепторів до інсуліну і змінюється їх конформація, стимулюються рецепторні і пострецепторні стадії передачі сигналу інсуліну. Метформін посилює активність і процеси фосфорилювання інсулінових рецепторів. Паралельно з цим посилюються ефекти інсуліну на транскрипцію, трансляцію і синтез фосфатидилінозитол-3-кінази, відповідальної за транслокацію переносників глюкози до плазматичної мембрани, що призводить до збільшення поглинання глюкози печінковими, м’язовими і жировими клітинами [11, 12].
Зменшення ІР можна досягти і зменшенням маси тіла у жінок з ожирінням, але це не вирішує проблему ІР у жінок із СПКЯ та нормальним ІМТ. Крім того, зниження тільки ІМТ не призводить у більшості хворих до відновлення функції репродуктивної системи. Тому дослідники розглядають пряму дію метформіну на ліпідний обмін, не пов’язану із впливом на вуглеводний обмін. Можливо, під дією метформіну зменшується активність ключових ферментів синтезу холестерину — гідроксиметил-глутарил-КоА-редуктази і гідроксиметил-глутарил-КоА-синтази. Міжнародні настанови вказують на критерії, згідно з якими при СПКЯ незалежно від інших факторів клініко-анамнестичного ризику і без проведення гормонального аналізу крові ІР може бути встановлена за наявністю принаймні двох з чотирьох ознак: підвищення рівня тригліцеридів, зниження рівня холестерину ЛПВЩ, наявності АГ, гіперглікемії натще або через 2 год після вуглеводного навантаження [3].
Таким чином, жінки з СПКЯ і ІР, центральним ожирінням, дисліпідемією мають найбільший ризик розвитку ЦД і серцево-судинної патології. Це стосується і частки жінок з нормальним ІМТ. Підтримання маси тіла на належному рівні залишається базовою терапією в цих пацієнток.
Отже, застосування метформіну слід розглядати як потенційно ефективний метод для подолання ІР, поліпшення гормональних, біохімічних параметрів і можливого зниження кардіоваскулярного ризику при СПКЯ. Необхідні подальші дослідження з використанням певних діагностичних критеріїв для вивчення етіології СПКЯ, причому слід враховувати весь спектр порушень та їх вплив на здоров’я жінки.
Висновки
1. Застосування метформіну у 26 жінок із СПКЯ та ІР призвело до вірогідного зниження рівня ІРІ натще (з 21,4 ± 2,3 до 6,9 ± 0,8 мкОД/мл; р = 0,005) без впливу на рівні глікемії натще. Показник НОМА-IR знизився з 4,38 ± 1,26 до 1,17 ± 0,18 (р = 0,01), а індекс Caro підвищився з 0,24 ± 0,05 до 0,58 ± 0,14 (р = 0,02).
2. Оцінка показників ліпідного обміну через 6 місяців після початку лікування метформіном підтвердила вірогідне зниження рівня холестерину з 5,4 ± 0,3 до 3,6 ± 0,5 ммоль/л (р = 0,01) і рівня тригліцеридів з 1,7 ± 0,2 до 0,8 ± 0,2 ммоль/л (р = 0,03).
3. Обстеження, проведене у 2018 р. в цих же пацієнток, засвідчило збільшення маси тіла не тільки порівняно з показниками через 6 місяців після лікування метформіном, але й з початковими. Спостерігалося вірогідне підвищення рівня холестерину при обстеженні в 2018 р. до 6,7 ± 0,4 ммоль/л (р = 0,01 порівняно з показником після лікування метформіном).
4. Жінки із СПКЯ та інсулінорезистентністю, центральним ожирінням, дисліпідемією мають найбільший ризик розвитку ЦД і серцево-судинної патології. Застосування метформіну розглядається як потенційно ефективний метод для подолання інсулінорезистентності, поліпшення гормональних, біохімічних параметрів і можливого зниження кардіоваскулярного ризику при СПКЯ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
- Mayer SB, Evans WS, Nestler JE. Polycystic ovary syndrome and insulin: our understanding in the past, present and future. Womens Health (Lond). 2015;11(2):137-49. doi: 10.2217/whe.14.73.
- Glintborg D. Endocrine and metabolic characteristics in polycystic ovary syndrome. Dan Med J. 2016 Apr;63(4). pii: B5232.
- Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E; American Association of Clinical Endocrinologists (AACE); American College of Endocrinology (ACE); Androgen Excess and PCOS Society. American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State clinical review: Guide to the Best Practices in the Evaluation and Treatment of Polycystic Ovary Syndrome - Part 2. Endocr Pract. 2015;21(12):1415-26. doi: 10.4158/EP15748.DSCPT2.
- Mortada R, Williams T. Metabolic Syndrome: Polycystic Ovary Syndrome. FP Essent. 2015;435:30-42.
- Notsu Y, Nabika T, Shibata H, Nagai A, Shiwaku K, Masuda J. HOMA-IR and related clinical parameters. Rinsho Byori. 2007;55(8):737-42.
- Akram T, Hasan S, Imran M, Karim A, Arslan M. Association of polycystic ovary syndrome with cardiovascular risk factors. Gynecol Endocrinol. 2010;26(1):47-53. doi: 10.3109/09513590903159565.
- Iftikhar S, Collazo-Clavell ML, Roger VL, et al. Risk of cardiovascular events in patients with polycystic ovary syndrome. Neth J Med. 2012;70(2):74-80.
- Mathur R, Alexander CJ, Yano J, Trivax B, Azziz R. Use of metformin in polycystic ovary syndrome. Am J Obstet Gynecol. 2008;199(6):596-609. doi: 10.1016/j.ajog.2008.09.010.
- Abdalmageed OS, Farghaly TA, Abdelaleem AA, Abdelmagied AE, Ali MK, Abbas AM. Impact of Metformin on IVF Outcomes in Overweight and Obese Women With Polycystic Ovary Syndrome: A Randomized Double-Blind Controlled Trial. Reprod Sci. 2019 Oct;26(10):1336-1342. doi: 10.1177/1933719118765985.
- Palomba S, Falbo A, Carrillo L, et al. Metformin reduces risk of ovarian hyperstimulation syndrome in patients with polycystic ovary syndrome during gonadotropin-stimulated in vitro fertilization cycles: a randomized, controlled trial. Fertil Steril. 2011 Dec;96(6):1384-1390.e4. doi: 10.1016/j.fertnstert.2011.09.020.
- Palomba S, Falbo A, La Sala GB. Effects of metformin in women with polycystic ovary syndrome treated with gonadotrophins for in vitro fertilisation and intracytoplasmic sperm injection cycles: a systematic review and meta-analysis of randomised controlled trials. BJOG. 2013 Feb;120(3):267-76. doi: 10.1111/1471-0528.12070.
- Practice Committee of the American Society for Reproductive Medicine; Practice Committee of the American Society for Reproductive Medicine. Role of metformin for ovulation induction in infertile patients with polycystic ovary syndrome (PCOS): a guideline. Fertil Steril. 2017 Sep;108(3):426-441. doi: 10.1016/j.fertnstert.2017.06.026.

/630-1.jpg)