Журнал «Медицина неотложных состояний» №8(103), 2019
Вернуться к номеру
Вплив гемофільтрації на загальний стан онкохворих після мультиорганних операцій
Авторы: Красносельський М.В., Крутько Є.М., Храмцов Р.Є.
ДУ «Інститут медичної радіології ім. С.П. Григор’єва НАМН України», м. Харків, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Мета роботи: дослідити вплив гемофільтрації у хворих після мультиорганних оперативних втручань. Матеріали та методи. Вивчались післяопераційні ускладнення у хворих з мультиорганними оперативними втручаннями. Проводились клініко-інструментальні, біохімічні, клінічні, статистичні дослідження; використовувались кардіомонітор Heaco, апарати ультразвукової діагностики й електрокардіографії. Результати. При проведенні в комплексі інтенсивної терапії гемофільтрації та аналізу її впливу на тяжкість стану за шкалами Sequential Organ Failure Assessment і коми Глазго унаслідок гемофільтрації показники тяжкості стану знизились в 1,2 раза. Висновки. Запропонована методика гемофільтрації дозволила знизити число післяопераційних гнійно-септичних ускладнень в основній групі в 1,4 раза і сприяла зменшенню ризику розвитку синдрому поліорганної дисфункції на 33,8 % в основній групі проти групи порівняння.
Цель работы: исследовать влияние гемофильтрации у больных после мультиорганных оперативных вмешательств. Материалы и методы. Изучались послеоперационные осложнения у больных с мультиорганными оперативными вмешательствами. Проводились клинико-инструментальные, биохимические, клинические, статистические исследования; использовались кардиомонитор Heaco, аппараты ультразвуковой диагностики и электрокардиографии. Результаты. При проведении в комплексе интенсивной терапии гемофильтрации и анализе ее влияния на тяжесть состояния по шкалам Sequential Organ Failure Assessment и комы Глазго вследствие гемофильтрации показатели тяжести состояния снизились в 1,2 раза. Выводы. Предложенная методика гемофильтрации позволила снизить число послеоперационных гнойно-септических осложнений в основной группе в 1,4 раза и способствовала уменьшению риска развития синдрома полиорганной дисфункции на 33,8 % в основной группе против группы сравнения.
Background. The purpose was to study the method of hemofiltration in patients after multiple surgical interventions. Materials and methods. The clinical part of the work was done during the clinical and physiological examination and treatment of 39 patients aged 19–75 years (median 52 years) after multiple surgical interventions. The patients were divided into 2 groups. The first (comparison) group included 23 patients with multi-organ interventions, who received common intensive care. The second (main) group included 16 patients with multi-organ surgical interventions, in whom hemofiltration technique was used as a part of comprehensive intensive care. Acute Physiology And Chronic Health Evaluation II (APACHE II), Sequential Organ Failure Assessment (SOFA) and Glasgow Coma Scale were used to determine clinical and laboratory parameters, which are necessary to assess the severity of patient’s state. Results. To evaluate the clinical effectiveness of comprehensive intensive care with hemofiltration, overall clinical, biochemical and immunological parameters were studied, which were probably related to the outcome of underlying disease in the dynamics from day 1 to day 7 of treatment of cancer patients at the department of anesthesiology and intensive care, with assessment of mortality during hospital stay. The effect of continuous hemofiltration on the central nervous system from day 1 to day 7 was evaluated using GCS. In patients of the main group, the initial level of consciousness was 11.5 ± 2.7 points, which clinically corresponded to sopor — stunning. On the second day of the treatment, the level of consciousness was 12.1 ± 2.3 points, from the 3rd to the 7th day, there was a significant (p < 0.05) increase to 14.5 ± 1.5 points, which clinically corresponded to a moderate stunning. In the comparison group of patients, the initial degree of depressed consciousness was probably (p < 0.01) higher — 7.8 ± 2.5 points, which clinically corresponded to a deep sopor — coma I, remaining at this level up to day 3 — 7.5 ± 1.5 points. From the 3rd to the 7th day, against deterioration and progression of the multiple organ dysfunction syndrome (MODS), the level of consciousness significantly (p < 0.05) reduced and was 6.0 ± 1.5 points that clinically corresponded to coma II. The impact of continuous hemofiltration on the severity of MODS during its conduction from the 1st to the 7th day was assessed using the SOFA. In patients of the main group, the severity of the state and the severity of MODS on the SOFA in the first day of continuous hemofiltration was 12.9 ± 3.3 points with a significant (p < 0.05) decrease to day 3 up to 10.3 ± 2.1 point, and to day 7 — up to 7.1 ± 2.3 points. Clinically, it was characterized by stabilization of the state and regression of the manifestations of MODS, primarily stabilization, starting from day 2, of the indicators of central hemodynamics, gas exchange function of the lungs and level of consciousness. In the comparison group, the severity of the condition on the SOFA on the first day of treatment was higher compared to patients who survived — 13.1 ± 2.3 points, but these differences were not significant (p > 0.05). In the dynamics, from the second day of observation, against the background of MODS progression and, first of all, hemodynamic indicators, there was a significant (p < 0.05) deterioration in the severity of the condition up to 16.5 ± 2.0 points, and on the seventh day — up to 19.0 ± 1.0 points. Conclusions. Due to the use of hemofiltration as a part of intensive care and its effect on the severity of the state on the SOFA and GCS, the severity of the disease reduced by 1.2 times. The proposed method of hemofiltration has allowed us to reduce the number of postoperative purulent-septic complications in the main group by 1.4 times and the risk of the multiple organ dysfunction syndrome — by 33.8 % in the main group versus the comparison group.
гемофільтрація; мультиорганні операції; онкохворі
гемофильтрация; мультиорганные операции; онкобольные
hemofiltration; multi-organ operations; cancer patients
Вступ
Дезінтеграція систем гомеостазу в патогенезі післяопераційного періоду супроводжується змінами біохімічних констант, появою неспецифічних сполук у плазмі крові, якісне та кількісне визначення яких становить специфічну патохімічну картину функціональних і структурних змін з боку органів і систем [4].
Розлади метаболізму виражаються, насамперед, у порушенні вуглеводного обміну через різке зниження фосфорилювання глюкози в кишечнику при проявах поліорганної недостатності [5]. В анаеробних умовах глюкоза залишається єдиним джерелом енергії для забезпечення тканинного обміну, а її динаміка є критерієм ступеня інфекційних ускладнень й адекватності проведеного лікування [6, 7].
Реакція організму у відповідь на операційну травму веде до виснаження запасів глікогену, активації перекисного окислення ліпідів (ПОЛ), посиленого ліполізу з утворенням вільних жирних кислот, що підтверджується концепцією цитокінової мережі базисного метаболізму [8–10].
Індикаторами ліпідної пероксидації, що характеризують рівень тканинної гіпоксії, є дієнові кон’югати і малоновий діальдегід, яким приділяється діагностична і прогностична роль в оцінці стану післяопераційного періоду [11, 12]. Істотну роль має вивчення й визначення мієлопероксидази нейтрофілів людини, механізмів взаємозв’язку між гемостазом і ПОЛ [12, 13].
З появою сучасних ліків та медичних технологій постає дуже актуальна проблема щодо безпеки матеріалів, які плануються для використання в галузях медицини та фармакології. Це стосується також і засобів перед- та оперативного втручання. Вивчення впливу агентів, які застосовують в анестезіології, на генетичний апарат соматичних клітин людини дозволить скласти більш повну картину змін в організмі онкологічних пацієнтів при операціях великого обсягу порівняно з оперативними втручаннями малого обсягу. Це обумовлює необхідність досліджень в даній галузі. У лікуванні онкохворих практично немає даних про використання гемофільтрації.
Контроль за інтенсивною терапією (ІТ) повинен проводитися з використанням багатофункціональних моніторів [15]. Деякі автори [3, 16] пропонують програми ІТ синдрому поліорганної дисфункції (СПОД) будь-якої етіології. Вони включають корекцію кислотно-основного стану, застосування антигіпоксантів і антиоксидантів, протекторів клітинних мембран, дезінтоксикаційну терапію, ліквідацію порушень мікроциркуляції та ін. Застосування цих програм значно поліпшує результати лікування [8, 14].
Отже, в інтенсивній терапії післяопераційних ускладнень онкохворих можна виділити низку важливих напрямків. Спочатку слід усунути фактори ендотоксемії. Потім необхідно підтримати кисневий баланс, системну гемодинаміку. При цьому виправданим є застосування антигіпоксантів і засобів, що зв’язують вільні радикали [4].
Надалі важливим напрямком інтенсивної терапії СПОД є заміщення або підтримка неспроможної функції органів і систем [1]. Підтримка або штучне заміщення функцій у міру їх відновлення знижується та припиняється. Ключовими ланками лікування постраждалих у цей період є знеболювання й забезпечення достатньою енергією. Щоб уникнути низки ускладнень, ІТ повинна бути випереджальною [2, 3].
Все вищевикладене визначає основні напрямки наших досліджень з питань удосконалювання нинішніх і пошуку нових способів профілактики та інтенсивної терапії на основі сучасних технологій з упровадженням їх у клінічну практику.
Мета дослідження: вивчити вплив гемофільтрації у хворих після мультиорганних оперативних втручань.
Матеріали та методи
Використовувалися клініко-інструментальні, біохімічні, клінічні, статистичні методи; кардіомонітор Heaco, апарат ультразвукової діагностики, апарат електрокардіографії. Клінічна частина роботи виконана під час клініко-фізіологічного обстеження та лікування 39 хворих після мультиорганних оперативних втручань віком від 19 до 75 років (медіана — 52 роки).
Хворі були розподілені на дві групи: група порівняння (n = 23) — хворі з оперативним мультиорганним втручанням, яким проводилась загальноприйнята інтенсивна терапія; та основна група (n = 16) — хворі з мультиорганними оперативними втручаннями, у яких в комплексній інтенсивній терапії було використано методику гемофільтрації.
Визначення клінічних і лабораторних параметрів, необхідних для оцінки тяжкості стану, проводилось за шкалами Acute Physiology And Chronic Health Evaluation II (APACHE ІІ), Sequential Organ Failure Assessment (SOFA) та коми Глазго.
Результати та обговорення
Для оцінки клінічної ефективності комплексної інтенсивної терапії із застосуванням гемофільтрації було проведене дослідження загальних клінічних, клініко-біохімічних та імунологічних показників, вірогідно пов’язаних з результатом основного захворювання в динаміці з 1-ї по 7-му добу лікування онкохворих у відділенні анестезіології та інтенсивної терапії, з оцінкою летальності за період перебування.
Оцінку впливу продовженої гемофільтрації на стан центральної нервової системи з 1-ї по 7-му добу проводили з використанням шкали коми Глазго (рис. 1).
У хворих основної групи вихідний рівень свідомості становив 11,5 ± 2,7 бала, що клінічно відповідало сопору — оглушенню. На другу добу лікування рівень свідомості дорівнював 12,1 ± 2,3 бала, з 3-ї по 7-му добу відбувалося вірогідне (р < 0,05) збільшення до 14,5 ± 1,5 бала, що клінічно відповідало помірному оглушенню.
У групі порівняння хворих вихідний ступінь пригнічення свідомості був вірогідно (р < 0,01) вище і становив 7,8 ± 2,5 бала, що клінічно відповідало глибокому сопору — комі I, залишаючись на цьому рівні до 3-ї доби — 7,5 ± 1,5 бала. Із 3-ї по 7-му добу на тлі погіршення стану і прогресування СПОД рівень свідомості вірогідно (р < 0,05) знижувався і становив 6,0 ± 1,5 бала, що клінічно відповідало комі II.
Отже, у хворих основної групи на тлі проведення продовженої гемофільтрації прослідковується виражена позитивна динаміка відновлення рівня свідомості; у свою чергу, у хворих групи порівняння відзначено вірогідно (р < 0,05) більш виражене пригнічення ступеня свідомості до рівня глибокого сопору — коми за весь період спостереження.
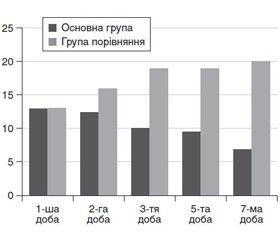
Оцінку впливу продовженої гемофільтрації на вираженість СПОД при її проведенні з 1-ї по 7-му добу провели з використанням шкали SOFA (рис. 2).
У хворих основної групи тяжкість стану і вираженість СПОД за шкалою SOFA у першу добу проведення постійної гемофільтрації становила 12,9 ± 3,3 бала з вірогідним (р < 0,05) зниженням до 3-ї доби до 10,3 ± 2,1 бала, а до 7-ї доби — до 7,1 ± 2,3 бала. Клінічно це характеризувалося стабілізацією стану і регресом проявів СПОД, у першу чергу стабілізацією, починаючи з 2-ї доби, показників центральної гемодинаміки, газообмінної функції легенів і рівня свідомості.
У хворих групи порівняння тяжкість стану за шкалою SOFA у першу добу лікування була вище порівняно з пацієнтами, які вижили, — 13,1 ± 2,3 бала, але ці відмінності не були вірогідними (р > 0,05). У динаміці вже з другої доби спостереження на тлі прогресування СПОД і в першу чергу показників гемодинаміки відзначено вірогідне (р < 0,05) погіршення тяжкості стану до 16,5 ± 2,0 бала, а на 7-му добу — до 19,0 ± 1,0 бала. Під час аналізу взаємозв’язку тяжкості стану та вираженості СПОД за шкалою SOFA вірогідні відмінності відзначаються із 2-ї доби спостереження, становлячи в онкохворих обстежуваних груп 12,7 ± 1,5 і 16,5 ± 2,0 бала відповідно (р < 0,001). У хворих основної групи тяжкість стану і вираженість СПОД за шкалою SOFA у першу добу проведення постійної гемофільтрації становила 12,9 ± 3,3 бала з вірогідним (р < 0,05) зниженням на 3-тю добу до 10,3 ± 2,1 бала, а на 7-му добу до 7,1 ± 2,3 бала. Клінічно це характеризувалося стабілізацією стану і регресом проявів СПОД, у першу чергу стабілізацією, починаючи з другої доби, показників центральної гемодинаміки, газообмінної функції легенів і рівня свідомості.
У хворих групи порівняння тяжкість стану за шкалою SOFA у першу добу лікування була вище порівняно з пацієнтами, які вижили, — 13,1 ± 2,3 бала, але ці відмінності не були вірогідними (р > 0,05). У динаміці вже з другої доби спостереження на тлі прогресування СПОД і у першу чергу показників гемодинаміки відзначено вірогідне (р < 0,05) погіршення тяжкості стану до 16,5 ± 2,0 бала, а на 7-му добу — до 19,0 ± 1,0 бала.
Висновки
Запропонована методика гемофільтрації дозволила знизити число післяопераційних гнійно-септичних ускладнень в основній групі в 1,4 раза і сприяла зменшенню ризику розвитку СПОД на 33,8 % в основній групі проти групи порівняння.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Жетинкаримова А.Д., Стикаеева Р.К., Каюпова Б.А. и др. Биологически активные медиаторы фетальных органопрепаратов в стресспротекции послеоперационной печеночной недостаточности. Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2007. Т. 17. № 1 (прил. 29). С. 4.
2. Баркаган З.С. Современные аспекты патогенеза, диагностики и терапии ДВС синдрома. Вестник гематологии. 2005. Т. 1. № 2. С. 5-14.
3. Биленко М.В. Ишемические и реперфузионные повреждения органов. М.: Медицина, 1989. 368 с.
4. Воробьев П.А. Возрастные аспекты интоксикации и экстракорпоральное воздействие на кровь. Клиническая геронтология. 2007. № 1. С. 9-15.
5. Миронов П.И., Мардганиева Э.А., Марданов А.З., Гумеров А.А. Выбор оптимальной шкалы оценки тяжести состояния при сепсисе у детей. Анестезиология и реаниматология. 2001. № 1. С. 51-53.
6. Горн М.М. Водноэлектролитный и кислотно-основной баланс: краткое руководство. СПб., 2000. 319 с.
7. Ситкин С.И., Савельева Ю.В., Другова И.Н. и др. Влияние анальгезии на течение раннего послеоперационного периода в реконструктивной хирургии брюшной аорты. Регионарная анестезия и лечение острой боли. 2007. Т. 1. № 1. С. 15-18.
8. Галкин Д.В. Современная антибактериальная профилактика в абдоминальной хирургии. Consilium Medicum. 2005. № 2. С. 7-13.
9. Пермяков П.Е., Жидовинов А.А., Зурнаджьянц В.А. и др. Патогенетические аспекты синдрома ишемии-реперфузии в прогрессировании системного воспаления и эндотоксикоза при кишечной непроходимости. Вестник Волгоградского гос. мед. ун-та. 2010. № 1(33). С. 111-114.
10. Шумаков И.В., Ким В.Г., Краснов С.В. и др. Клинический опыт проведения симультанных операций у больных с сердечно-сосудистой патологией и злокачественными новообразованиями других органов [Электронный ресурс]. Вестник КазНМУ. 2013. № 3. Режим доступа: http://kaznmu.kz/press/2013/03/13. (назва з екрана).
11. Грицук С.Ф., Безруков В.М. Синдром аминокислотного дисбаланса и метаболическая дисфункция при критических состояниях в хирургии. Вестник интенсивной тepaпии. 2004. № 2. С. 10-13.
12. Губайдуллин P.P. Нарушения в системе транспорта кислорода и пути их коррекции у больных с внутрибрюшной гипертензией: автореф. дис. на соискание науч. степени д-ра мед. наук: 14.00.37. М., 2005. 48 с.
13. Бабков О.В., Луфт В.М., Беляев А.М. и др. Ранняя энтеральная терапия и нутриционная поддержка больных с опухолевой кишечной непроходимостью. Вестник Российской военно-медицинской академии. 2010. № 3. С. 165-169.
14. Луфт В.М. Нутриционная поддержка больных при критических состояниях как базисный метод коррекции метаболических нарушений. Вестник интенсивной терапии. 2002. № 3. С. 28-32.
15. Любошевский П.А. Возможности оценки коррекции хирургического стресс-ответа при операциях высокой травматичности. Регионарная анестезия и лечение острой боли. 2014. Т. 8. № 4. С. 5-21.
16. Nelson D.P., Samsel R.W., Wood L.D., Schumacker P. Pathological supply dependence of systemic and intestinal O2 uptake during endotoxemia. J. Appl. Physiol. 2008. Vol. 64. P. 2410-2419.

/92-1.jpg)