Журнал «Здоровье ребенка» Том 15, №1, 2020
Вернуться к номеру
Час початку лікувальної гіпотермії та перебіг гіпоксично-ішемічної енцефалопатії у доношених новонароджених
Авторы: Соколова К.Ю.
Державний заклад «Дніпропетровська медична академія Міністерства охорони здоров’я України»,
м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
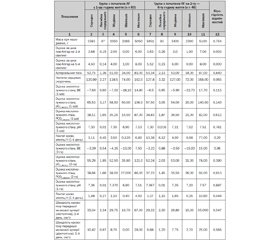
Актуальність. Сучасний стандарт проведення лікувальної гіпотермії у доношених новонароджених дітей з гіпоксично-ішемічною енцефалопатією вимагає початку гіпотермії протягом перших шести годин життя. Невирішеним залишається питання щодо можливих переваг раннього початку гіпотермії (у віці першої години життя) з урахуванням різних моделей проведення процедури. Метою нашої роботи було дослідження зв’язків між часом початку фази пасивного охолодження лікувальної гіпотермії та короткостроковими наслідками гіпоксично-ішемічної енцефалопатії. Матеріали та методи. Аналіз проявів гіпоксично-ішемічної енцефалопатії проводився залежно від часу початку гіпотермії: в першу годину життя чи протягом перших 2–6 годин життя. Результати. У дослідження були включені 129 доношених новонароджених з асфіксією при народженні, яким проводилась лікувальна гіпотермія (модель системної гіпотермії з використанням простих засобів охолодження). Серед немовлят із раннім початком охолодження в 27,7 % (23/83) випадків перебіг гіпоксично-ішемічної енцефалопатії був несприятливим. Серед новонароджених із більш пізнім початком гіпотермії 36,1 % (13/46) дітей мали несприятливий перебіг гіпоксично-ішемічної енцефалопатії. Не встановлено вірогідних відмінностей між групами з різним часом початку пасивного охолодження щодо частоти реєстрації деструктивних гіпоксично-ішемічних уражень мозку та летальних випадків унаслідок розвитку постішемічного набряку мозку і поліорганної недостатності (p = 0,551). Між групами спостереження були виявлені вірогідні відмінності щодо значень центральної температури на момент госпіталізації у відділення інтенсивної терапії (33,17 ± 0,11 °С проти 33,85 ± 0,18 °C), віку досягнення цільової температури (4,64 ± 0,65 години проти 7,52 ± 1,35 години), тривалості госпіталізації в неонатальному стаціонарі (27,3 ± 1,4 дня проти 33,8 ± 2,7 дня, р = 0,020). Висновки. Не виявлено вірогідних відмінностей щодо короткострокових наслідків гіпоксично-ішемічного ураження залежно від часу початку пасивного охолодження в межах перших 6 годин життя. Але немовлята, які підлягали пасивному охолодженню протягом першої години життя, мали більш низькі значення центральної температури на момент госпіталізації у відділення інтенсивної терапії та швидше досягали цільової температури лікувальної гіпотермії.
Актуальность. Современный стандарт проведения лечебной гипотермии у доношенных новорожденных детей с гипоксически-ишемической энцефалопатией требует начала гипотермии в течение первых шести часов жизни. Нерешенным остается вопрос о возможных преимуществах раннего начала гипотермии (в возрасте первого часа жизни) с учетом различных моделей проведения процедуры. Целью нашей работы было исследование связей между временем начала фазы пассивного охлаждения лечебной гипотермии и краткосрочными последствиями гипоксически-ишемической энцефалопатии. Материалы и методы. Анализ проявлений гипоксически-ишемической энцефалопатии проводился в зависимости от времени начала гипотермии: в первый час жизни или в течение первых 2–6 часов жизни. Результаты. В исследование включены 129 доношенных новорожденных с асфиксией при рождении, которым проводилась лечебная гипотермия (модель системной гипотермии с использованием простых средств охлаждения). Среди младенцев с ранним началом охлаждения в 27,7 % (23/83) случаях течение гипоксически-ишемической энцефалопатии было неблагоприятным. Среди новорожденных с более поздним началом гипотермии 36,1 % (13/46) детей имели неблагоприятное течение гипоксически-ишемической энцефалопатии. Не установлены достоверные различия между группами с разным временем начала пассивного охлаждения относительно частоты регистрации деструктивных гипоксически-ишемических поражений мозга и летальных случаев вследствие развития постишемического отека мозга и полиорганной недостаточности (p = 0,551). Между группами наблюдения выявлены достоверные различия центральной температуры на момент госпитализации в отделение интенсивной терапии (33,17 ± 0,11 °С против 33,85 ± 0,18 °C), возраста достижения целевой температуры (4,64 ± 0,65 часа против 7,52 ± 1,35 часа), продолжительности госпитализации в неонатальном стационаре (27,3 ± 1,4 дня против 33,8 ± 2,7 дня, р = 0,020). Выводы. Не выявлены достоверные отличия краткосрочных последствий гипоксически-ишемического поражения в зависимости от времени начала пассивного охлаждения в пределах первых 6 часов жизни. Однако младенцы, подлежащие пассивному охлаждению в течение первого часа жизни, имели более низкие значения центральной температуры на момент госпитализации и быстрее достигали целевой температуры охлаждения.
Background. The current algorithm for therapeutic hypothermia in full-term infants with hypoxic-ischemic encephalopathy requires the initiation of hypothermia within the first six hours of life. But the question remains unsolved about the possible benefits of early initiation of hypothermia (within the first hour of life), taking into account the different models of the procedure. The aim of our work was to investigate the relationship between the time of initiation of the phase of passive cooling of therapeutic hypothermia and the short-term effects of hypoxic-ischemic encephalopathy. Materials and methods. Analysis of manifestations of hypoxic-ischemic encephalopathy was performed depending on the time of hypothermia initiation: in the first hour of life or during the first 2–6 hours of life. Results. The study included 129 full-term infants with asphyxia at birth, who underwent therapeutic hypothermia (a model of systemic hypothermia using simple means of cooling). Among infants with an early initiation of cooling, the course of hypoxic-ischemic encephalopathy was unfavourable in 27.7 % (23/83) of cases. Among newborns with later initiation of hypothermia, 36.1 % (13/46) of children had an adverse course of hypoxic-ischemic encephalopathy. No significant changes were found between the groups with different time of initiation of passive cooling in terms of the frequency of destructive hypoxic-ischemic brain lesions and fatal cases due to the development of post-ischemic brain edema and multiple organ failure (p = 0.551). Significant differences were observed between the groups in terms of the core body temperature at the time of hospitalization in the neonatal hospital (33.17 ± 0.11 °C vs. 33.85 ± 0.18 °C), the age at reaching the target temperature (4.64 ± 0.65 hours vs. 7.52 ± 1.35 hours), duration of hospitalization in neonatal department (27.3 ± 1.4 days vs. 33.8 ± 2.7 days, p = 0.020). Conclusions. No significant differences were found in the short-term effects of hypoxic-ischemic lesions depending on the initiation of passive cooling within the first 6 hours of life. However, infants, who were passively cooled during the first hour of life, had lower core body temperatures at the time of hospitalization and reached the target cooling temperature faster.
новонароджені; гіпоксично-ішемічна енцефалопатія; лікувальна гіпотермія
новорожденные; гипоксически-ишемическая энцефалопатия; лечебная гипотермия
newborns; hypoxic-ischemic encephalopathy; therapeutic hypothermia
Вступ
Матеріали та методи
Результати
Висновки
1. Lee A.C. et al. Intrapartum-related neonatal encephalopathy incidence and impairment at regional and global levels for 2010 with trends from 1990. Pediatr. Res. 2013. Vol. 74(1). P. 50-72.
2. Lawn J.E et al. Every Newborn: progress, priorities, and potential beyond survival/Lancet Every Newborn Study Group. Lancet. 2014. Vol. 12. № 384(9938). P. 189-205.
3. Jacobs S.E. et al. Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database Syst. Rev. 2013. Vol. 1. CD003311.
4. Enweronu-Laryea C. et al. Core temperature after birth in babies with neonatal encephalopathy in a sub-Saharan African hospital setting. J. Physiol. 2019. Vol. 597(15). P. 4013-4024.
5. El-Dib M.et al. Should therapeutic hypothermia be offered to babies with mild neonatal encephalopathy in the first 6 h after birth? Pediatr. Res. 2019. Vol. 85. P. 442-448.
6. Chiang M.C., Jong Y.J., Lin C.H. Therapeutic hypothermia for neonates with hypoxic ischemic encephalopathy. Pediatr. Neonatol. 2017. Vol. 58(6). P. 475-483.
7. Mietzsch U. et al. Active cooling temperature required to achieve therapeutic hypothermia correlates with short-term outcome in neonatal hypoxic-ischaemic encephalopathy. J. Physiol. 2020. Vol. 598(2). P. 415-424.
8. Shankaran S. et al. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N. Engl. J. Med. 2005. Vol. 353. P. 1574-1584.
9. Gluckman P.D. et al. Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicentre randomised trial. Lancet. 2005. Vol. 365. P. 663-670.
10. Azzopardi D.V. et al. Moderate hypothermia to treat perinatal asphyxial encephalopathy/TOBY Study Group. N. Engl. J. Med. 2009. Vol. 361. P. 1349-1358.
11. Simbruner G., Mittal R.A., Rohlmann F., Muche R., neo.nEURO.network. Trial Participants. Systemic hypothermia after neonatal encepha–lopathy: outcomes of neo.nEURO.network RCT. Pediatrics. 2010. Vol. 126. P. 771-778.
12. Jacobs S.E. et al. Wholebody hypothermia for term and near-term newborns with hypoxic-ischemic encephalopathy: a randomized controlled trial. Arch. Pediatr. Adolesc. Med. 2011. Vol. 165. P. 692-700.
13. Lemyre B., Chau V., Canadian Paediatric Society. Hypothermia for newborns with hypoxic-ischemic encephalopathy. Paediatr. Child. Health. 2018. Vol. 23(4). P. 285-291.
14. Guillot M. et al. Influence of timing of initiation of therapeutic hypothermia on brain MRI and neurodevelopment at 18 months in infants with HIE: a retrospective cohort study. BMJ Paediatr. Open. 2019. Vol. 21. № 3(1). P. 000442.
15. Roelfsema V. et al. Window of opportunity of cerebral hypothermia for postischemic white matterin juryin the near-term fetal sheep. J. Cereb. Blood. Flow. Metab. 2004. Vol. 24. P. 877-886.
16. Sabir H. et al. Immediate hypothermia is not neuroprotective after severe hypoxia-ischemia and is deleterious when delayed by 12 hoursin neonatal rats. Stroke. 2012. Vol. 43. P. 3364-3370.
17. Lemyre B. et al. Initiation of passive cooling at referring centre is most predictive of achieving early therapeutic hypothermia in asphyxiated newborns. Paediatr. Child. Health. 2017. Vol. 22(5). P. 264-268.
18. Thoresen M. et al. Time is brain: starting therapeutic hypothermia within three hours after birth improves motor outcome in asphyxiated newborns. Neonatology. 2013. Vol. 104(3). P. 228-233.
19. Enweronu-Laryea C. et al. Core temperature after birth in babies with neonatal encephalopathy in a sub-Saharan African hospital setting. J. Physiol. 2019. Vol. 597(15). P. 4013-4024.
20. Shellhaas R. A. et al. Guideline on Continuous Electroencephalography Monitoring in Neonates’. ’The American Clinical Neurophysiology Society’s. J. Clin. Neurophysiol. 2011. Vol. 28. P. 611-617.
21. Сурков Д.М., Мохульська О.М. Контроль температури тіла під час проведення лікувальної гіпотермії у новонароджених з гіпоксично-ішемічною енцефалопатією. Актуальні питання педіатрії, акушерства та гінекології. 2019. № 1. Р. 26-32.
22. Лапоног С.П. Особливості перебігу змін температур у новонароджених з тяжкою асфіксією під час сеансу краніоцеребральної гіпотермії. Медичні перспективи. 2011. Т. XVI. № 2. С. 35-42.

/76.jpg)
/77.jpg)