Журнал «Травма» Том 21, №1, 2020
Вернуться к номеру
Дослідження напружено-деформованого стану в системі «імплантат — кістка» на моделі алокомпозитного ендопротеза проксимального відділу стегнової кістки
Авторы: Вирва О.Є., Головіна Я.О., Карпінський М.Ю., Яресько О.В., Малик Р.В.
ДУ «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка НАМН України», м. Харків, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Актуальність. Відновлення масивних післярезекційних дефектів довгих кісток — одне з основних завдань, що постає перед хірургом у разі лікування хворих з пухлинними ураженнями кісток. Тому розробка оптимальних імплантатів для заміщення дефектів кісток та суглобів триває вже багато десятиліть. Для підбору ідеального імплантату, який повинен відповідати вимогам біосумісності, механічної стабільності та бути безпечним, потрібно проводити безліч різних досліджень і тестів. Саме метод алокомпозитного ендопротезування становить інтерес для поглибленого проведення досліджень. Мета: обґрунтувати методику алокомпозитного ендопротезування на основі математичного моделювання методом кінцевих елементів. Матеріали та методи. Проведено вивчення методом кінцевих елементів математичної моделі стегнової кістки з пухлинним ендопротезом. Вивчали напружено-деформований стан моделі при виконанні резекції стегнової кістки прямим розтином та розтином у вигляді сходинки. Була змодельована ситуація у різні терміни після оперативного втручання — через 3 та 6 місяців. Для кожного типу резекції моделювали цементний та безцементний варіанти фіксування ніжки ендопротеза. Результати. При поперечній остеотомії та безцементному способі фіксації ніжки максимальні за величиною напруження (92,3 МПа) виникають в зоні остеотомії. У діафізарній частині стегнової кістки зона максимальних напружень розташовується по медіальному боку, де вони набувають значень 10,5 та 10,1 МПа в дистальній та проксимальній частинах відповідно. Використання ступінчастої остеотомії в поєднанні з безцементною фіксацією ніжки ендопротеза в найближчий післяопераційний період дозволяє знизити рівень напружень в зоні остеотомії до 59,1 МПа. В процесі набуття міцності кісткового регенерату після використання поперечної остеотомії в поєднанні з безцементною фіксацією ніжки спостерігається зниження рівня напружень в зоні остеотомії — 75,6 МПа. У діафізарній частині стегнової кістки вони визначаються в межах від 9,5 до 10,0 МПа. При використанні ступінчастої остеотомії та безцементного кріплення ніжки ендопротеза діапазон напружень в діафізарній частині стегнової кістки визначається від 7,9 до 13,8 МПа. Використання цементу в поєднанні з поперечною остеотомією в післяопераційний період 3 місяці не веде до принципових змін у напружено-деформованому стані моделі. Максимальна величина напружень (77,1 МПа) визначається в зоні остеотомії. При використанні ступінчастої остеотомії наявність цементного прошарку між ніжкою ендопротеза та стінкою кістково-мозкового каналу дозволяє знизити рівень напружень в зоні остеотомії до позначки 31,5 МПа. Висновки. У результаті проведеного математичного моделювання було виявлено, що виконання ступінчастої остеотомії стегнової кістки дозволяє вдвічі знизити рівень механічних напружень в зоні остеотомії порівняно з моделями із поперечною остеотомією. Використання кісткового цементу для фіксації ніжки ендопротеза у теоретичній моделі також дає можливість значно знизити рівень напружень в усіх варіантах досліджених моделей через утворення демпферного прошарку між металом та кістковою тканиною. Набуття міцності кісткового регенерату з часом веде до вирівнювання величин напружень як між контрольними точками кожної з моделей, так і між моделями з різними видами остеотомії стегнової кістки.
Актуальность. Восстановление массивных послерезекционных дефектов длинных костей — одна из основных задач, которая стоит перед хирургом при лечении больных с опухолевыми поражениями костей. Поэтому разработка оптимальных имплантатов для замещения дефектов костей и суставов продолжается уже многие десятилетия. Для подбора идеального имплантата, который должен соответствовать требованиям биосовместимости, механической стабильности и быть безопасным, нужно проводить множество различных исследований и тестов. Именно метод алокомпозитного эндопротезирования представляет интерес для углубленного проведения исследований. Цель: обосновать методику алокомпозитного эндопротезирования на основании математического моделирования методом конечных элементов. Материалы и методы. Проведено изучение методом конечных элементов математической модели бедренной кости с «опухолевым» эндопротезом. Изучено напряженно-деформированное состояние модели при выполнении резекции бедренной кости прямым сечением и сечением в виде ступеньки. Смоделирована ситуация в разные сроки после оперативного вмешательства — через 3 и 6 месяцев. Для каждого типа резекции моделировали цементный и бесцементный варианты фиксирования ножки эндопротеза. Результаты. При поперечной остеотомии и бесцементном способе фиксации ножки максимальные по величине напряжения (92,3 МПа) возникают в зоне остеотомии. В диафизарной части бедренной кости зона максимальных напряжений располагается по медиальной стороне, они принимают значения 10,5 и 10,1 МПа в дистальной и проксимальной частях соответственно. Использование ступенчатой остеотомии в сочетании с бесцементной фиксацией ножки эндопротеза в ближайший послеоперационный период позволяет снизить уровень напряжений в зоне остеотомии до 59,1 МПа. В процессе увеличения прочности костного регенерата после использования поперечной остеотомии в сочетании с бесцементной фиксацией ножки наблюдается снижение уровня напряжений в зоне остеотомии — 75,6 МПа. В диафизарной части бедренной кости они определяются в пределах от 9,5 до 10,0 МПа. При использовании ступенчатой остеотомии и бесцементного крепления ножки эндопротеза диапазон напряжений в диафизарной части бедренной кости определяется от 7,9 до 13,8 МПа. Использование цемента в сочетании с поперечной остеотомией в послеоперационный период 3 месяца не ведет к принципиальным изменениям в напряженно-деформированном состоянии модели. Максимальная величина напряжений (77,1 МПа) определяется в зоне остеотомии. При использовании ступенчатой остеотомии наличие цементного слоя между ножкой эндопротеза и стенкой костно-мозгового канала позволяет снизить уровень напряжений в зоне остеотомии до отметки 31,5 МПа. Выводы. В результате проведенного математического моделирования обнаружено, что выполнение ступенчатой остеотомии бедренной кости позволяет вдвое снизить уровень механических напряжений в зоне остеотомии по сравнению с моделями с поперечной остеотомией. Использование костного цемента для фиксации ножки эндопротеза в теоретической модели также позволяет значительно снизить уровень напряжений во всех вариантах исследованных моделей за счет образования демпферного слоя между металлом и костной тканью. Увеличение прочности костного регенерата со временем приводит к выравниванию величин напряжений как между контрольными точками каждой из моделей, так и между моделями с различными видами остеотомии бедренной кости.
Background. The restoration of massive post-resection defects of long bones is one of the main challenges facing surgeons in the treatment of patients with bone tumors. Therefore, the deve-lopment of optimal implants to replace defects of bones and joints has been going on for many decades. To select the “ideal” implant, which must meet the requirements of biocompatibility, mechanical stability and be safe, you need to conduct many different studies and tests. It is the allocomposite endoprosthetic replacement method that is of interest for in-depth researches. The purpose was to substantiate the technique of allocomposite endoprosthetic replacement based on mathematical modeling by the finite element method. Materials and methods. The finite element method was used to study a mathematical model of the femur with a “tumor” endoprosthesis. We studied the stress-strain state of the model when performing a femoral resection with a direct section and a section in the form of a step. The situation was simulated at different times after surgery, in 3 and 6 months. For each type of resection, cement and cementless versions of fixing the endoprosthesis stem were modeled. Results. With transverse osteotomy and a cementless method of fixing the stem, the maximum stresses (92.3 MPa) arise in the osteotomy zone. In the diaphyseal femur, the zone of maximum stresses is located on the medial side, they are 10.5 and 10.1 MPa in the distal and proximal parts, respectively. The use of stepwise osteotomy in combination with cementless fixation of the endoprosthesis stem in the immediate postoperative period reduces the level of stress in the osteotomy zone to 59.1 MPa. In the process of increasing the strength of the bone regenerate after using transverse osteotomy in combination with cementless fixation of the stem, a decrease in stress level in the osteotomy zone is observed — 75.6 MPa. In the diaphyseal part of the femur, stresses range from 9.5 to 10.0 MPa. When using stepwise osteotomy and cementless fixation of the endoprosthesis stem, the stress range in the diaphyseal part of the femur is from 7.9 to 13.8 MPa. The use of cement in combination with transverse osteotomy in the postoperative period of 3 months does not lead to fundamental changes in the stress-strain state of the model. The maximum stress value (77.1 MPa) is determined in the osteotomy zone. When using stepwise osteotomy, the presence of a cement layer between the stem of the endoprosthesis and the wall of the bone marrow canal reduces the level of stress in the osteotomy zone to 31.5 MPa. Conclusions. As a result of mathematical modeling, it was found that stepwise osteotomy of the femur allows reducing the level of mechanical stresses in the osteotomy zone compared to models with transverse osteotomy. The use of bone cement for fixing the endoprosthesis stem in a theoretical model also allows one to significantly reduce the level of stresses in all variants of the studied models, due to the formation of a damper layer between the metal and bone tissue. An increase in the strength of the bone regenerate over time leads to equalization of stress values, both between the control points of each model and between models with different types of femoral osteotomy. Thus, as a result of the study, a mathematically sound technique of allocomposite endoprosthetic replacement was deve-loped, which we improved. The best results were obtained with the use of stepwise osteotomy and fixation of allobone with the recipient’s bone according to the type of “Russian castle” and intramedullary fixation of the entire system.
кісткова пухлина; ендопротезування; імплантат
костная опухоль; эндопротезирование; имплантат
bone tumor; endoprosthetic replacement; implant
Вступ
Відновлення масивних післярезекційних дефектів довгих кісток — одне з основних завдань, що постає перед хірургом у разі лікування хворих з пухлинними ураженнями кісток.
На сьогодні в арсеналі ортопедів є безліч технік для реконструкції великих дефектів кісток та суглобів. Серед них можна визначити основні, такі як кісткова пластика, метод дистракційного остеогенезу, заміщення дефектів біоматеріалами (демінералізований кістковий матрикс та керамічні імплантати), ендопротезування. Серед методів кісткової пластики можна виділити автопластику (з використанням губчастих, кортикальних і автоклавованих автотрансплантатів), алопластику та ксенопластику [1, 2].
Проте нині все більшої популярності набувають комбіновані методи заміщення великих сегментарних дефектів кісток та суглобів. Серед них можна виділити метод дистракційного остеогенезу в комбінації з кістковою автопластикою, а також алокомпозитне ендопротезування (метод, що об’єднує ендопротезування та кісткову алопластику сегментарними імплантатами). Саме комбінація різних методик дозволяє звести до мінімуму недоліки обох методів та використати необхідні їх переваги [2].
Розробка оптимальних імплантатів для заміщення дефектів кісток та суглобів триває вже багато десятиліть. Для підбору ідеального імплантату, який повинен відповідати вимогам біосумісності, механічної стабільності та бути безпечним, потрібно проводити безліч різних досліджень та тестів [3–5]. Саме метод алокомпозитного ендопротезування становить інтерес для поглибленого проведення досліджень.
Основними та найчастішими ускладненнями при використанні кісткової алопластики сегментарними імплантатами є інфекційні, відсутність зрощення алоімплантату та кістки-реципієнта, а також нестабільність металоконструкцій, якими фіксуються алоімплантати. Згідно з роботами різних учених, частота інфекційних ускладнень після алотрансплантації становить від 4 до 30 %, що спричинює підвищення частоти ампутацій до 50 % [1, 6, 18].
Частота виникнення несправжніх суглобів після імплантації масивних алотрансплантатів становить від 8 до 14 %. Доведено, що на цей процес впливають післяопераційна паліативна хіміотерапія (ПХТ) або променева терапія (ПТ) чи стан закриття трансплантата м’якими тканинами та будь-які інші імунологічні проблеми. Важливим для прогнозування розвитку несправжнього суглоба є тип з’єднання між донорською кісткою та кісткою реципієнта. R. Capanna визначив три основні типи з’єднання як базові: кірково-кірковий, кірково-губчастий та губчасто-губчастий. Він встановив 50 % кірково-кіркових зрощень, 91 % — кірково-губчастих та усіх губчасто-губчастих з’єднань за умов післяопераційної ПХТ. Відомо, що у разі щільного контакту між порівнюваними фрагментами в кірковому шарі діафіза кістки частота зрощень зростає. Якщо розмір щілини перевищує 1 мм, то частота зрощення значно зменшується. Клінічні дослідження показали, що для кращого зрощення потрібно застосовувати ригідну фіксацію. Також для стабілізації використовують накісткові пластини та інтрамедулярні фіксатори. Але частота переломів алотрансплантатів зростає після фіксації пластиною. З іншого боку, інтрамедулярна фіксація, навіть із проксимальним та дистальним замками, може не забезпечити адекватних умов для зрощення. Інтрамедулярний стрижень із замком є недостатньо ефективним для зрощення з’єднання в діафізі довгої кістки. Несправжні суглоби виникли у всіх 12 випадках такої фіксації [7–10].
Отже, з метою покращення результатів хірургічного лікування онкологічних хворих у разі застосування алокомпозитного ендопротезування нами була удосконалена ця методика та проведене її математичне обґрунтування.
Мета роботи: обґрунтувати методику алокомпозитного ендопротезування на основі математичного моделювання методом кінцевих елементів.
Матеріали та методи
З метою покращення результатів хірургічного лікування хворих із кістковими пухлинами нами була удосконалена методика заміщення післярезекційного дефекту довгих кісток. Як замісний матеріал використовувалися сегментарні кісткові алоімплантати — артикулюючі або без збереження метаепіфізарної зони (діафізарні). Кісткові алоімплантати були виготовлені у відділі трансплантології ДУ «ІПХС ім. проф. М.І. Ситенка НАМНУ» (сертифікат відповідності № UA.TR 101-21-2016).
Методика включає два етапи: на першому етапі оперативного втручання виконується радикальне абластичне видалення пухлини довгої кістки (сегментарна резекція) en block. У зоні опилу кістки проводиться ступінчаста остеотомія (step-cut). Один кінець сегментарного алоімплантату обробляється таким чином, щоб виступаючі його частини та частини кістки-реципієнта повністю збігалися за типом «руського замка». На другому етапі проводиться заміщення післярезекційного дефекту довгої кістки. В інтрамедулярний канал сегментарного алоімплантату вводиться інтрамедулярний стрижень, здійснюється його блокування за допомогою гвинтів. Вільна частина стрижня вводиться у кістковомозковий канал кістки-реципієнта так, щоб «сходи» опилу алоімплантату та кістки-реципієнта повністю збігались. Далі проводиться блокування стрижня у кістці-реципієнті. Інтрамедулярний стрижень вводиться без застосування кісткового цементу. У зоні контакту алоімплантату та кістки-реципієнта додатково розташовуються вільні кісткові автотрансплантати (з місцевих тканин) та за допомогою швів фіксуються один до одного. У разі локалізації пухлини у проксимальному відділі стегнової кістки для фіксації алоімплантату використовується ніжка ендопротеза.
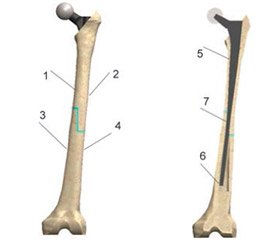
В лабораторії біомеханіки ДУ «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка НАМН України» проведено вивчення методом кінцевих елементів напружено-деформованого стану математичної моделі стегнової кістки з пухлинним ендопротезом. Ця модель була обрана як найбільш часто зареєстрована у літературі локалізація для виконання алокомпозитного ендопротезування у разі пухлинного ураження. Під час дослідження вивчали напружено-деформований стан моделі при виконанні резекції стегнової кістки прямим розтином (поперечна остеотомія) та розтином у вигляді сходинки (ступінчаста остеотомія). Зовнішній вигляд моделі наведено на рис. 1.
Зважаючи на процес регенерації, що відбувається у зоні контакту алоімплантату та кістки реципієнта, нами була змодельована ця ситуація у різні терміни після оперативного втручання. По лінії резекції моделювали наявність кісткового регенерату шляхом введення тонкого прошарку, якому надавали два різних значення модуля пружності для імітації стану регенерату через 3 та 6 місяців після операції. Для кожного типу резекції моделювали цементний та безцементний варіанти фіксування ніжки ендопротеза в кістково-мозковому каналі.
Механічні властивості біологічних тканин (кортикальна та губчаста кістка, хрящ) для математичного моделювання обрано за даними літератури [11–14]. Матеріал елементів ендопротеза — титан. Механічні характеристики штучних матеріалів обирали за даними технічної літератури [15]. При моделюванні використовували такі характеристики, як Е — модуль пружності (модуль Юнга), υ — коефіцієнт Пуассона. Механічні характеристики матеріалів, що використовували в розрахунках, наведені в табл. 1.
Для навантаження моделі моделювали масу тіла при одноопорному стоянні, для чого до головки стегнової кістки прикладали розподілену силу величиною 1100 Н, а до великого вертлюга прикладали силу дії м’язів, що відводять стегно, величиною 540 Н [16]. Опорна поверхня стопи моделі мала жорстке кріплення. Схема навантаження моделі наведена на рис. 2.
Величини максимальних напружень фіксували в чотирьох зонах на великогомілковій кістці та в трьох точках на ніжці ендопротеза. Схема розташування конт-рольних точок наведена на рис. 3.
Дослідження напружено-деформованого стану моделей виконували за допомогою методу кінцевих елементів. Як критерій оцінки напруженого стану моделей використовували напруження за Мізесом. Моделювання виконували за допомогою системи автоматизованого проєктування SolidWorks. Розрахунки напружено-деформованого стану моделей проводили за допомогою програмного комплексу CosmosM [17].
Результати та обговорення
Унаслідок проведеного дослідження були отримані дані про напружено-деформований стан моделі стегнової кістки з пухлинним ендопротезом, на яких вивчали варіанти виконання резекції стегнової кістки поперечною та ступінчастою остеотомією, а також цементну та безцементну фіксацію ніжки ендопротеза.
На рис. 4 наведено картину розподілу напружень в моделі з поперечною остеотомією в період після 3 місяців ендопротезування з безцементним кріпленням ніжки.
Дослідження показали, що при виконанні попереч-ної остеотомії діафіза стегнової кістки та безцементному способі фіксації ніжки в кістковомозковому каналі максимальні за величиною напруження (92,3 МПа) виникають в ніжці ендопротеза в зоні остеотомії. В діафізарній частині стегнової кістки зона максимальних напружень розташовується по медіальному боку, які набувають значень 10,5 та 10,1 МПа в дистальній та проксимальній частинах відповідно. На латеральному боці рівень напружень трохи нижчий і становить 9,3 та 9,9 МПа відповідно.
Картина розподілу напружень в моделі із ступінчастою остеотомією в період 3 місяці після ендопротезування з безцементним кріпленням ніжки наведена на рис. 5.
Використання ступінчастої остеотомії стегнової кістки в поєднанні з безцементною фіксацією ніжки ендопротеза в найближчий післяопераційний період (3 місяці) дозволяє знизити рівень напружень саме в зоні остеотомії до 59,1 МПа порівняно з поперечною остеотомією. При цьому величина напружень на дистальному кінці ніжки знижується до 4,2 МПа. За це доводиться розраховуватись мозаїчним розподілом напружень вище та нижче зони остеотомії. Так, максимальні за величиною напруження в кістковій тканині виникають по медіальній поверхні нижче від зони остеотомії (15,8 МПа) та по латеральній поверхні стегнової кістки (12,0 МПа) вище від зони остеотомії.
З протилежних боків спостерігається зворотна картина. Напруження вище від зони остеотомії більші, ніж в дистальній частині, — 8,4 та 7,7 МПа відповідно.
Дані про величини напружень в контрольних точках моделей з безцементним кріпленням ніжки в найближчий період після ендопротезування наведено в табл. 2.
Як бачимо, виконання ступінчастої остеотомії дозволяє знизити рівень напружень на ніжці ендопротеза в зоні остеотомії практично вдвічі. В інших контрольних точках моделей різниця в величинах напружень незначна.
На рис. 6 наведена картина розподілу напружень в моделі з поперечною остеотомією у період 6 місяців після ендопротезування з безцементним кріпленням ніжки.
У процесі набуття міцності кісткового регенерату після використання поперечної остеотомії в поєднанні з безцементною фіксацією ніжки спостерігається зниження рівня величин максимальних напружень в усіх контрольних точках моделі. Отже, характер розподілу напружень зберігається незмінним. Так, на досить високому рівні 75,6 МПа визначається максимальна величина напружень на ніжці ендопротеза саме в зоні остеотомії. Доцільно відзначити вирівнювання величин напружень в діафізарній частині стегнової кістки, де вони визначаються в межах від 9,5 до 10,0 МПа.
Картину розподілу напружень в моделі із ступінчастою остеотомією у період 6 місяців після ендопротезування з безцементним кріпленням ніжки можна спостерігати на рис. 7.
Аналогічна картина спостерігається і при використанні ступінчастої остеотомії при безцементному кріпленні ніжки ендопротеза. Набуття міцності кісткового регенерату веде до зниження величин максимальних напружень в контрольних точках моделі. Отже, вирівнювання величин напружень в діафізі стегнової кістки відбувається повільніше, ніж при виконанні поперечної остеотомії. Діапазон напружень в діафізарній частині стегнової кістки визначається більш широким — від 7,9 до 13,8 МПа. Дані про величини напружень в контрольних точках моделей з безцементним кріпленням ніжки у період 6 місяців після ендопротезування наведені в табл. 3.
Як бачимо, набуття міцності кісткового регенерату сприяє вирівнюванню величин напружень як між контрольними точками кожної з моделей, так і між моделями з різними видами остеотомії стегнової кістки. Отже, різниця у величинах напружень на ніжках ендопротезів саме в зонах остеотомій та на їх дистальних кінцях залишається досить значною на користь моделі із ступінчастою остеотомією.
Розглянути напружено-деформований стан моделі з поперечною остеотомією в поєднанні з цементним кріпленням ніжки в період 3 місяці після ендопротезування можна на рис. 8.
Використання цементу для фіксації ніжки ендопротеза в поєднанні з поперечною остеотомією стегнової кістки в післяопераційний період 3 місяці не веде до принципових змін в напружено-деформованому стані моделі. Максимальна величина напружень (77,1 МПа) визначається на ніжці ендопротеза в зоні остеотомії. Слід звернути увагу на зниження величин напружень на дистальному та проксимальному кінцях ніжки ендопротеза порівняно з її безцементним варіантом кріплення до 8,5 та 14,8 МПа відповідно. Також можна відзначити досить рівномірний розподіл напружень в діафізі стегнової кістки, де їх максимальні значення визначаються в діапазоні від 9,9 до 10,5 МПа.
На рис. 9 наведено картину напружено-деформованого стану моделі із ступінчастою остеотомією та цементним кріпленням ніжки в період 3 місяці після ендопротезування.
При використанні ступінчастої остеотомії наявність цементного прошарку між ніжкою ендопротеза та стінкою кістковомозкового каналу дозволяє знизити рівень напружень на ніжці ендопротеза в зоні остеотомії до позначки 31,5 МПа. В інших контрольних точках моделі також спостерігається зниження рівня напружень, але не такі помітні.
Дані про значення максимальних величин напружень в контрольних точках моделей з цементним кріпленням ніжки в період 3 місяці після ендопротезування наведені в табл. 4.
Як бачимо, наявність цементного прошарку між ніжкою ендопротеза та стінкою кістковомозкового каналу не веде до принципових змін напружено-деформованого стану моделей порівняно з безцементним варіантом, але звертає увагу велика різниця величин напружень в зоні остеотомії більше ніж удвічі.
Розглянемо картину напружено-деформованого стану моделі з поперечною остеотомією та цементним кріпленням ніжки у період 6 місяців після ендопротезування, наведену на рис. 10.
Як і в моделі з безцементною фіксацією ніжки ендопротеза, підвищення міцності кісткового регенерату в зоні остеотомії при цементному кріпленні ніжки в поєднанні з поперечною остеотомією стегнової кістки дозволяє знизити рівень величин напружень в усіх контрольних точках моделі. Отже, на характер розподілу напружень в моделі ці зміни не мають принципового впливу.
Розподіл напружень в моделі із ступінчастою остеотомією стегнової кістки та цементним кріпленням ніжки ендопротеза у період 6 місяців після ендопротезування можна спостерігати на рис. 11.
У моделі із ступінчастою остеотомією стегнової кістки та цементним кріпленням ніжки ендопротеза підвищення міцності кісткового регенерату приводить до невеликого зменшення величин напружень в усіх контрольних точках моделей, без принципових змін у характері розподілу цих напружень.
Дані про значення величин напружень в контрольних точках моделей з цементним кріпленням ніжки ендопротеза у періоді 6 місяців після ендопротезування наведені в табл. 5.
Результати проведеного дослідження дозволяють стверджувати, що виконання остеотомії стегнової кістки у вигляді сходинки дозволяє значно знизити рівень напружень в зоні остеотомії, що має особливе значення в найближчому післяопераційному періоді (3 місяці) після ендопротезування, поки міцність кісткового регенерату по лінії остеотомії не набуває достатнього рівня.
Проведене дослідження показало, що ступінчаста остеотомія стегнової кістки дозволяє вдвічі знизити рівень механічних напружень в зоні остеотомії. Це відбувається завдяки тому, що виконання розтину у вигляді сходинки дозволяє кістковим фрагментам надавати спротив зсувним переміщенням. Це пояснює й виникнення асиметричних пікових напружень вище та нижче від зони остеотомії.
Використання кісткового цементу для фіксації ніжки ендопротеза дає можливість значно знизити рівень напружень навколо ніжки ендопротеза при обох варіантах виконання остеотомії стегнової кістки. Це відбувається через те, що кістковий цемент, маючі модуль пружності за проміжною величиною між титаном та кістковою тканиною, утворює між ними прошарок, який виконує демпферну функцію, чим згладжує різницю величин деформації металу та кісткової тканини, тим самим знижуючи рівень напружень в них. Саме тому значне зменшення величини напружень в моделях із цементною фіксацією ніжки спостерігається тільки в кістковомозковому каналі та ніжці ендопротеза.
Висновки
У результаті проведеного математичного моделювання було виявлено, що виконання ступінчастої остео-томії стегнової кістки дозволяє вдвічі знизити рівень механічних напружень в зоні остеотомії порівняно з моделями з поперечною остеотомією.
Використання кісткового цементу для фіксації ніжки ендопротеза у теоретичній моделі також дозволяє значно знизити рівень напружень в усіх варіантах досліджених моделей через утворення демпферного прошарку між металом та кістковою тканиною.
Набуття міцності кісткового регенерату з часом приводить до вирівнювання величин напружень як між контрольними точками кожної з моделей, так і між моделями з різними видами остеотомії стегнової кістки.
Отже, у результаті проведеного дослідження була математично обґрунтована методика алокомпозитного ендопротезування, що була нами удосконалена. Отримано найкращі результати при застосуванні ступінчастої остеотомії та фіксації алокістки з кісткою реципієнта за типом «руського замка» та інтрамедулярною фіксацією всієї системи.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Pearce A.I., Richards R.G., Milz S. et al. Animal Models for Implant Biomaterial Research in Bone: a Review. Eur. Cells Materials. 2007. Vol. 13. P. 1-10.
2. Mumford J.E. Management of Bone Defects: a Review of Available Techniques. Iowa Orthop. J. 1992. Vol. 12. P. 42-49.
3. Bloebaum R.D., Merrell M., Gustke K., Simmons M. Retrieval analysis of a hydroxyapatite-coated hip prosthesis. Clin. Orthop. Relat. Res. 1991. Vol. 267. Р. 97-102.
4. Kuhn J.L., Goldstein S.A., Ciarelli M.J., Matthews L.S. The limitations of canine trabecular bone as a model for human: a biomechanical study. J. Biomech. 1989. Vol. 22. Р. 95-107.
5. Liebschner M.A. Biomechanical considerations of animal models used in tissue engineering of bone. Biomaterials. 2004. Vol. 25. Р. 1697-1714.
6. Zehr R.J., Enneking W.F., Scarborough M.T. Allograft-prosthesis composite versus megaprosthesis in proximal femoral reconstruction. Clin. Orthop. Relat. Res. 1996. Vol. 322.Р. 207-223.
7. Capanna R., Donati I.X., Masctti C. et al. Effect of electromagnetic fields on patients undergoing massive bone graft following bone tumor resection: a double blind study. Clin. Orthop. Rclat. Res. 1994. Vol. 306. 213-221.
8. Blunn G.W., Briggs T.W., Cannon S.R. et al. Cementless fixation for primary segmental bone tumor endoprostheses. Clin. Orthop. 2000. Vol. 372. Р. 223-230.
9. Capanna R., Morris H.G., Campanacci D. et al. Modular uncemented prosthetic reconstruction after resection of tumours of the distal femur. J. Bone Joint Surg. Br. 1994. № 76. Р. 178-186.
10. Вирва О.Е. Модульне індивідуальне ендопротезування в лікуванні хворих на злоякісні пухлини кісток кінцівок: дис. д-ра. мед. наук: 14.01.21. Київ, 2013. 398 с.
11. Березовский В.А., Колотилов Н.Н. Биофизические характеристики тканей человека: Справочник. К.: Наукова думка, 1990. 224 с.
12. Вирва О.Є. Біомеханічне дослідження напружено-деформованих станів системи «ендопротез — плечова кістка» за умов резекції пухлини. Ортопедия, травматология и протезирование. 2015. № 3. С. 14-20. DOI: 10.15674/0030-59872015314-20.
13. Вирва О.Є. Експериментальне обґрунтування комбінованої фіксації пухлинного ендопротеза для заміщення діафізарних дефектів довгих кісток у щурів. Ортопедия, травматология и протезирование. 2015. № 4. С. 49-54. DOI: 10.15674/0030-59872015449-54.
14. Вирва О.Є. Комбінована фіксація модульного пухлинного ендопротеза проксимального відділу плечової кістки (експериментально-клінічне дослідження). Ортопедия, травматология и протезирование. 2017. № 3. С. 99-104. DOI: 10.15674/0030-59872017399-104.
15. Gere J.M. Mechanics of Material. Boston: PWS Publishing Company, 1997. 912 p.
16. Образцов И.Ф. Проблема прочности в биомеханике: учебное пособие для техн. и биол. спец. ВУЗ. М.: Высшая школа, 1988. 311 с.
17. Алямовский А.А. SolidWorks/COSMOSWorks. Инженерный анализ методом конечных элементов. М.: ДМК Пресс, 2004. 432 с.
18. Вырва О.Е., Головина Я.А., Малык Р.В. Аллокомпозитное эндопротезирование при хирургическом лечении пациентов со злокачественными опухолями длинных костей (обзор литературы). Ортопедия, травматология, протезирование. 2015. № 2. С. 120-126.

/48-1.jpg)
/49-1.jpg)
/50-1.jpg)
/51-1.jpg)
/52-1.jpg)
/53-1.jpg)