Международный эндокринологический журнал Том 16, №1, 2020
Вернуться к номеру
Зміни варіабельності ритму серця під впливом цукрознижуючої терапії у хворих на цукровий діабет 2-го типу
Авторы: Перцева Н.О., Мошенець К.І.
ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», м. Дніпро, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
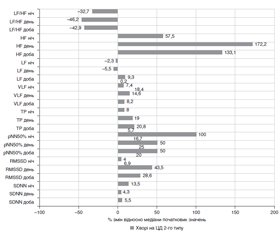
Актуальність. Цукровий діабет (ЦД) визнаний Всесвітньою організацією охорони здоров’я неінфекційною епідемією XXI сторіччя. Серцево-судинна патологія є основною причиною смерті цих пацієнтів. Мета дослідження: вивчити показники варіабельності ритму серця (ВРС) у хворих на ЦД 2-го типу залежно від ступеня компенсації, а також їх динаміку після корекції цукрознижуючої терапії. Матеріали та методи. Обстежено 53 пацієнти з ЦД 2-го типу та 10 практично здорових людей контрольної групи. Лабораторне дослідження включало визначення С-пептиду, глікованого гемоглобіну (HbA1c), креатиніну крові та мікроальбуміну в ранковій порції сечі. Усім обстежуваним проводилось тривале моніторування глікемії паралельно з електрокардіографією за Холтером протягом 24 годин. Пацієнти були розподілені на дві групи за рівнем НbА1с: група 1 (n = 23) з НbА1с ≤ 7 % і група 2 (n = 30) з НbА1с > 7 %. Групи були розподілені на підгрупи з відсутністю (а) або наявністю (б) гіпоглікемії. Через 6 місяців після модифікації цукрознижуючої терапії проводилось повторне обстеження пацієнтів в тому ж обсязі. Результати. Групи та підгрупи хворих на ЦД 2-го типу суттєво не відрізнялись між собою за показниками ВРС (p > 0,05) та мали вірогідне зниження показників SDNN доба, pNN50% доба, VLF доба, високочастотний спектр (HF) ВРС доба порівняно з контрольною групою (р < 0,05). Добові показники загальної потужності спектра (TP) суттєво не відрізнялись від контролю тільки в 1а підгрупі (р > 0,05). Значення низькочастотного спектра (LF) ВРС були вірогідно нижчими порівняно з контролем тільки при аналізі всієї основної групи хворих на ЦД 2-го типу. Показник LF/HF був суттєво вищим від контролю в усіх підгрупах обох груп (р < 0,05). Висновки. Пацієнти з ЦД 2-го типу мали вірогідно нижчі показники ВРС, які переважно стосувались SDNN, TP та VLF, HF і LF/HF. Через 6 місяців після модифікації цукрознижуючої терапії отримано вірогідне збільшення практично всіх показників ВРС, окрім LF. Найбільша динаміка стосувалась підвищення показників pNN50% доба (+50 %), pNN50% день (+50 %), RMSSD день (+43,5 %), RMSSD доба (+28,6 %), HF (+133,1 % — доба, +172,2 % — день, +57,5 % — ніч) та зниження відношення LF/HF (–42,9 % — доба, –46,2 % — день, –32,7 % — ніч) (p < 0,05). Отримані результати наочно демонструють відновлення вагосимпатичного балансу серцево-судинної системи під впливом компенсації вуглеводного обміну.
Актуальность. Сахарный диабет (СД) признан Всемирной организацией здравоохранения неинфекционной эпидемией XXI века. Сердечно-сосудистая патология является основной причиной смерти этих пациентов. Цель исследования: изучить показатели вариабельности сердечного ритма (ВСР) у больных СД 2-го типа в зависимости от степени компенсации, а также их динамику после коррекции сахароснижающей терапии. Материалы и методы. Обследовано 53 пациента с СД 2-го типа и 10 практически здоровых людей контрольной группы. Лабораторное исследование включало определение С-пептида, гликированного гемоглобина (HbA1c), креатинина крови и микроальбумина в утренней порции мочи. Всем обследуемым проводилось длительное мониторирование гликемии параллельно с электрокардиографией по Холтеру в течение 24 часов. Пациенты были разделены на две группы по уровню НbА1с: группа 1 (n = 23) с НbА1с ≤ 7 % и группа 2 (n = 30) с НbА1с > 7 %. Группы были разделены на подгруппы по отсутствию (а) или наличию (б) гипогликемии. Через 6 месяцев после модификации сахароснижающей терапии проводилось повторное обследование пациентов в том же объеме. Результаты. Группы и подгруппы больных СД 2-го типа существенно не отличались между собой по показателям ВСР (p > 0,05) и имели достоверное снижение показателей SDNN сутки, pNN50% сутки, VLF сутки, высокочастотный спектр (HF) ВРС сутки в сравнении с контрольной группой (р < 0,05). Суточные показатели общей мощности спектра (TP) существенно не отличались от контроля только в 1а подгруппе (р > 0,05). Значения низкочастотного спектра (LF) ВРС сутки были достоверно ниже по сравнению с контролем только при анализе всей основной группы больных СД 2-го типа. Показатель LF/HF сутки был достоверно выше контроля во всех подгруппах обеих групп (р < 0,05). Выводы. Пациенты с СД 2-го типа имели достоверно более низкие показатели ВСР, которые преимущественно касались SDNN, TP и VLF, HF и LF/HF. Через 6 месяцев после модификации сахароснижающей терапии получено достоверное увеличение практически всех показателей ВСР, кроме LF. Наибольшая динамика касалась повышения показателей pNN50% сутки (+50 %), pNN50% день (+50 %), RMSSD день (+43,5 %), RMSSD сутки (+28,6 %), HF (+133,1 % — сутки, +172,2 % — день, +57,5 % — ночь) и снижение отношения LF/HF (–42,9 % — сутки, –46,2 % — день, –32,7 % — ночь) (p < 0,05). Полученные результаты наглядно демонстрируют восстановление вагосимпатического баланса сердечно-сосудистой системы под влиянием компенсации углеводного обмена.
Background. The World Health Organization (WHO) has identified diabetes mellitus (DM) as a non-communicable epidemic of the XXI century. Cardiovascular pathology is a major cause of death for these patients. The purpose was to study the indicators of heart rate variability (HRV) in patients with type 2 DM, depending on the course of the disease, and HRV changes after the management of hyperglycemia. Materials and methods. We examined 53 type 2 DM patients and 10 healthy controls. Laboratory tests include determination of C-peptide, glycated hemoglobin (HbA1c), serum creatinine and urinary albumin concentration (UAC). All subjects underwent continuous glucose monitoring and 24-hour Holter monitoring at the same time. The patients were divided into 2 groups according to the НbА1с level: group 1 (n = 23) with НbА1с ≤ 7.0 % and group 2 (n = 30) with НbА1с > 7.0 %. The groups were divided into subgroups according to the absence (a) or presence (b) of hypoglycemia. The patients were re-examined after 6 months of glucose-lowering therapy modification. Results. HRV parameters did not differ significantly between the groups and subgroups of type 2 DM patients (p > 0.05). Both groups and subgroups, as well as the whole basic group of type 2 DM patient, had a significant decrease in SDNN daily, pNN50% daily, VLF daily, HF daily indicators compared with control subjects (р < 0.05). There were no statistically significant differences in daily TP between the control group and subgroup 1а only (р > 0.05). LF daily level was significantly lower compared to control only to all patients with type 2 DM. Daily LF/HF ratio was significantly higher in all subgroups of both groups than the control one (р < 0.05). Conclusions. Type 2 DM patients had significantly lower HRV, which mainly consists of SDNN, TP, VLF, HF LF/HF ratio. Six months after glucose-lowering therapy modification, we received a significant increase in most HRV indicators, except for LF. Main changes were observed in pNN50% daily (+50 %), pNN50% day (+50 %), RMSSD day (+43.5 %), RMSSD daily (+28.6 %), HF (+133.1 % – daily, +172.2 % — day, +57.5 % — at night) and a decrease in LF/HF ratio (–42.9 % — daily, –46.2 % — day, –32.7 % — at night) (p < 0.05). The results clearly demonstrate the restoration of the cardiac vagosympathetic balance due to compensation of carbohydrate metabolism.
цукровий діабет 2-го типу; варіабельність ритму серця; компенсація вуглеводного обміну
сахарный диабет 2-го типа; вариабельность сердечного ритма; компенсация углеводного обмена
type 2 diabetes mellitus; heart rate variability; compensation for carbohydrate metabolism
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
1. International Diabetes Federation. IDF Diabetes Atlas. 9th ed. 2019. Available from: https://www.diabetesatlas.org/upload/resources/2019/IDF_Atlas_9th_Edition_2019.pdf.
2. International Diabetes Federation. Diabetes and cardiovascular disease. Brussels, Belgium: International Diabetes Federation, 2016. Available from: https://idf.org/our-activities/care-prevention/cardiovascular-disease/cvd-report.html#sub-content-tab-nav.
3. Madonna R., Pieragostino D., Balistreri C.R. et al. Diabetic macroangiopathy: Pathogenetic insights and novel therapeutic approaches with focus on high glucose-mediated vascular damage. Vascul. Pharmacol. 2018. 1537–1891(17). 30322-1. doi: 10.1016/j.vph.2018.01.009.
4. Katakami N. Mechanism of development of atherosclerosis and cardiovascular disease in diabetes mellitus. J. Atheroscler. Thromb. 2018. 25(1). 27-39. doi: 10.5551/jat.RV17014.
5. Vaidya V., Gangan N., Sheehan J. Impact of cardiovascular complications among patients with Type 2 diabetes mellitus: a systematic review. Expert Rev. Pharmacoecon. Outcomes Res. 2015. 15(3). 487-97. doi: 10.1586/14737167.2015.1024661.
6. Einarson T.R., Acs A., Ludwig C., Panton U.H. Cardiovasc Diabetol. Prevalence of cardiovascular disease in type 2 diabetes: a systematic literature review of scientific evidence from across the world in 2007-2017. Cardiovasc. Diabetol. 2018. 17(1). 83. doi: 10.1186/s12933-018-0728-6.
7. Hudjakova L.A., Bagatenkova A.I., Kulahmetov D.R. Spectral analysis method of heart rate variability. Vіsnik NTUU “KPІ”. Serіja Priladobuduvannja. 2018. 55(1). 138-44 (in Russian).
8. Heart rate variability. Standards of measurement, physiological interpretation, and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Eur. Heart J. 1996. 17(3). 354-81. PMID: 8737210.
9. Shaffer F., Ginsberg J.P. An Overview of Heart Rate Variability Metrics and Norms Front Public Health. 2017. 5. 258. doi: 10.3389/fpubh.2017.00258. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5624990/pdf/fpubh-05-00258.
10. Bishop S.A., Dech R.T., Guzik P. Neary JP. Heart rate va–riability and implication for sport concussion. Clin. Physiol. Funct. Imaging. 2018. 38(5). 733-42. doi: 10.1111/cpf.12487.
11. The Diabetes Control and Complications Trial Research Group The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N. Engl. J. Med. 1993. 329. 977-86. doi: 10.1056/NEJM199309303291401.
13. ADVANCE Collaborative Group, Patel A., MacMahon S., et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N. Engl. J. Med. 2008. 358. 2560-72. doi: 10.1056/NEJMoa0802987.
14. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998. 352. 837-53. doi: 10.1016/S0140-6736(98)07019-6.
15. Rodriguez-Gutierrez R., Gonzalez-Gonzalez J.G., Zuñiga-Hernandez J.A., McCoy R.G. Benefits and harms of intensive glycemic control in patients with type 2 diabetes. BMJ. 2019. 367. 15887. doi: 10.1136/bmj.l5887.
16. Bergenstal R.M., Beck R.W., Close C.L. et al. Glucose management indicator (GMI): a new term for estimating A1C from continuous glucose monitoring. Diabetes Care. 2018. 41(11). 2275-80. doi: 10.2337/dc18-1581.
17. Heinemann L., Freckmann G., Ehrmann D. et al. Real-time continuous glucose monitoring in adults with type 1 diabetes and impaired hypoglycaemia awareness or severe hypoglycaemia treated with multiple daily insulin injections (HypoDE): a multicentre, randomised controlled trial. Lancet. 2018. 391(10128). 1367-77. doi: 10.1016/S0140-6736(18)30297-6.
18. Kovatchev B.P. Metrics for glycaemic control-from HbA 1c to continuous glucose monitoring. Nat. Rev. Endocrinol. 2017. 13(7). 425-36. doi: 10.1038/nrendo.2017.3.
19. Spallone V. Update on the impact, diagnosis and management of cardiovascular autonomic neuropathy in diabetes: what is defined, what is new, and what is unmet. Diabetes Metab. J. 2019. 43(1). 3-30. doi: 10.4093/dmj.2018.0259.
20. Nganou-Gnindjio C.N., Mba C.M., Azabji-Kenfack M. et al. Poor glycemic control impacts heart rate variability in patients with type 2 diabetes mellitus: a cross sectional study. BMC Res. Notes. 2018. 11(1). 599. doi: 10.1186/s13104-018-3692-z.
21. Koçer A., Aktürk Z., Maden E., Taşçı A. Orthostatic hypotension and heart rate variability as signs of cardiac autonomic neuropathy in diabetes mellitus. Eur. J. Gen. Med. 2005. 2(1). 5-9. doi: 10.29333/ejgm/82257.
22. Trivedi G.Y., Saboo B., Singh R.B., Maheshwari A., Sharma K., Verma N. Can decreased heart rate variability be a marker of autonomic dysfunction, metabolic syndrome and diabetes? J. Diabetol. 2019. 10(2). 48-56. doi: 10.4103/jod.jod_17_18.

/35.jpg)
/36.jpg)
/37.jpg)