Международный эндокринологический журнал Том 16, №1, 2020
Вернуться к номеру
Вміст кислотно-лабільної субодиниці в крові дітей з ознаками затримки внутрішньоутробного розвитку на тлі нормосоматотропінемії
Авторы: Большова О.В., Музь Н.М.
ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
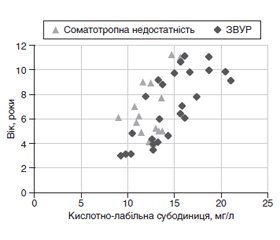
Актуальність. Недостатній для гестаційного віку ріст становить приблизно 20 % від усіх випадків низькорослості в дітей. Незважаючи на те, що більшість дітей із затримкою внутрішньоутробного розвитку (ЗВУР) наздоганяють у рості в ранньому дитинстві (протягом першого-другого років життя), майже 10 % таких пацієнтів за невідомих причин залишаються низькорослими. Рівень кислотно-лабільної субодиниці (КЛС) відіграє критичну роль у регуляції рівнів інсуліноподібного фактора росту 1 (ІФР-1) та зв’язуючого білка 3 (ІФР-ЗБ-3), яким належить важлива роль у регуляції фетального і постнатального росту дитини. На сьогодні невідомо, як саме ці гормони впливають на виникнення ЗВУР та постнатальний ріст таких пацієнтів. Мета роботи: визначити рівень КЛС у сироватці крові в пацієнтів з ознаками затримки внутрішньоутробного розвитку, які мають нормальний стимульований викид гормона росту. Матеріали та методи. Обстежені 25 дітей із низькорослістю, які народилися з ознаками ЗВУР, середній вік яких становив 6,98 ± 0,55 року. Усім пацієнтам проведено по два стимуляційні тести (інсулін, клонідин). Установлена наявність нормального викиду гормона росту у всіх обстежених (> 10,0 нг/мл). Рівні гормона росту, ІФР-1, ІФР-ЗБ-3 визначали методом твердофазного імуноферментного аналізу з використанням наборів Immulate 2000 XPi. Рівні тиреотропного гормона, вільного Т4 визначали імунорадіометричним методом за допомогою стандартних наборів (Immunotech® kit, Chech Republic). Рівень кислотно-лабільної субодиниці в сироватці крові визначали за допомогою набору ELISA Cusabio (Х’юстон, США). Значення виражали в Standard Deviation Score (SDS) відповідно до віку і статі. Для статистичної обробки даних використовували пакет програм Microsoft Excel. Результати дослідження представлені у вигляді середніх значень та їх стандартної похибки (М ± m). Для перевірки кореляції був використаний коефіцієнт кореляції Пірсона. Статистичну вірогідність оцінювали за параметричним t-критерієм Стьюдента. Різницю вважали вірогідною при р < 0,05. Результати. Середнє значення КЛС для всіх обстежених пацієнтів становило мінус 0,8 SDS, що значно нижче 0 SDS (р < 0,05). Зниження рівня КЛС супроводжується різким зменшенням рівнів ІФР-1 та ІФР-ЗБ-3. КЛС SDS значно корелює з ІФР-1 SDS (r = 0,79) і ІФР-ЗБ-3 SDS (r = 0,67). Загалом по групі виявлений слабкий кореляційний зв’язок рівнів SDS кислотно-лабільної субодиниці і показників росту пацієнтів з ознаками ЗВУР (r = 0,25) і маси тіла (r = 0,18). У 9 осіб (36 %) з ознаками ЗВУР показники рівнів КЛС, ІФР-1 та ІФР-ЗБ-3 знаходились у межах нижче мінус 1,5 SDS (від мінус 1,5 до мінус 2,0 SDS). У цій групі пацієнтів КЛС SDS значно корелювала із SDS росту (r = 0,66). Дівчатка з ознаками ЗВУР при народженні мали нижчі показники КЛС, ніж хлопчики, а саме мінус 0,91 ± 0,18 SDS і мінус 0,74 ± 0,17 SDS відповідно, хоча різниця між цими показниками була невірогідною (р > 0,05). Виявлено, що рівень КЛС у сироватці крові збільшується з віком (r = 0,74, р < 0,05). Висновки. У дітей з ознаками затримки внутрішньоутробного розвитку на тлі нормосоматотропінемії спостерігається вірогідне зниження рівнів кислотно-лабільної субодиниці в сироватці крові, причому в 36 % випадків — різке зниження цього показника (від мінус 1,5 до мінус 2,0 SDS). Знижений рівень кислотно-лабільної субодиниці супроводжується суттєвим зменшенням рівнів інсуліноподібного фактора росту 1 та білка, що його зв’язує. Загалом по групі виявлено слабкий кореляційний зв’язок рівнів SDS кислотно-лабільної субодиниці і показників росту пацієнтів з ознаками ЗВУР і маси тіла. Однак установлено, що найнижчі рівні кислотно-лабільної субодиниці асоціюються з найбільшим відставанням у рості пацієнтів зі ЗВУР, найнижчими показниками ІФР-1 і ІФР-ЗБ-3. Виявлено, що і в групі пацієнтів, які народились з ознаками ЗВУР, і в дітей із соматотропною недостатністю рівень кислотно-лабільної субодиниці в сироватці крові зростав із віком.
Актуальность. Недостаточный для гестационного возраста рост составляет примерно 20 % от всех случаев низкорослости у детей. Несмотря на то, что у большинства детей с задержкой внутриутробного развития (ЗВУР) отмечается скачок роста в раннем детстве (в течение первого-второго года жизни), почти 10 % таких пациентов по неизвестным причинам остаются низкорослыми. Уровень кислотно-лабильной субъединицы (КЛС) играет критическую роль в регуляции уровней инсулиноподобного фактора роста 1 (ИФР-1) и связывающего белка 3 (ИФР-СБ-3), которым принадлежит важная роль в регуляции фетального и постнатального роста ребенка. На сегодняшний день неизвестно, как именно эти гормоны влияют на возникновение ЗВУР и постнатальный рост таких пациентов. Цель работы: определить уровень кислотно-лабильной субъединицы в сыворотке крови детей, родившихся с признаками задержки внутриутробного развития, при нормальном стимулированном выбросе гормона роста. Материалы и методы. Обследованы 25 детей с низкорослостью, родившихся с признаками ЗВУР, средний возраст которых составил 6,98 ± 0,55 года. Всем пациентам проведено по два стимуляционных теста (инсулин, клонидин). Установлено наличие нормального выброса гормона роста у всех обследованных (> 10,0 нг/мл). Уровни гормона роста, ИФР-1, ИФР-СБ-3 определяли методом твердофазного иммуноферментного анализа с использованием наборов Immulate 2000 XPi. Уровни тиреотропного гормона, свободного Т4 определяли иммунорадиометрическим методом с помощью стандартных наборов (Immunotech® kit, Chech Republic). Уровень кислотно-лабильной субъединицы в сыворотке крови определяли при помощи набора ELISA Cusabio (Хьюстон, США). Значения выражали в Standard Deviation Score (SDS) соответственно возрасту и полу. Для статистической обработки данных использовали пакет программ Microsoft Excel. Результаты исследования представлены в виде средних значений и их стандартной ошибки (М ± m). Для проверки корреляции был использован коэффициент корреляции Пирсона. Статистическую достоверность оценивали по параметрическому t-критерию Стьюдента. Различие считали достоверным при р < 0,05. Результаты. Среднее значение КЛС для всех обследованных пациентов составляло минус 0,8 SDS, что значительно ниже 0 SDS (р < 0,05). Снижение уровня КЛС сопровождается резким уменьшением уровней ИФР-1 и ИФР-СБ-3. КЛС SDS существенно коррелирует с ИФР-1 SDS, r = 0,79, и ИФР-СБ-3 SDS, r = 0,67. В целом по группе выявлена слабая коррелятивная связь уровней SDS кислотно-лабильной субъединицы и показателей роста пациентов с признаками ЗВУР (r = 0,25) и массы тела (r = 0,18). У 9 человек (36 %) с признаками ЗВУР показатели уровней КЛС, ИФР-1 и ИФР-СБ-3 находились в пределах ниже минус 1,5 SDS (от минус 1,5 до минус 2,0 SDS). В этой группе пациентов КЛС SDS значительно коррелировала с SDS роста (r = 0,66). У девочек с признаками ЗВУР при рождении были более низкие показатели КЛС, чем у мальчиков, а именно минус 0,91 ± 0,18 SDS и минус 0,74 ± 0,17 SDS соответственно, хотя различие между этими показателями было недостоверным (р > 0,05). Выявлено, что уровень КЛС в сыворотке крови повышается с возрастом (r = 0,74, р < 0,05). Выводы. У детей с признаками задержки внутриутробного развития на фоне нормосоматотропинемии наблюдается достоверное снижение уровней кислотно-лабильной субъединицы в сыворотке крови, причем в 36 % случаев — резкое снижение этого показателя (от минус 1,5 SDS до минус 2 SDS). Снижение уровня кислотно-лабильной субъединицы сопровождается существенным уменьшением уровней инсулиноподобного фактора роста 1 и связывающего его белка. В целом по группе выявлена слабая коррелятивная связь уровней SDS кислотно-лабильной субъединицы и показателей роста и массы тела пациєнтов с признаками ЗВУР. Однако установлено, что самые низкие уровни кислотно-лабильной субъединицы ассоциируются с наибольшим отставанием в росте пациента со ЗВУР. Определено, что и в группе пациентов, которые родились со ЗВУР, и у детей с соматотропной недостаточностью уровень кислотно-лабильной субъединицы в сыворотке крови повышался с возрастом.
Background. Insufficient growth in children born small for gestational age (SGA) is about 20 % of all cases of short stature. Despite the fact that most children born small for gestational age have a catch-up growth in early childhood (within 1–2 years of life), almost 10 % of these patients remain with persistent short stature for unknown reasons (Finken M.J.J. et al., 2018). The level of acid-labile subunit (ALS) plays a critical role in regulating the levels of insulin-like growth factor-1 (IGF-1) and the binding protein-3 (IGF-BP-3), which have an important role in regulating fetal and postnatal growth of the child. Today, it is not known exactly how these hormones affect the occurrence of SGA and postnatal growth of such patients. The purpose of the study was to determine the level of acid-labile subunit in the blood serum in SGA children with short stature with normal growth hormone. Materials and methods. We examined 25 prepubertal SGA children with short stature with the average age of 6.98 ± 0.55 years. All patients had two stimulation tests (insulin, clonidine). The growth factor was normal in all examined patients (> 10.0 ng/ml). The blood serum ALS was determined using a Cusabio ELISA kit (Houston, USA). The values are presented in SDS according to the age and gender. For statistical data processing, the Microsoft Excel software package was used. The results of the study are presented in the form of mean values and their standard error (M ± m). Pearson’s correlation coefficient was used to test for correlations. A P-value < 0.05 was considered significant. Results. The mean ALS level for all examined patients was –0.8 SDS, which is significantly lower than 0 SDS (p < 0.05). A decrease in the ALS level is accompanied by a significant decrease of IGF-1 and IGF-BP-3 levels. ALS SDS significantly correlates with IGF-1 SDS, r = 0.79 and IGF-BP-3 SDS, r = 0.67. We found a weak correlation in the total group of short SGA children between SDS ALS levels and patient growth, r = 0.25, and body weight, r = 0.18. In 9 SGA children with short stature (36 %), the levels of ALS, IGF-1 and IGF-BP-3 were in the range below –1.5 SDS (from –1.5 to –2.0 SDS). In this group of patients, ALS SDS significantly correlated with SDS growth (r = 0.66). SGA girls had lower ALS level than boys, –0.91 ± 0.18 SDS and –0.74 ± 0.17 SDS, respectively, although the difference between these indicators was not significant (p > 0.05). The study tested that the blood serum ALS increases with age (r = 0.74, p < 0.05). Conclusions. In the short SGA children with normosomatotropinemia, a decrease in serum acid-labile subunit levels is observed, and in 36 % of cases, its significant decrease was found (below –1.5 SDS). A decrease in the level of acid-labile subunit is accompanied by a significant decrease in the levels of insulin-like growth factor-1 and its binding protein. The total group of short SGA children showed a weak correlation between the SDS ALS levels and growth and body weight. However, it was found that the lowest levels of acid-labile subunit are associated with the greatest growth retardation in SGA children with short stature. It was found that the level of acid-labile subunit in blood serum increased with age both in groups of short SGA children and in children with growth hormone deficiency.
затримка внутрішньоутробного розвитку; діти; кислотно-лабільна субодиниця; гормон росту; інсуліноподібний фактор росту 1; інсуліноподібний фактор росту — зв’язуючий білок 3
задержка внутриутробного развития; дети; кислотно-лабильная субъединица; гормон роста; инсулиноподобный фактор роста 1; инсулиноподобный фактор роста — связывающий белок 3
small for gestational age; children; acid-labile subunit; growth hormone; insulin-like growth factor-1; insulin-like growth factor-binding protein-3
Вступ
Матеріали та методи
Результати
/43.jpg)
Обговорення
Висновки
1. Clayton P.E., Cianfarani S., Czernichow P., Johannsson G., Rapaport R., Rogol A. Management of the child born small for gestational age through to adulthood: a consensus statement of the International Societies of Paediatric Endocrinology and the Growth Hormone Research Society. J. Clin. Endocrinol. Metab. 2007. 92(3). Р. 804-10. doi: 10.1210/jc.2006-2017.
2. Karlberg J., Albertsson-Wikland K. Growth in full-term small-for-gestational-age infants: from birth to final height. Pediatr. Res. 1995. 38(5). Р. 733-9. doi: 10.1203/00006450-199511000-00017.
3. Finken M.J.J., van der Steen M., Smeets C.C.J., Walenkamp M.J.E., de Bruin C., Hokken-Koelega A.C.S., Wit J.M. Children Born Small for Gestational Age: Differential Diagnosis, Molecular Genetic Evaluation, and Implications. Endocr. Rev. 2018. 39(6). Р. 851-894. doi: 10.1210/er.2018-00083.
4. Renes J.S., van Doorn J., Breukhoven P.E., Lem A.J., de Ridder M.A., Hokken-Koelega A.C. Acid-labile subunit levels and the association with response to growth hormone treatment in short children born small for gestational age. Horm. Res. Paediatr. 2014. 81(2). Р. 126-32. doi: 10.1159/000356926.
5. Khosravi M.J., Diamandi A., Mistry J., Krishna R.G., Khare A. Acid-labile subunit of human insulin-like growth factor-binding protein complex: measurement, molecular, and clinical evaluation. J. Clin. Endocrinol. Metab. 1997. 82(12). Р. 3944-51. doi: 10.1210/jcem.82.12.4415.
6. Baxter R.C., Martin J.L., Beniac V.A. High molecular weight insulin-like growth factor binding protein complex. Purification and properties of the acid-labile subunit from human serum. J. Biol. Chem. 1989. 264. Р. 11843-11848. PMID: 2473065.
7. Boisclair Y.R., Hurst K.R., Ueki I., Tremblay M.L., Ooi G.T. Organization and chromosomal localization of the gene encoding the mouse acid labile subunit of the insulin-like growth factor binding complex. Proc. Natl Acad. Sci. USA. 1996. 93(19). Р. 10028-33. doi: 10.1073/pnas.93.19.10028.
8. Domené H.M., Hwa V., Argente J., Wit J.M., Camacho-Hübner C., Jasper H.G. International ALS Collaborative Group. Human acid-labile subunit deficiency: clinical, endocrine and metabolic consequences. Horm. Res. 2009. 72(3). Р. 129-41. doi: 10.1159/000232486.
9. Renes J.S., van Doorn J., Hokken-Koelega A.C.S. Current Insights into the Role of the Growth Hormone-Insulin-Like Growth Factor System in Short Children Born Small for Gestational Age. Horm. Res. Paediatr. 2019. 92. Р. 15-27. doi: 10.1159/000502739.
10. Baxter R.C. Circulating levels and molecular distribution of the acid-labile (alpha) subunit of the high molecular weight insulin-like growth factor-binding protein complex. J. Clin. Endocrinol. Metab. 1997. 70. Р. 1347-1353. doi: 10.1210/jcem-70-5-1347.
11. Juul A., Moller S., Mosfeldt-Laursen E., Rasmussen M.H., Scheike T. The acid-labile subunit of human ternary insulin-like growth factor binding protein complex in serum: hepatosplanchnic release, diurnal variation, circulating concentrations in healthy subjects, and diagnostic use in patients with growth hormone deficiency. J. Clin. Endocrinol. Metab. 1998. 83. Р. 4408-4415. doi: 10.1210/jcem.83.12.5311.
12. Fofanova-Gambetti O.V., Hwa V., Kirsch S., Pihoker C., Chiu H.K. Three novel IGFALS gene mutations resulting in total ALS and severe circulating IGF-I/IGFBP-3 deficiency in children of different ethnic origins. Horm. Res. 2009. 71. Р. 100-110. doi: 10.1159/000183899.
13. van Duyvenvoorde H.A., Kempers M.J., Twickler T.B., van Doorn J., Gerver W.J. Homozygous and heterozygous expression of a novel mutation of the acid-labile subunit. Eur. J. Endocrinol. 2008. 159. Р. 113-120. doi: 10.1530/EJE-08-0081.
14. Ranke M.B. Diagnosis of growth hormone deficiency and growth hormone stimulation tests. Diagnostics of endocrine function in Children and Adolescents. Basel, Karger. 2011; ed.4. Р. 102-137.
15. Muz N.M., Bolshova O.V. Thyroid function in term small for gestational age children with growth hormone therapy. Science Rise: Medical Science. 2017. 11(19). Р. 48-51. doi: 10.15587/2519–4798.2017.116466.
16. Tanner J.M., Davies P.S. Clinical longitudinal standards for height and height velocity for north American children. J. Pediatr. 1985. 107(3). Р. 317-29. doi: 10.1016/s0022-3476(85)80501-1.
17. Boguszewski M., Rosberg S., Albertsson-Wikland K. Spontaneous 24-hour growth hormone profiles in prepubertal small for gestational age children. J. Clin. Endocrinol. Metab. 1995. 80(9). Р. 2599-606. doi: 10.1210/jcem.80.9.7673401.
18. de Waal W.J., Hokken-Koelega A.C., Stijnen T., de Muinck Keizer-Schrama S.M., Drop S.L. The Dutch Working Group on Growth Hormone. Endogenous and stimulated GH secretion, urinary GH excretion, and plasma IGF-I and IGF-II levels in prepubertal children with short stature after intrauterine growth retardation. Clin. Endocrinol. (Oxf.). 1994. 41(5). Р. 621-30. doi: 10.1111/j.1365-2265.1994.tb01828.x.
19. Trivin C., Souberbielle J.C., Aubertin G., Lawson-Body E., Adan L., Brauner R. Diagnosis of idiopathic growth hormone deficiency: contributions of data on the acid-labile subunit insulin-like growth factor (IGF)-I and-II and IGF binding protein-3. Journal of Pediatric Endocrinology and Metabolism. 2006. 19. Р. 481-489. PMID: 16759033.
20. Rotwein P. Large-scale analysis of variation in the insulin-like growth factor family in humans reveals rare disease links and common polymorphisms. J. Biol. Chem. 2017. 292(22). Р. 9252-61. doi: 10.1074/jbc.M117.783639.
21. Zaidman V.E. Analysis of acid-labile subunit and its usefulness in pediatrics. Arch. Argent. Pediatr. 2017. 115(4). Р. 391-398. doi: 10.5546/aap.2017.eng.391.
22. Işık E., Haliloglu B., van Doorn J., Demirbilek H., Scheltinga S.A., Losekoot M. Clinical and biochemical characteristics and bone mineral density of homozygous, compound heterozygous and heterozygous carriers of three novel IGFALS mutations. Eur. J. Endocrinol. 2017. 176(6). Р. 657-667. doi: 10.1530/EJE-16-0999.
23. Walenkamp M.J., Losekoot M., Wit J.M. Molecular IGF-1 and IGF-1 receptor defects: from genetics to clinical management. Endocr. Dev. 2013. 24. Р. 128-37. doi: 10.1159/000342841.
24. Iniguez G., Argandona F., Medina P., Gonzalez C. Acid-labile subunit (ALS) gene expression and protein content in human placentas: differences according to birth weight. J. Clin. Endocrinol. Metab. 2011. 96. Р. 187-191. doi: 10.1210/jc.2010-0244.
25. Li G.L., Niu L.L., Liu H.F., Guo J.Z. Structure and function of insulin-like growth factor acid-labile subunits in mammalian homologues. 2015. 37(12). Р. 1185-93. doi: 10.16288/j.yczz.15-192.
26. Barrios V., Argente J., Munoz M.T., Pozo J., Chowen J.A., Hernandez M. Diagnostic interest of acid-labile subunit measurement in relationship to other components of the IGF system in pediatric patients with growth or eating disorders. European Journal of Endocrinology. 2001. 144. Р. 245-250. doi: 10.1530/eje.0.1440245.
27. Fukuda I., Hotta M., Hizuka N., Takano K., Ishikawa Y. Decreased serum levels of acid-labile subunit in patients with anorexia nervosa. J. Clin. Endocrinol. Metab. 1999. 84. Р. 2034-2036. doi: 10.1210/jcem.84.6.5737.

/42.jpg)