Международный эндокринологический журнал Том 16, №1, 2020
Вернуться к номеру
Основные и плейотропные эффекты витамина D у пациентов с сахарным диабетом 1-го и 2-го типа
Авторы: Панькив И.В.
ВГУЗУ «Буковинский государственный медицинский университет», г. Черновцы, Украина
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
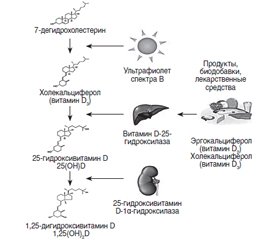
Вітамін D, початково біологічно неактивний, перетворюється в організмі на активну форму, що взаємодіє з ядерними рецепторами багатьох тканин і органів. Унаслідок цього сьогодні вітамін D визнаний D-гормоном, хоча за історичною традицією його продовжують називати вітаміном. Основна роль вітаміну D зводиться до регуляції кальцієвого гомеостазу, що багато в чому пов’язано з впливом на кишкову абсорбцію іонів кальцію і ремоделюванням (формуванням і резорбцією) кісток. Однак в останні десятиліття було виявлено ще принаймні 5 галузей фізіології, у яких вітамін D впевнено проявляє свої функції: уроджений імунітет; адаптивний імунітет; секреція інсуліну β-клітинами та інші аспекти підтримки гомеостазу глюкози; робота серця і регуляція артеріального тиску; розвиток мозку і плода. Наша стаття присвячена третій із перерахованих галузей — застосуванню вітаміну D для профілактики і лікування цукрового діабету 1-го і 2-го типу (ЦД1 і ЦД2). В експериментальних дослідженнях було продемонстровано, що вітамін D важливий для адекватної секреції інсуліну і нормалізації рівня глюкози в плазмі крові. У клінічних роботах було встановлено взаємозв’язок між низьким рівнем вітаміну D у сироватці крові і ризиком розвитку обох типів цукрового діабету. Показана ефективність вітаміну D у профілактиці та лікуванні цукрового діабету. Важливе значення має той факт, що вітамін D проявляє додаткові плейотропні ефекти, виявлені в пацієнтів із ЦД2: нормалізує артеріальний тиск, ліпіди крові, індекс маси тіла, бореться з хронічним запаленням, перешкоджає розвитку ретинопатії і діабетичної периферичної нейропатії. Призначення вітаміну в великих дозах (2000–4000 МО/день або більше) призводить до розвитку бажаного ефекту в короткострокових режимах терапії (3–6 місяців). Якщо лікар має справу з ЦД1, повинні використовуватися такі ж великі дози вітаміну.
Витамин D, будучи исходно биологически неактивным, превращается в организме в активную форму, взаимодействующую с ядерными рецепторами многих тканей и органов. Вследствие этого сегодня витамин D признан D-гормоном, хотя, следуя исторической традиции, его продолжают называть витамином. Основная роль витамина D сводится к регуляции кальциевого гомеостаза, что во многом связано с влиянием на кишечную абсорбцию ионов кальция и ремоделированием (формированием и резорбцией) костей. Однако в последние десятилетия было выявлено еще по крайней мере 5 областей физиологии, в которых витамин D уверенно проявляет свои функции: врожденный иммунитет; адаптивный иммунитет; секреция инсулина β-клетками и другие аспекты поддержания гомеостаза глюкозы; работа сердца и регуляция артериального давления; развитие мозга и плода. Наша статья посвящена третьей из перечисленных областей — применению витамина D для профилактики и лечения сахарного диабета 1-го и 2-го типа (СД1 и СД2). В экспериментальных исследованиях было продемонстрировано, что витамин D важен для адекватной секреции инсулина и нормализации уровня глюкозы в плазме крови. В клинических работах была установлена взаимосвязь между низким уровнем витамина D в сыворотке крови и риском развития обоих типов сахарного диабета. Показана эффективность витамина D в профилактике и лечении сахарного диабета. Важное значение имеет тот факт, что витамин D проявляет дополнительные плейотропные эффекты, выявленные у пациентов с СД2: нормализует артериальное давление, липиды крови, индекс массы тела, борется с хроническим воспалением, препятствует развитию ретинопатии и диабетической периферической нейропатии. Назначение витамина в больших дозах (2000–4000 МЕ/день или больше) приводит к развитию желаемого эффекта в краткосрочных режимах терапии (3–6 месяцев). Если врач имеет дело с СД1, должны использоваться такие же большие дозы витамина.
Vitamin D, being initially biologically inactive, turns into an active form in the body that interacts with the nuclear receptors of many tissues and organs. Because of this, today vitamin D is recognized as a D-hormone, although, following historical tradition, it continues to be called vitamin. The main role of vitamin D is reduced to the regulation of calcium homeostasis, which is largely due to the effect on the intestinal absorption of calcium ions and bone remodeling (formation and resorption). However, in recent decades at least 5 other areas of physiology have been identified in which vitamin D confidently shows its functions: innate immunity; adaptive immunity; insulin secretion in β-cells and other aspects of maintaining glucose homeostasis; heart function and blood pressure regulation; brain and fetal development. Our article deals with the third of these areas — the use of vitamin D for the prevention and treatment of type 1 and type 2 diabetes mellitus (DM-1 and DM-2). In experimental studies, it was demonstrated that vitamin D is important for adequate secretion of insulin and normalization of blood glucose levels. In clinical studies, a relationship has been established between low levels of vitamin D in serum and the risk of developing both types of diabetes mellitus. Vitamin D has been shown to be effective in the prevention and treatment of diabetes mellitus, although larger, longer, well-planned, randomized clinical trials are required. It is important that vitamin D exhibits additional pleiotropic effects found in patients with DM-2: it normalizes blood pressure, blood lipids, body mass index, fights chronic inflammation, and prevents the development of retinopathy and diabetic peripheral neuropathy. The administration of vitamin in high doses (2000–4000 IU/day or more) leads to the development of the desired effect in short-term treatment regimens (3–6 months). If the doctor is dealing with DM-1, the same high doses of vitamin A should be used.
вітамін D; цукровий діабет
витамин D; сахарный диабет
vitamin D; diabetes mellitus
Введение
/72.jpg)
Обоснование роли витамина D в регуляции уровня глюкозы
Механизмы действия витамина D при сахарном диабете
Эффективность назначения витамина D для профилактики и лечения сахарного диабета 1-го и 2-го типа
Плейотропные эффекты витамина D у пациентов с сахарным диабетом
Выводы
1. Шварц Г.Я. Дефицит витамина D и его фармакологическая коррекция. РМЖ. 2009. № 7. С. 477-486.
2. Komba S., Kotake-Nara E., Tsuzuki W. Simultaneous Synthesis of Vitamins D2, D4, D5, D6, and D7 from Commercially Available Phytosterol, β-Sitosterol, and Identification of Each Vitamin D by HSQC NMR. Metabolites. 2019. V. 9, № 6. Pii: E107.
3. Vitamin D: Roles, Benefits, Forms, Serum Levels, Blood Tests. https://www.foodtips.org. 2018.
4. Vitamin D. https://ods.od.nih.gov. 2019.
5. Binkley N., Ramamurthy R., Krueger D. Low vitamin D status: definition, prevalence, consequences, and correction. Endocrinol. Metab. Clin. North Am. 2010. V. 39, № 2. P. 287-301,
6. Medrano M., Carrillo-Cruz E., Montero I., Perez-Simon J.A. Vitamin D: Effect on Haematopoiesis and Immune System and Clinical Applications. Int. J. Mol. Sci. 2018. V. 19, № 9. Pii: E2663.
7. Norman A.W. From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health. Am. J. Clin. Nutr. 2008. V. 88, № 2. P. 491S-499S.
8. Chakhtoura M., Azar S.T. The role of vitamin d deficiency in the incidence, progression, and complications of type 1 diabetes mellitus. Int. J. Endocrinol. 2013. V. 2013. P. 148-673.
9. Muñoz-Garach A., García-Fontana B., Muñoz-Torres M. Vitamin D Status, Calcium Intake and Risk of Developing Type 2 Diabetes: An Unresolved Issue. Nutrients. 2019. V. 11, № 3. Pii: E642.
10. Kadowaki S., Norman A.W. Dietary vitamin D is essential for normal insulin secretion from the perfused rat pancreas. J. Clin. Invest. 1984. V. 73, № 3. P. 759-766.
11. Jeddi S., Syedmoradi L., Bagheripour F., Ghasemi A. The effects of vitamin d on insulin release from isolated islets of rats. Int. J. Endocrinol. Metab. 2015. V. 13, № 1. P. e20620.
12. Cade C., Norman A.W. Vitamin D3 improves impaired glucose tolerance and insulin secretion in the vitamin D-deficient rat in vivo. Endocrinology. 1986. V. 119, № 1. P. 84-90.
13. Cade C., Norman A.W. Rapid normalization/stimulation by 1,25-dihydroxyvitamin D3 of insulin secretion and glucose tolerance in the vitamin D-deficient rat. Endocrinology. 1987. V. 120, № 4. P. 1490-1497.
14. Zeitz U., Weber K., Soegiarto D.W. et al. Impaired insulin secretory capacity in mice lacking a functional vitamin D receptor. FASEB J. 2003. V. 17, № 3. P. 50-9. 511.
15. Bouillon R., Carmeliet G., Verlinden L. et al. Vitamin D and human health: lessons from vitamin D receptor null mice. Endocr. Rev. 2008. V. 29, № 6. P. 726-776.
16. Song Y., Wang L., Pittas A.G. et al. Blood 25-hydroxy vitamin D levels and incident type 2 diabetes: a meta-analysis of prospective studies. Diabetes Care. 2013. V. 36, № 5. P. 1422-1428.
17. Shen L., Zhuang Q.S., Ji H.F. Assessment of vitamin D levels in type 1 and type 2 diabetes patients: Results from metaanalysis. Mol. Nutr. Food Res. 2016. V. 60, № 5. P. 1059-1067.
18. Lucato P., Solmi M., Maggi S. et al. Low vitamin D levels increase the risk of type 2 diabetes in older adults: A systematic review and meta-analysis. Maturitas. 2017. V. 100. P. 8-15.
19. Liu C., Lu M., Xia X. et al. Correlation of serum vitamin D level with type 1 diabetes mellitus in children: a meta-analysis. Nutr. Hosp. 2015. V. 32, № 4. P. 1591-1594.
20. Paschou S.A., Papadopoulou-Marketou N., Chrousos G.P., Kanaka-Gantenbein C. On type 1 diabetes mellitus pathogenesis. Endocr. Connect. 2018. V. 7, № 1. P. R38-R46.
21. Harinarayan C.V. Vitamin D and diabetes mellitus. Hormones (Athens). 2014. V. 13, № 2. P. 163-181.
22. Cantorna M.T., Snyder L., Lin Y.D., Yang L. Vitamin D and 1,25(OH)2D regulation of T cells. Nutrients. 2015. V. 7, № 4. P. 3011-3021.
23. Zhang Z., Chen F., Li J. et al. 1,25(OH)2D3 suppresses proinflammatory responses by inhibiting Th1 cell differentiation and cytokine production through the JAK/STAT pathway. Am. J. Transl. Res. 2018. V. 10, № 8. P. 2737-2746.
24. Imazeki I., Matsuzaki J., Tsuji K., Nishimura T. Immunomodulating effect of vitamin D3 derivatives on type-1 cellular immunity. Biomed. Res. 2006. V. 27, № 1. P. 1-9.
25. Verma R., Singh S., Singh B. et al. Role of Active Vitamin D3 in Immunity. Indian Journal of Medical Biochemistry. 2017. V. 21, № 2. P. 166-175.
26. Gregoriou E., Mamais I., Tzanetakou I. et al. The Effects of Vitamin D Supplementation in Newly Diagnosed Type 1 Diabetes Patients: Systematic Review of Randomized Controlled Trials. Rev. Diabet. Stud. 2017. V. 14, № 2-3. P. 260-268.
27. Hu Z., Chen J., Sun X. et al. Efficacy of vitamin D supplementation on glycemic control in type 2 diabetes patients: A meta-analysis of interventional studies. Medicine (Baltimore). 2019. V. 98, № 14. P. e14970.
28. Swart K.M., Lips P., Brouwer I.A. et al. Effects of vitamin D supplementation on markers for cardiovascular disease and type 2 diabetes: an individual participant data meta-analysis of randomized controlled trials. Am. J. Clin. Nutr. 2018. V. 107, № 6. P. 1043-1053.
29. Li X., Liu Y., Zheng Y. et al. The Effect of Vitamin D Supplementation on Glycemic Control in Type 2 Diabetes Patients: A Systematic Review and Meta-Analysis. Nutrients. 2018. V. 10, № 3. Pii: E375.
30. Santos R.K.F., Brandão-Lima P.N., Tete R.M.D.D. et al. Vitamin D ratio and glycaemic control in individuals with type 2 diabetes mellitus: A systematic review. Diabetes Metab. Res. Rev. 2018. V. 34, № 3. P. e2969.
31. Wu C., Qiu S., Zhu X., Li L. Vitamin D supplementation and glycemic control in type 2 diabetes patients: A systematic review and meta-analysis. Metabolism. 2017. V. 73. P. 67-76.
32. Lee C.J., Iyer G., Liu Y. et al. The effect of vitamin D supplementation on glucose metabolism in type 2 diabetes mellitus: A systematic review and meta-analysis of intervention studies. J. Diabetes Complications. 2017. V. 31, № 7. P. 1115-1126.
33. Krul-Poel Y.H., Ter Wee M.M., Lips P., Simsek S. Management of endocrine disease: The effect of vitamin D supplementation on glycaemic control in patients with type 2 diabetes mellitus: a systematic review and meta-analysis. Eur J. Endocrinol. 2017. V. 176, № 1. P. R1-R14.
34. Nigil Haroon N., Anton A., John J., Mittal M. Effect of vitamin D supplementation on glycemic control in patients with type 2 diabetes: a systematic review of interventional studies. J. Diabetes Metab. Disord. 2015. V. 14, № 3.
35. Effect of vitamin D supplementation on fasting plasma glucose, insulin resistance and prevention of type 2 diabetes mellitus in non-diabetics: A systematic review and meta-analysis / He S., Yu S., Zhou Z. et al. Biomed. Rep. 2018. V. 8, № 5. P. 475-484.
36. Lee K.J., Lee Y.J. Effects of vitamin D on blood pressure in patients with type 2 diabetes mellitus. Int. J. Clin. Pharmacol. Ther. 2016. V. 54, № 4. P. 233-242.
37. Jafari T., Fallah A.A., Rostampour N., Mahmoodnia L. Vitamin D ameliorates systolic but not diastolic blood pressure in patients with type 2 diabetes: Results from a meta-analysis of randomized controlled trials. Int. J. Vitam. Nutr. Res. 2018. V. 88, № 1–2. P. 90-99.
38. Jafari T., Fallah A.A., Barani A. Effects of vitamin D on serum lipid profile in patients with type 2 diabetes: A meta-analysis of randomized controlled trials. Clin. Nutr. 2016. V. 35, № 6. P. 1259-1268.
39. Rafiq S., Jeppesen P.B. Body Mass Index, Vitamin D, and Type 2 Diabetes: A Systematic Review and Meta-Analysis. Nutrients. 2018. V. 10, № 9. Pii: E1182.
40. Perna S. Is Vitamin D Supplementation Useful for Weight Loss Programs? A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Medicina (Kaunas). 2019. V. 55, № 7. Pii: E368.
41. Mousa A., Naderpoor N., Teede H. et al. Vitamin D supplementation for improvement of chronic low-grade inflammation in patients with type 2 diabetes: a systematic review and meta-analysis of randomized controlled trials. Nutr. Rev. 2018. V. 76, № 5. P. 380-394.
42. Yu Y., Tian L., Xiao Y. et al. Effect of Vitamin D Supplementation on Some Inflammatory Biomarkers in Type 2 Diabetes Mellitus Subjects: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Ann. Nutr. Metab. 2018. V. 73, № 1. P. 62-73.
43. Luo B.A., Gao F., Qin L. The Association between Vitamin D Deficiency and Diabetic Retinopathy in Type 2 Diabetes: A Meta-Analysis of Observational Studies. Nutrients. 2017. V. 9, № 3. Pii: E307.
44. Juber S.M. Evaluation Of Vitamin D Supplementation In Management Of Diabetic Retinopathy. IOSR Journal of Dental and Medical Sciences. 2018. V. 17, № 3. P. 1-45.
45. Smriti J., B Chandra S., Lubhani J. A clinical study of vitamin d supplementation in diabetic retinopathy patients with type 2 diabetes mellitus. http://proceedings.aios.org. 2017.
46. Qu G.B., Wang L.L., Tang X. et al. The association between vitamin D level and diabetic peripheral neuropathy in patients with type 2 diabetes mellitus: An update systematic review and meta-analysis. J. Clin. Transl. Endocrinol. 2017. V. 9. P. 25-31.
47. Shehab D., Al-Jarallah K., Abdella N. et al. Prospective evaluation of the effect of short-term oral vitamin d supplementation on peripheral neuropathy in type 2 diabetes mellitus. Med. Princ. Pract. 2015. V. 24, № 3. P. 250-256.
48. Ghadiri-Anari A., Mozafari Z., Gholami S. et al. Dose vitamin D supplementations improve peripheral diabetic neuropathy? A before-after clinical trial. Diabetes Metab. Syndr. 2019. V. 13, № 1. P. 890-893.
49. Scott A., Chambers D., Goyder E., O’Cathain A. Socioeconomic inequalities in mortality, morbidity and diabetes management for adults with type 1 diabetes: A systematic review. PLoS One. 2017. V. 12, № 5. P. e0177-210.
50. Bertoni A.G., Krop J.S., Anderson G.F., Brancati F.L. Diabetes-related morbidity and mortality in a national sample of U.S. elders. Diabetes Care. 2002. V. 25, № 3. P. 471-475.

/74.jpg)
/75.jpg)