Журнал «Актуальная инфектология» Том 8, №2, 2020
Вернуться к номеру
Клінічна та імунологічна ефективність застосування бактеріального лізату OM-85 у дітей з інфекцією дихальних шляхів
Авторы: Сорокман Т.В., Молдован П.М., Попелюк Н.О., Колєснік Д.І., Сокольник І.С.
ВДНЗ України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
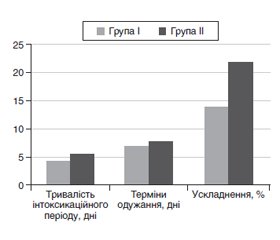
Актуальність. Згідно із сучасними епідеміологічними даними часті респіраторні інфекції посідають провідне місце в структурі дитячої захворюваності в Україні. У програмі комплексної дитячої реабілітації одним з основних заходів є імунореабілітація. Матеріали та методи. Обстежені 108 дітей віком від 1 до 3 років із діагнозом «гостра респіраторна інфекція»: I групу становили 57 дітей, які отримували стандартну терапію відповідно до чинних методичних рекомендацій, ІІ групу — 51 дитина, в лікування яких, окрім стандартної терапії, доданий препарат ОМ-85 у дозуванні 3,5 мг на добу. Визначали рівні Т-лімфоцитів, Т-хелперів, Т-супресорів, NK-клітин, В-лімфоцитів, фагоцитарне число, фагоцитарний індекс, IgG, IgA, IgM до та після застосування препарату ОМ-85. Статистичну обробку одержаних результатів проводили методом варіаційної статистики з використанням комп’ютерних програм Microsoft Office Excel. Результати. Установлено вірогідне підвищення захворюваності на гостру респіраторну інфекцію серед дітей раннього віку в зимово-весняний період та зміни імунологічної реактивності: пригнічення фагоцитарної ланки, дисбаланс у співвідношенні популяцій Т-лімфоцитів, дисімуноглобулінемія. У дітей II групи прояви загальної слабкості зникали на 0,99 доби раніше, кашель — на 1,45 доби, катаральні явища — на 1,23 доби раніше порівняно з хворими І групи (р < 0,05). Після проведеного протокольного лікування спостерігалася позитивна динаміка змін вмісту досліджуваних показників у хворих І групи, проте їх нормалізація не відмічалася. Зі свого боку, доповнення терапії препаратом ОМ-85 сприяло нормалізації фагоцитарної ланки, концентрації CD3+-, CD4+- та CD21+-лімфоцитів, відновленню рівня IgА та IgМ. Висновки. Застосування ОМ-85 у терапії респіраторних інфекцій сприяє скороченню періоду гострої інтоксикації, зниженню ймовірності бактеріальних ускладнень. Клінічна доцільність застосування бактеріальних лізатів пов’язана зі стимуляцією системних механізмів адаптивного і вродженого імунітету.
Актуальность. Согласно современным эпидемиологическим данным частые респираторные инфекции занимают ведущее место в структуре детской заболеваемости в Украине. В программе комплексной детской реабилитации одним из основных мероприятий является иммунореабилитация. Материалы и методы. Обследованы 108 детей в возрасте от 1 года до 3 лет с диагнозом «острая респираторная инфекция»: I группу составили 57 детей, получавших стандартную терапию в соответствии с действующими рекомендациями, II группу — 51 ребенок, в лечение которых, кроме стандартной терапии, добавлен препарат ОМ-85 в дозе 3,5 мг в сутки. Определяли уровни Т-лимфоцитов, Т-хелперов, Т-супрессоров, NK-клеток, В-лимфоцитов, фагоцитарное число, фагоцитарный индекс, IgG, IgA, IgM до и после применения препарата ОМ-85. Статистическую обработку полученных результатов проводили методом вариационной статистики с использованием компьютерных программ Microsoft Office Excel. Результаты. Установлены достоверное повышение заболеваемости острой респираторной инфекцией среди детей раннего возраста в зимне-весенний период и изменения иммунологической реактивности: угнетение фагоцитарного звена, дисбаланс в соотношении популяций Т-лимфоцитов, дисиммуноглобулинемия. У детей II группы проявления общей слабости исчезали на 0,99 суток раньше, кашель — на 1,45 суток, катаральные явления — на 1,23 суток раньше по сравнению с больными I группы (р < 0,05). После проведенного протокольного лечения наблюдалась положительная динамика изменений содержания изучаемых показателей у больных I группы, однако их нормализация не отмечалась. В свою очередь, дополнение терапии препаратом ОМ-85 способствовало нормализации фагоцитарного звена, концентрации CD3+-, CD4+- и CD21+-лимфоцитов, восстановлению уровня IgА и IgМ. Выводы. Применение ОМ-85 в терапии респираторных инфекций способствует сокращению периода острой интоксикации, снижению вероятности бактериальных осложнений. Клиническая целесообразность применения бактериальных лизатов связана со стимуляцией системных механизмов адаптивного и врожденного иммунитета.
Background. According to current epidemiological data, frequent respiratory infections occupy a leading position in the structure of childhood morbidity in Ukraine. The program of comprehensive children rehabilitation includes immune rehabilitation as the main measurement. Materials and methods. One-hundred and eight children aged from 1 to 3 years were diagnosed with an acute respiratory infection (АRI): the first group consisted of 57 children receiving standard therapy according to the current guidelines, the second group consisted of 51 children whose therapy was added with the drug OM-85 at a dosage of 3.5 mg per day. The levels of T-lymphocytes, T-helpers, T-suppressors, NK cells, B-lymphocytes, phagocytic index, phagocytic number, IgG, IgA, IgM were determined before and after administration of OM-85. Statistical processing of the obtained results was performed by the method of variation statistics using computer programs Microsoft Office Excel. Results. The study revealed a significant increase in the incidence of ARI among young children in winter and spring and changes in immunological reactivity such as suppression of phagocytic link, imbalance in the ratio of T-lymphocyte populations, dysimmunoglobulinemia. In children of group II, manifestations of general weakness disappeared 0.99 days earlier, cough — 1.45 days, catarrhal phenomena — 1.23 days earlier compared to the patients of group I (p < 0.05). After the protocol treatment, there was a positive dynamics in the content of the studied parameters in patients of group I, but their normalization did not occur. Besides, supplementation with OM-85 therapy contributed to the normalization of the phagocytic level, the concentration of CD3+, CD4+ and CD21+ lymphocytes, the restoration of IgA and IgM levels. Conclusions. The use of OM-85 in the treatment of respiratory infections contributes to reducing the period of acute intoxication, reducing the likelihood of bacterial complications. Clinical feasibility of bacterial lysates is associated with stimulation of systemic mechanisms of adaptive and innate immunity.
діти; гостра респіраторна інфекція
дети; острая респираторная инфекция
children; acute respiratory infection
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
1. Pechinka A.M., Dzeman M.I. Acute respiratory diseases: questions of clinical diagnostic and treatment (lecture). Ukrainian Medical Journal. 2010. 5(79). Р. 95-103.
2. Сміян О.І., Бинда Т.П., Дмітрова Є.В., Сухарєва В.А. Сучасні етіопатогенетичні та клініко-діагностичні особливості перебігу гострих респіраторних вірусних інфекцій у дітей. Журнал клінічних та експериментальних медичних досліджень. 2013. 1(3). С. 321-328.
3. European Centre for Disease Prevention and Control. Antimicrobial resistance. http://ecdc.europa.eu/en/healthtopics/antimicrobial-resistance-and-consumption/antimicrobial_resistance/Pages/index.aspx. Accessed: November 1, 2016.
4. Shen K., Yang Y., Wang T. et al. Diagnosis, treatment, and prevention of 2019 novel coronavirus infection in children: experts’ consensus statement. World J. Pediatr. 2020. https://doi.org/10.1007/s12519-020-00343-7.
5. Schaad U.B., Esposito S., Razi C.H. Diagnosis and management of recurrent respiratory tract infections in children: a practical guide. Arch. Pediatr. Infect. Dis. 2016. 4. e31039. doi:10.5812/pedinfect.31039.
6. Grief S.N. Upper respiratory infections. Prim. Care. 2013. 40. Р. 757-770. doi: 10.1016/j.pop.2013.06.004.
7. Toivonen L., Karppinen S., Schuez-Havupalo L. et al. Burden of Recurrent Respiratory Tract Infections in Children: A Prospective Cohort Study. Pediatr Infect Dis. J. 2016 Dec. 35(12). e362-e369. doi: 10.1097/INF.0000000000001304.
8. Yin J., Xu B., Zeng X., Shen K. Broncho-Vaxom in pediatric recurrent respiratory tract infections: A systematic review and meta-analysis. Int. Immunopharmacol. 2018. 54. Р. 198-209. doi: 10.1097/INF.0000000000001304.
9. Koatz A.M., Coe N.A., Ciceran A., Alter A.J. Clinical and immunological benefits of OM-85 bacterial lysate in patients with allergic rhinitis, asthma, and COPD and recurrent respiratory infections. Lung. 2016. 194. Р. 687-697. doi: 10.1007/s00408-016-9880-5.
10. Dang A.T., Pasquali C., Ludigs K., Guarda G. OM-85 is an immunomodulator of interferon-beta production and inflammasome activity. Sci. Rep. 2017. 7. 43844. doi: 10.1038/srep43844.
11. Kearney S.C., Dziekiewicz M., Feleszko W. Immunoregulatory and immunostimulatory responses of bacterial lysates in respiratory infections and asthma. Ann. Allergy Asthma Immunol. 2015. 114. Р. 364-369. doi: 10.1016/j.anai.2015.02.008.
12. Hryniewicz W. Rekomendacje postepowania w pozaszpitalnych zakazeniach ukladu oddechowego. 2016. http://www.antybiotyki. edu.pl/pdf/Rekomendacje2016.pdf. Accessed: October 8, 2018.
13. American Academy of Otolaryngology-Head and Neck Surgery. Tonsillitis. http://www.entnet.org/content/tonsillitis. Accessed: October 8, 2018.
14. Тapiainen T., Aittoniemi J., Immonen J. et al. Finnish guidelines for the treatment of laryngitis, wheezing bronchitis and bronchiolitis in children. Acta Paediatr. 2016. 105. Р. 44-49. doi: 10.1111/apa.13162.
15. Rossi G.A., Bessler W., Ballarini S. et al. Evidence that a primary antiviral stimulation of the immune response by OM-85 reduces susceptibility to a secondary respiratory bacterial infection in mice. Ital. J. Pediatr. 2018. 44. Р. 112. https://doi.org/10.1186/s13052-018-0569-7.
16. Альбицкий В.Ю., Баранов А.А. Часто болеющие дети. Клинико-социальные аспекты, пути оздоровления. Саратов: Медицина, 1986. 345 c.
17. Esposito S., Soto-Martinez M.E., Feleszko W., Jones M.H., Shen K.L., Schaad U.B. Nonspecific immunomodulators for recurrent respiratory tract infections, wheezing and asthma in children: a systematic review of mechanistic and clinical evidence. Curr. Opin. Allergy Clin. Immunol. 2018. 18(3). Р. 198-209. doi: 10.1097/ACI.0000000000000433.
18. Chen J., Zhou Y., Nie J. et al. Bacterial lysate for the prevention of chronic rhinosinusitis recurrence in children. J. Laryngol. Otol. 2017. 131. Р. 523-528. doi: 10.1017/S0022215117000524.
19. Bitar M.A., Saade R. The role of OM-85 BV (Broncho-Vaxom) in preventing recurrent acute tonsillitis in children. Sovremennaya pediatriya. 2015. 6(70). Р. 25-29. doi: 10.1016/j.ijporl.2013.01.009.
20. Dang A.T., Pasquali C., Ludigs K., Guarda G. OM-85 is an immunomodulator of interferon-β production and inflammasome activity. Sci. Rep. 2017. 7. 43844. doi: 10.1038/srep43844.
21. Luan H., Zhang Q., Wang L. et al. OM-85-BV induced the productions of IL-1 beta, IL-6, and TNF-alpha via TLR4-and TLR2-mediated ERK1/2/NF-kappa B pathway in RAW264.7 cells. J. Interfer. Cytok. Res. 2014. 34. Р. 526-536. doi: 10.1089/jir.2013.0077.
22. Калюжин О.В. ОМ-85 в профилактике/лечении респираторных инфекций и обострений хронических заболеваний легких: критерии выбора, механизмы и доказательства. Лечащий врач. 2018. 3. Р. 77-82.
23. Del-Rio-Navarro B.E., Espinosa-Rosales F.J., Flenady V., Sienra-Mongen J.J.L. Cochrane Review: Immunostimulants for preventing respiratory tract infection in children. Evidence Based Child Health. 2012. 7. Р. 629-717. doi:10.1002/ebch.1833.
24. Schaad U.B. OM-85 BV, an immunostimulant in pediatric recurrent respiratory tract infections:a systematic review. World J. Pediatr. 2010. 6(1). Р. 5-12. doi: 10.1007/s12519-010-0001-x.
25. De Benedetto F., Sevieri G. Prevention of respiratory tract infections with bacterial lysate OM-85 bronchomunal in children and adults: a state of the art. Multidisciplin Respir. Med. 2013. 8(1). Р. 33. doi: 10.1186/2049-6958-8-33.
26. Razi C.H., Harmancı K., Abacı A., Özdemir O. et al. Kattacks in preschool children. J. Allergy ClinImmunol. 2010. 126(4). Р. 763-769. doi: 10.1016/j.jaci.2010.07.
27. Manolova V., Flace A., Jeandet P., Bessler W.C., Pasquali C. Biomarkers induced by the mmunomodulatory bacterial extract OM-85: 10.4172/2155-9899.1000494.
28. Zaplatnikov A.L., Leonidovich A., Girina A.A. et al. Polyvalent mechanical bacterial lysate in children with recurrent infections of the respiratory system: using experience, efficacy and safety. Pediatriya Zhurnal im GN Speranskogo. 2016. 95. Р. 96-101.
29. Lu Y., Li Y., Xu L. et al. Bacterial lysate increases the percentage of natural killer T cells in peripheral blood and alleviates asthma in children. Pharmacology. 2015. 95. Р. 139-144. doi: 10.1159/000377683.
30. Bartkowiak-Emeryk M. The influence of polyvalent mechanical bacterial lysate on immunological parameters in asthmatic children. European Academy of Allergy and Clinical Immunology Congress 17–21 June 2017, Helsinki (Abstract 0078).
31. Simon A.K., Hollander G.A., McMichael A. Evolution of the immune system in humans from infancy to old age. Proc. Biol. Sci. 2015. 282. 20143085. doi: 10.1098/rspb.2014.3085.
32. Дронов И.А., Денисова А.Р. Бактериальный лизат ОМ-85: вопросы эффективности у детей и потенциальная роль в сдерживании роста антимикробной резистентности. Вопросы практической педиатрии. 2019. 14(1). С. 76-83. doi: 10.20953/1817-7646-2019-1-76-83.
33. Rodrigues A., Gualdi L.P., de Souza R.G. et al. Bacterial extract (OM-85) with human-equivalent doses does not inhibit the development of asthma in a murine model. Allergol. Immunopathol. 2016. 44. С. 504-511. doi: 10.1016/j.aller.2016.04.010.

/21.jpg)
/21_2.jpg)
/22.jpg)
/23.jpg)