Газета «Новости медицины и фармации» №3 (715), 2020
Вернуться к номеру
Поствірусні ускладнення: можливості профілактики із застосуванням полівалентних механічних лізатів
Авторы: Уманець Т.Р.
ДУ «Інститут педіатрії, акушерства і гінекології імені академіка О.М. Лук’янової НАМН України», м. Київ, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Розвиток бактеріальних ускладнень на тлі гострої респіраторної вірусної інфекції (ГРВІ) залишається актуальною клінічною проблемою у зв’язку з високою поширеністю вірусно-бактеріальної коінфекції і ризиком фатальних наслідків. Так, згідно з науковими даними, під час пандемій респіраторних вірусів (1957, 1968, 2009 рр.) бактеріальні ускладнення, у структурі яких переважали пневмонії, становили від 30 до 70 % [1, 2]. На жаль, незважаючи на суттєві досягнення в медицині й наявність сучасних антибактеріальних і противірусних препаратів, пневмонії залишаються основною причиною летального кінця в усьому світі [3, 4].
Окрім вторинної бактеріальної пневмонії, ГРВІ асоційована з розвитком таких ускладнень, як гострий середній отит і бактеріальний синусит, особливо в дітей. Доведений зв’язок між менінгококовим менінгітом і грипом [5–7].
Найбільше асоційовані з розвитком бактеріальної коінфекції такі віруси: грипу, парагрипу, адено- й риновіруси (НRV), респіраторно-синцитіальний вірус (RSV), метапневмовірус (hMPV) і коронавіруси (табл. 1) [1, 18].
Незважаючи на те, що хворі з коморбідними станами (хронічні неспецифічні захворювання бронхолегеневої системи, цукровий діабет, гіпертонічна хвороба, коронарні захворювання, імуноскомпрометовані пацієнти), віковими особливостями (літні люди, діти раннього й дошкільного віку) є групами ризику щодо ускладнень ГРВІ, навіть у здорових пацієнтів можуть розвиватися тяжкий респіраторний дистрес-синдром і летальний кінець від бактеріальної пневмонії на тлі вірусної інфекції, особливо грипу, що підкреслює клінічну значимість даної проблеми.
Клінічними особливостями вторинних бактеріальних ускладнень у хворих із ГРВІ є більш тяжкий і затяжний перебіг захворювання [8].
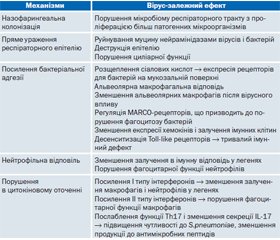
Механізми, що пояснюють розвиток бактеріальної коінфекції, зокрема пневмонії, складні й остаточно не визначені (табл. 2). Вважається, що колонізація носоглотки є першим кроком у розвитку вторинної бактеріальної пневмонії, середнього отиту й синуситу [9, 17]. Хоча S.pneumoniae, S.aureus, H.influenzae, S.pyogenes, Moraxella catarrhalis у нормі колонізують верхні дихальні шляхи, однак за певних обставин ці патогени можуть проліферувати й набувати інвазивних властивостей. З іншого боку, сама вірусна інфекція посилює колонізацію верхніх дихальних шляхів різними бактеріями, включно з S.pneumoniae і H.influenzae [14]. Так, у дітей вірус грипу асоційований із 15-кратним збільшенням титру S.рneumoniae в носоглотці [15].
Однією з гіпотез, що пояснює взаємозв’язок між вірусами й бактеріями й активно дискутується в науковій літературі, є мікробіомна. Отримані нові дані щодо існування нормальної мікробіоти дихальних шляхів зруйнували догму «стерильності респіраторного тракту», що існувала протягом тривалого часу [10]. Згідно з мікробіомною концепцією респіраторні віруси порушують резидентну мікрофлору, створюючи середовище, у якому непатогенні бактерії стають патогенними й викликають інвазивну інфекцію респіраторного тракту [11, 14, 16].
У реплікації вірусів як у верхніх, так і в нижніх дихальних шляхах центральне місце посідає респіраторний епітелій, ступінь його ураження змінюється залежно від типу вірусу й активації вродженої противірусної імунної відповіді. Респіраторні віруси викликають деструкцію бронхіального епітелію, підвищують проникність слизової оболонки дихальних шляхів, порушують мукоциліарний кліренс і нейрогенну регуляцію тонусу гладкої мускулатури бронхів, посилюють продукцію прозапальних цитокінів [12].
Порушення бар’єрної функції респіраторного епітелію сприяє бактеріальній колонізації і розвитку інфекції у хворих. Одним із механізмів посилення бактеріальної адгезії на слизових дихальних шляхів є розщеплення сіалових кислот, що розташовані на поверхні респіраторного епітелію, у результаті чого рецептори для бактеріальних лігандів стають доступними.
Вірусна інфекція порушує фагоцитарну функцію макрофагів, ранній хемотаксис моноцитів у легеневу тканину, здатність альвеолярних макрофагів залучати клітини імунної системи, що свідчить про скомпрометованість вродженої імунної відповіді, яка призводить до ослаблення антибактеріального захисту організму [13, 16]. Бактеріальна інфекція також може впливати на імунну відповідь на віруси. Експериментальні in vitro дослідження з інфікуванням клітин бронхіального епітелію H.influenzae продемонстрували підвищену здатність до зв’язування НRV-вірусу та їх реплікації, а також продукції цитокінів. Це може створювати передумови для повторних ГРВІ й поглиблювати порушення в механізмах вродженої та адаптивної імунної відповіді у вірусно-бактеріальній взаємодії.
Наявні доклінічні й клінічні дослідження демонструють раціональність застосування й ефективність імунотаргетних підходів до профілактики повторних респіраторних інфекцій і їх вторинних ускладнень, що включають специфічну імунізацію (вакцинація проти грипу й пневмококів) і неспецифічну імуномодуляцію (бактеріальні лізати) [19, 20].
Бактеріальні лізати, розроблені ще в 1970-х роках, у наш час привертають увагу науковців і практичних лікарів завдяки доказовій базі щодо ефективної профілактики респіраторних інфекцій у дітей і дорослих. Зазвичай вони є сумішшю декількох видів бактерій, які включають найбільш поширені респіраторні патогени, включно з S.aureus, Streptococcus pyogenes, Streptococcus viridans, Streptococcus pneumoniae, Klebsiella pneumoniae, Klebsiella ozaenae, Haemophilus influenzae, Diplococcus pneumoniae і Neisseria catarrhalis [20–22]. Лізис бактеріальних клітин є ключовим кроком до їх інактивації, що може здійснюватися різними методами: механічним, хімічним, ферментативним або ізолюванням бактеріальних органел. Порівняно з іншими методами лізису (наприклад, хімічним лізисом, що спричиняє фрагментацію, яка негативно впливає на імуногенність інактивованих бактеріальних клітин), механічний лізис не змінює будову антигенів і забезпечує збереження антигенних властивостей бактеріальних клітин.
Імунізація із застосуванням бактеріального лізату забезпечує активацію захисних імунних механізмів від вірусних і бактеріальних інфекцій, що знижує рівень інфікування й колонізацію респіраторними патогенами. Ефективність елімінації бактеріальних збудників пояснюється залученням системи імунної пам’яті. Загальний механізм дії бактеріальних лізатів полягає у їх взаємодії з лімфоїдною тканиною слизових оболонок (MALT), що постійно піддаються впливу патогенних антигенів. Основна роль системи MALT полягає в продукуванні IgA, які у своїй секреторній формі (sIgA) виконують захисну функцію шляхом аглютинації мікробних клітин і чинять бактеріостатичну дію, знижують адгезивні властивості ендотеліальних клітин і нейтралізують токсини [21]. Клітини пам’яті (memory B cells) продукують тривало невелику кількість антитіл, які «готові для негайного реагування», якщо є ризик повторної пенетрації ідентичного збудника. При цьому кількість інфекційного антигену, необхідна для вторинної імунної відповіді, нижча, ніж у випадку первинного контакту. Вторинна імунна відповідь швидша й сильніша порівняно з первинною відповіддю за рахунок більшої афінності антитіл до специфічних антигенів. За винятком включення в організмі пацієнта імунної пам’яті, готовність до захисту від бактеріальних збудників зазвичай підтримується тривало, однак для запобігання поступовому послабленню цих механізмів бактеріальні лізати повинні призначатись повторними курсами.
Оскільки вірусна інфекція полегшує колонізацію бактерій шляхом модифікації місцевих захисних механізмів дихальних шляхів і сприяє змінам клітинних мембран, це, з одного боку, призводить до більш легкої адгезії бактерій. З іншого боку, бактерії полегшують сприйнятливість до вірусних інфекцій шляхом протеолітичної деградації гемаглютиніну. Це формує порочне патологічне коло взаємодії бактерій і вірусів. Існуючі дослідження доводять здатність полівалентних механічних бактеріальних лізатів (ПМБЛ) розривати даний взаємозв’язок, що призводить до меншої вірулентності інфекцій [24]. Іншими дослідженнями продемонстровано вплив ПМБЛ на стимуляцію дозрівання циркулюючих і плазмоцитоїдних дендритних клітин, що беруть участь у вродженій імунній відповіді; стимуляцію природних кілерних клітин, які залучені до елімінації інфікованих вірусом клітин [25, 26].
Переваги й ефективність ПМБЛ у профілактиці й лікуванні рецидивуючих респіраторних інфекцій і їх ускладнень було підтверджено в численних клінічних дослідженнях [27–33]. Результати досліджень демонструють значний потенціал щодо зниження частоти інфекцій дихальних шляхів і частоти загострень хронічних неспецифічних захворювань легень, зменшення використання антибіотиків у хворих із рецидивними інфекціями дихальних шляхів, особливо в дітей; скорочення тривалості перебігу інфекції і високу безпеку застосування.
Ефективна імуномодуляція із застосуванням бактеріальних лізатів залежить від типу й складу препарату, способу введення, режиму дозування й дози, індивідуальної реактивності пацієнта, повторюваності інфекцій, а також впливу респіраторних патогенів [23].
Одним із препаратів, що належать до ПМБЛ і широко застосовуються в лікувальній практиці в Україні з 2009 року, є Респіброн [34–37].
Респіброн — імуномодулюючий препарат, що містить полівалентний бактеріальний лізат, отриманий шляхом механічного лізису мікробних клітин методом ультразвукового дроблення. Дана методика виробництва на відміну від інших способів лізису дозволяє відокремити великі фрагменти клітинних оболонок без їх істотних змін, зі збереженням природної антигенної структури респіраторних патогенів, що краще розпізнається імунною системою людини. Відсутність токсичних компонентів дозволяє уникнути загальної негативної реакції організму.
До складу Респіброну входить більша кількість штамів, а саме бактеріальні лізати 13 штамів найбільш поширених збудників захворювань дихальних шляхів: шість серотипів Diplococcus pneumoniae, у тому числі Streptococcus pneumoniae, Haemophilus influenzae, Klebsiella pneumoniae, Klebsiella ozaenae, Streptococcu spyogenes, Streptococcus viridans, Staphylococcus aureus, Neisseria (Moraxella) catarrhalis.
Перевагою Респіброну є сублінгвальний метод застосування, що сприяє безпосередньому контакту препарату з мукозальним відділом ротової порожнини людини. Завдяки присутності великої кількості дендритних клітин взаємодія зі слизовою оболонкою сублінгвальної зони є більш ефективним шляхом проведення імунізації. Крім того, сублінгвальний шлях прийому Респіброну дозволяє уникнути проходження лікарського засобу через шлунково-кишковий тракт і, отже, зберегти антигенну структуру препарату.
Інактивовані бактеріальні антигени, що входять до складу Респіброну, через Toll-like рецептори дендритних клітин слизової сублінгвального регіону стимулюють її дозрівання, активацію і міграцію в лімфатичні вузли й вторинні лімфоїдні органи для презентації антигенів Т-лімфоцитам. Активована дендритна клітина сприяє проліферації поліклональних клітин натуральних кілерів, що призводять до деструкції інфікованих вірусами клітин респіраторного епітелію. Дендритна клітина також секретує прозапальні цитокіни, які індукують проліферацію Т-хелперів 1-го типу й переключають В-клітини на синтез специфічних поліклональних імуноглобулінів (IgA, IgG, IgM) і секреторного IgA на поверхні слизових дихальних шляхів. Завдяки опсонізуючим імуноглобулінам відбувається фагоцитоз бактерій гранулоцитами. Секреторний IgА у високих концентраціях блокує прикріплення вірусу до клітинної стінки, а в низьких — інгібує внутрішньоклітинну реплікацію вірусу, не впливаючи на адгезію. Також секреторний IgА блокує адгезію до епітеліальних клітин бактеріальних мікроорганізмів.
Сублінгвальні таблетки Респіброн є потужним індуктором утворення імуноглобулінів слини, які виступають як перша лінія захисту.
Отже, Респіброн має подвійний механізм імуностимулюючої дії на рівні вродженої (стимуляція й дозрівання дендритних клітин, натуральних кілерів і гранулоцитів) та адаптивної імунної відповіді (специфічна стимуляція Т- і В-лімфоцитів і секреція специфічних антитіл), який реалізується на мукозальному й системному рівнях.
Респіброн виявився ефективним у комплексному лікуванні гострих респіраторних інфекцій, що вимагають призначення антибактеріальних препаратів. Результати досліджень показали, що в дітей, які отримували Респіброн у комбінації з антибактеріальною терапією, рідше відзначалися рецидиви респіраторної інфекції, швидше зникали ознаки запалення й знижувався ризик ускладнень. Клінічний ефект застосування сублінгвальних таблеток Респіброн (відсутність повторних епізодів респіраторної інфекції) зберігається до 6 місяців після закінчення курсу лікування, що обґрунтовує проведення профілактичних курсів 2 рази на рік.
Респіброн рекомендований для лікування й профілактики респіраторних інфекцій у дітей із дворічного віку й дорослих. Із профілактичною метою Респіброн призначають по 1 таблетці 1 раз на добу сублінгвально протягом 10 днів із 20-денною перервою і повторюють трьома курсами. Для дітей раннього віку рекомендовано подрібнити таблетку, змочити кип’яченою водою і приймати пастообразну суміш сублінгвально. Зручність застосування (однократний прийом сублінгвально) і нетривалий курс (10 днів) сприяють високій прихильності до лікування як з боку дітей, так і з боку дорослих.
Власний багаторічний досвід застосування Респіброну в дітей з алергічними захворюваннями, які часто хворіють на гострі респіраторні інфекції, свідчить про можливість контролю вірус-індукованих загострень і їх ускладнень, а також зменшення частоти епізодів ГРВІ в епідемічний сезон.
Список литературы
Список літератури знаходиться в редакції

/12_u.jpg)