Вступ
Неалкогольна жирова хвороба печінки (НАЖХП) охоплює спектр захворювань, тісно пов’язаних із метаболічними факторами ризику [1]. На сьогодні доведено спільність патогенетичних механізмів для НАЖХП та метаболічного синдрому, стає очевидним їх зв’язок із цукровим діабетом (ЦД) 2-го типу, серцево-судинними захворюваннями, ожирінням тощо. Зайва вага та інсулінорезистентність (ІР) визнані основними факторами ризику виникнення НАЖХП. Однак не тільки переїдання, але й нездоровий раціон харчування, наприклад підвищене споживання продуктів, багатих на цукор і жири, недостатня фізична активність та генетична схильність, а також зміни мікробіоти кишечника та бар’єрної функції кишечника вважаються провідними факторами у розвитку НАЖХП [2].
Результати останніх досліджень указують на те, що розвиток НАЖХП пов’язаний із значними змінами у складі мікробіоти кишечника, а також підвищенням рівня бактеріальних ендотоксинів [3]. Є декілька паралельних гіпотез щодо патогенезу НАЖХП. Ожиріння разом із дієтичними звичками та факторами навколишнього середовища може призвести до підвищення рівня вільних жирних кислот у сироватці крові й до зростання рівня холестерину, розвитку ІР, проліферації адипоцитів та дисфункції кишкового мікробіоценозу. Посилене надходження вільних жирних кислот у печінку разом із зміненою активністю кишкової мікробіоми призводить до накопичення тригліцеридів і «токсичних» рівнів вільних жирних кислот, вільного холестерину та інших ліпідних метаболітів, які викликають дисфункцію мітохондрій, оксидативний стрес, утворення активних форм кисню та стрес ендоплазматичного ретикулуму з формуванням запалення та фіброзу печінки [4, 5].
Роль мікробіоти кишечника не обмежується дією на шлунково-кишковий тракт, вона може мати значний вплив на функцію різних систем та органів і бути причетною до формування багатьох захворювань. Мікробний дисбактеріоз сильно асоціюється з метаболічними порушеннями (ожиріння, цукровий діабет) [3], із серцево-судинними захворюваннями, синдромом подразненої товстої кишки, целіакією, неспецифічними запальними захворюваннями кишечника, нейропсихіатричними захворюваннями, такими як шизофренія, аутизм [6], тривожні розлади, депресія [7].
Експериментальні дослідження показали, що зміна нормального складу мікробіоти кишечника може спричинити порушення поведінки та пригнічувати функції мозку, зумовити відхилення від норми в нейрохімічних показниках. У роботі С. Yang та співавт. (2017) доведено, що Bifidobacteria кишечника може забезпечити стійкість до хронічного стресу, а пероральний прийом Bifidobacteria сприяє полегшенню симптомів депресії. Отримані дані підтверджують зв’язок між кишечником та мозком, де мікробіота кишки є важливим дистанційним посередником функції мозку, який впливає на розвиток та терапевтичні наслідки захворювань внутрішніх органів [8].
Мікроструктура і когнітивні функції мозку суттєво асоціюються з конкретним профілем мікробіотів кишечника. Нормальне функціонування мікробіоти кишечника є необхідним для підтримання динамічної регуляції та контролю таких функцій головного мозку, як тривожність та соціальна поведінка, а також для нейрогенезу та нормальної серотонінергічної нейротрансмісії центральної нервової системи при стресі [9].
Отже, в основі патогенезу багатьох хронічних захворювань внутрішніх органів, а також нейропсихіатричних розладів лежать зміни в кишковому мікробіоценозі, що дозволяє припустити вплив мікробіоти кишечника на виникнення симптомів тривоги та депресії при метаболічно обумовлених захворюваннях. Нормалізація мікробного складу товстої кишки може лежати в основі профілактики виникнення та/або прогресування симптомів тривоги та депресії, у тому числі й у хворих на НАЖХП.
Мета: визначити ефективність комплексної терапії з використанням препарату Bifidobacterium infantis 35624 на динаміку проявів депресії у хворих на НАЖХП та ЦД 2-го типу.
Матеріали та методи
На клінічній базі кафедри пропедевтики внутрішніх хвороб медичного факультету ДВНЗ «Ужгородський національний університет» (гастроентерологічне та ендокринологічне відділення ЗОКЛ ім. А. Новака) за 2016–2019 рр. обстежено 56 хворих на НАЖХП та ЦД 2-го типу. Серед обстежених було 32 чоловіки (57,1 %), жінок — 24 (42,9 %). Середній вік становив (49,7 ± 5,6) року. У контрольну групу ввійшли 20 практично здорових осіб (12 чоловіків (60,0 %), 8 жінок (40,0 %)). Середній вік становив (47,6 ± 5,8) року.
Усі дослідження були виконані за згодою пацієнтів (від усіх хворих було отримано письмову згоду щодо проведення відповідних діагностично-лікувальних заходів), а методика їх проведення відповідала Гельсінській декларації прав людини 1975 р. та її перегляду 1983 р., Конвенції Ради Європи про права людини і біомедицину та законодавству України.
Усі обстежені пацієнти підлягали дослідженню за загальноклінічними, антропометричними, інструментальними та лабораторними методами. Для верифікації діагнозу звертали увагу на характер скарг, анамнез захворювання. При антропометричному дослідженні визначали зріст, масу тіла, окружність талії, а також розраховували індекс маси тіла (ІМТ). Згідно з рекомендаціями Всесвітньої організації охорони здоров’я, хворих розподілили залежно від показника ІМT, при якому ІМT 16,0 кг/м2 і менше відповідав вираженому дефіцитові маси тіла; 16,0–18,5 — недостатній масі тіла; 18,0–24,9 — нормальній масі; 25,0–29,9 — надлишковій масі; 30,0–34,9 — ожирінню І ступеня; 35,0–39,9 — ожирінню ІІ ступеня; 40,0 і більше — ожирінню ІІІ ступеня [10].
Усім хворим виконано ультразвукове дослідження органів черевної порожнини за загальноприйнятою методикою. У сироватці крові проведено стандартні загальні та біохімічні дослідження для визначення функціонального стану печінки, показників ліпідного обміну, вуглеводного обміну (глюкози, інсуліну, глікозильованого гемоглобіну (HbA1c, %)).
Діагноз НАЖХП встановили згідно з критеріями уніфікованого клінічного протоколу (Наказ МОЗ України від 06.11.2014 р. № 826) та клінічними рекомендаціями EASL-EASD-EASO щодо діагностики та лікування НАЖХП [11]. Ступінь ураження печінки розраховано з використанням сурогатних маркерів фіброзу за допомогою онлайн-калькуляторів NAFLD fibrosis score (NFS), Fibrosis 4 calculator (FIB-4), а також фібротесту.
Діагноз ЦД 2-го типу встановлено згідно з рекомендаціями IDF (2005 р.), а також із урахуванням критеріїв уніфікованого клінічного протоколу (Наказ МОЗ України від 21.12.2012 № 1118) [12]. Ступінь тяжкості ЦД 2-го типу оцінювали за рівнем HbA1c (норма — до 6,0 %).
Дослідження якісного й кількісного складу мікрофлори товстої кишки (ТК) до та після лікування проводили методом посіву десятикратних розведень (10–1–10–9) фекалій на стандартний набір cелективних і диференційно-діагностичних поживних середовищ для виділення аеробних й анаеробних мікроорганізмів. Ступінь дисбіозу ТК оцінювали за класифікацією І.Б. Куваєвої, К.С. Ладодо (1991).
Порушення функції центральної нервової системи (ЦНС) визначали в обстежених хворих до та після лікування (через 6 місяців) за допомогою таких тестів:
1. Шкала самооцінки Ч.Д. Спілбергера (1972) у модифікації Ю.Л. Ханіна (1976) — дозволяє шляхом самооцінки визначити рівень тривожності на певний момент (реактивна тривожність як стан) та особистої тривожності (як сталої характеристики людини). Реактивна тривожність характеризується напруженням, нервозністю, неспокоєм. Особиста тривожність характеризується схильністю сприймати велике коло ситуацій станом тривоги. Результати оцінюються так: до 30 — низька, 31–45 — помірна, 46 і більше — висока тривожність.
2. Шкала депресії Бека (BDI). Цей опитувальник складається з 21 групи тверджень. Хворим пропонують прочитати уважно й обвести номер (0, 1, 2 або 3) твердження, що найкраще відображає їх самопочуття протягом останнього тижня, включно з поточним днем. Дозволяє охарактеризувати емоційну сферу пацієнтів.
3. Методика визначення рівня депресії, розроблена V. Zung (1965). Використовується для виявлення й кількісної оцінки вираженості депресивних розладів при різних соматичних захворюваннях. Нормативні показники шкали в здорових осіб становлять менше 50 балів, 50–59 балів характеризують наявність мінімальної, легкої депресії, 60–69 балів — наявність помірної депресії, 70 балів і вище вказують на тяжку, виражену депресію.
4. Торонтська алекситимічна шкала призначена для оцінки трьох основних якостей алекситимії:
— труднощі у визначенні та описі власних переживань;
— складність у проведенні розбіжностей між почуттями й тілесними відчуттями;
— сфокусованість більшою мірою на зовнішніх подіях, ніж на внутрішніх переживаннях.
За даними авторів методики, алекситимічний тип особистості отримує 74 бали й вище, неалекситимічний — 62 бали й нижче.
Надання медичної допомоги хворим на НАЖХП та ЦД 2-го типу проводили згідно з клінічними протоколами лікування МОЗ України та відповідно до локальних протоколів. Для контролю рівня глюкози в сироватці крові обстеженим пацієнтам призначали пероральні цукрознижувальні препарати (метформін) на фоні дієтичного харчування та модифікації способу життя, при потребі проводили інсулінотерапію. Усім обстеженим, хворим на НАЖХП та ЦД 2-го типу, призначено препарат урсодезоксихолевої кислоти (УДХК) урсофальк (фірми «Др. Фальк Фарма ГмБХ», Німеччина) із розрахунку 20 мг/кг маси тіла. Лікування УДХК продовжували протягом 6 місяців.
Хворих на НАЖХП та ЦД 2-го типу розподілено на дві клінічні групи — залежно від методу корекції дисбіозу товстої кишки (ДТК) — проведеного лікування, а саме:
— до І групи ввійшли 26 хворих, яким призначено комбінований пробіотик опефера (фірми World Medicine Europe) по 2 капсули 3 рази на добу після прийому їжі протягом 4 тижнів. Опефера — пробіотик, до складу якого входять живі ліофілізовані бактерії (Lactobacillus rhamnosus, Lactobacillus plantarum, Streptococcus thermophilus, Lactobacillus acidophilus, Bifidobacterium spp. (Bifidobacterium bifidum, Bifidobacterium longum, Bifidobacterium infantis), Saccharomyces boulardii, сухий екстракт квітів ромашки аптечної, інулін. Як підтримуючу терапію після курсу лікування з використанням опефери хворим призначено препарат лактулози медулак (фірми World Medicine Europe) по 15 мл 3 рази на добу протягом 5 місяців;
— до ІІ групи ввійшли 30 хворих, яким для лікування ДТК додатково призначено препарат Bifidobacterium infantis (B.infantis) 35624 альфлорекс (фірми Biocodex) по 1 капсулі 1 раз на добу. Лікування препаратом B.іnfantis продовжували до 6 місяців.
Наукове дослідження виконане в рамках НДР № 851 «Механізми формування ускладнень при захворюваннях печінки та підшлункової залози, методи їх лікування та профілактики», номер державної реєстрації: 0115U001103, а також загальнокафедральної теми кафедри пропедевтики внутрішніх хвороб ДВНЗ «Ужгородський національний університет».
Аналіз і обробку результатів обстеження хворих проведено за допомогою комп’ютерної програми Statistics for Windows v.7.0 (StatSoft Inc., USA) з використанням параметричних та непараметричних методів оцінки отриманих результатів.
Результати
Застосування лабораторно-інструментальних методів обстеження до лікування дало змогу встановити ураження печінки в усіх 56 обстежених хворих, що відповідало критеріям неалкогольного стеатогепатиту (НАСГ).
У всіх обстежених нами хворих встановлено ЦД 2-го типу переважно легкого та середнього ступеня тяжкості, що характеризувалося відсутністю гіпоглікемічних реакцій, рівнем глюкози в крові натще до 8,5 ммоль/л, після їжі — до 10 ммоль/л, HbA1c не перевищував 7 %.
Як бачимо на рис. 1 і 2, в обстежених хворих як І, так і ІІ групи до лікування частіше діагностовані ожиріння І ступеня (у 38,5 % хворих І групи та у 40,0 % хворих ІІ групи) та надмірна вага (у 34,6 % хворих І групи та у 33,3 % хворих ІІ групи). Проведена комплексна терапія у хворих обох груп позитивно вплинула на показники вгодованості, що проявлялося перерозподілом обстежених за результатами ІМТ, а саме: після лікування збільшилася кількість осіб з надмірною вагою та нормальною масою тіла.
Аналіз мікробіологічного дослідження фекалій в обстежених хворих обох груп до лікування вказує на виражені зміни в кількісному і якісному складі мікрофлори ТК. У всіх обстежених пацієнтів з НАСГ та ЦД 2-го типу визначали зниження рівня представників анаеробної флори: біфідобактерій нижче 107, а також лактобактерій нижче 106, що супроводжувалось підвищенням кількості представників патогенної мікрофлори в товстій кишці. Результати наведені у табл. 1 та 2.
/19.jpg)
Після 6-місячної комплексної терапії з використанням мультипробіотика з переходом на прийом лактулози (у хворих І групи) та препарату B.infantis 35624 (у хворих ІІ групи) виявлено позитивну динаміку в кількісному та якісному складі мікрофлори товстої кишки, а саме нормалізацію кількості Bifidobacterium та Lactobacillus у всіх обстежуваних хворих обох груп, що супроводжувалося зниженням кількості Proteus, Candida, Clostridium, Klebsiella та патогенних стафілококів (табл. 1, 2). Повторне мікробіологічне дослідження калу в обстежених хворих виконано через 1 місяць після припинення комплексного лікування, а також через 3 місяці.
/20.jpg)
При аналізі ефективності призначених пробіотиків встановлено цікаві відмінності в групах пацієнтів. У хворих І групи (місячний курс лікування з використанням мультипробіотика та подальшим прийомом лактулози (5 місяців)) позитивний ефект при повторному бактерологічному дослідженні через 1 місяць після припинення лікування не відрізнявся від такого у пацієнтів ІІ групи, що отримували препарат B.infantis 35624. Повторне мікробіологічне дослідження фекалій (через 3 місяці після припинення лікування) у хворих на НАСГ та ЦД 2-го типу дає змогу встановити, що системний прийом B.infantis 35624 призводить до стійкої нормалізації мікрофлори ТК, тоді як такого ефекту у хворих І групи не встановлено.
При аналізі ступеня тяжкості дисбіотичних змін до лікування у хворих обох груп діагностували переважно дисбіоз II ступеня (у 53,8 і 53,3 % хворих відповідно) (рис. 3, 4).
Перерозподіл обстежених хворих після закінчення комплексного лікування (через 3 місяці) за ступенями вираженості дисбіотичних змін ТК наведено на рис. 3, 4. При цьому в 50,0 % хворих на фоні лікування з використанням препарату B.infantis 35624 діагностовано нормалізацію кількісного і якісного складу мікрофлори ТК.
Нами проаналізовано стан емоційної сфери та її вираженість у хворих на НАЖХП та ЦД 2-го типу до та після лікування з використанням нейропсихометричного тестування.
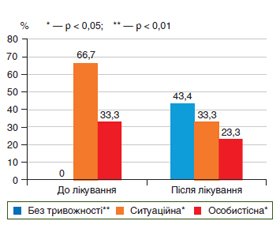
Шкала самооцінки Ч.Д. Спілбергера та Ю.Л. Ханіна показала виражену ситуаційну тривожність в обстежених пацієнтів. Показник реактивної тривожності, що залежить від життєвої ситуації пацієнта, значно покращився в ІІ групі (прийом препарату B.infantis 35624). До лікування показник у хворих ІІ групи становив (45,1 ± 12,2) бала, а після лікування зменшився до (22,1 ± 7,7) бала. У І групі обстежених цей показник змінився з (44,4 ± 11,5) бала лише до (39,8 ± 10,2) бала (рис. 5, 6).
При дослідженні емоційної сфери за результатами BDI виявили наявність помірної депресії та легкої депресії, ніж тривожності, у хворих з НАСГ та ЦД 2-го типу до лікування (рис. 7, 8). При аналізі результатів тестування за BDI виявлена більша частка відповідей на питання, що характеризують когнітивні, апатичні та соматичні прояви депресії. Як показав цей тест, більш ефективним щодо проявів депресії стало лікування з використанням B.infantis 35624.
У переважної більшості хворих на НАЖХП та ЦД 2-го типу мають місце прояви легкої або маскованої депресії за шкалою Zung (рис. 9, 10) на фоні вегетативної лабільності. Ці симптоми ефективно зменшується на фоні курсового прийому пробіотичного препарату B.іnfantis.
Алекситимія — нездатність хворого називати емоції, пережиті ним самим або іншими людьми, тобто вербалізувати їх, має місце у 60,0–61,5 % хворих на НАЖХП та ЦД 2-го типу. На фоні курсового прийому B.іnfantis алекситимія зменшується на 34,3 %.
Отже, у хворих на НАЖХП (НАСГ) та ЦД 2-го типу соматична патологія супроводжується вираженими проявами депресії, тривожності, невпевненості у собі. При цьому ці зміни більш виражені у пацієнтів з порушенням ІМТ.
Обговорення
Проведені нами дослідження свідчать про виражені зміни в кількісному та якісному складі мікрофлори товстої кишки у хворих на НАЖХП та ЦД 2-го типу. Окрім того, у цих хворих із поєднаною патологією часто визначаються легкі та помірно виражені прояви депресії, тривожності, що може вплинути на ефективність лікування й вимагає корекції.
Результати все більшої кількості досліджень свідчать про важливу роль кишкових бактерій у патогенезі НАЖХП [3, 13]. Зміни мікробного складу пов’язані зі стеатозом, НАСГ та фіброзом, також доказані асоціації між мікробіологічними продуктами кишечника та НАЖХП, що підтверджує гіпотезу про взаємозв’язок кишечника та печінки і навпаки (Panasevic M.R. et al., 2017) [14].
Протягом останніх кількох років усе більше утверджується усвідомлення важливості осі «кишечник — мозок» завдяки доказам, що базуються на розумінні нових зв’язків між імунною, ендокринною та нервовою системами [6]. Встановлено, що кишечник та мозок тісно пов’язані між собою у вісь «кишечник — мозок» кількома двоспрямованими сигнальними шляхами. Мікроструктура та когнітивні функції мозку суттєво асоціюються з конкретним профілем мікробіотів кишечника. Нормальне функціонування мікробіоти кишечника є необхідним для підтримання динамічної регуляції та контролю таких функцій головного мозку, як тривожність та соціальна поведінка, а також для нейрогенезу та нормальної серотонінергічної нейротрансмісії ЦНС при стресі та відповіді на антидепресанти [15].
Отже, як указують і результати наших досліджень, кишковий дисбіоз асоціюється з вираженими порушеннями психоневрологічної симптоматики, що особливо виражене у хворих з поєднаною патологією (НАЖХП, ЦД 2-го типу, ожиріння).
D. Rodrigues-Amorim та співавт. (2017) вказують, що дисбактеріоз кишечника може активувати Th17-клітини, викликаючи запалення шлунково-кишкового тракту, а також відіграє важливу роль у формуванні нейропсихіатричних захворювань [7].
Стає очевидним факт, що нормалізація кишкової мікробіоти може бути передумовою нормалізації тривожних і депресивних розладів у хворих з різними соматичними захворюваннями, що супроводжуються дисбіозом кишечника. L. Desbonnet та співавт. (2010) на тваринній моделі продемонстрували антидепресивні властивості саме B.infantis 35624. Відомо, що більшість антидепресантів діють через збільшення рівня серотоніну, і, як доведено, мікробіота може синтезувати серотонін і цим самим впливати на його рівні у мозку. Пероральний прийом Bifidobacterium infantis збільшив рівень попередника серотоніну — триптофану — в плазмі щурів, що вказує на те, що штам може мати потенціал як антидепресант [16, 17].
Отже, вплив B.infantis на серотонін разом із проявами антидепресивних властивостей може становити особливий інтерес у лікуванні захворювань, патогенез яких пов’язаний із дисбіотичними змінами ТК, а також які мають перебіг із вираженими розладами психоневрологічної симптоматики.
Результати наших досліджень указують на значний позитивний віддалений ефект на мікрофлору ТК курсового прийому B.infantis 35624 у хворих на НАЖХП (НАСГ) та ЦД 2-го типу. Продемонстровано значне зменшення вираженості депресії, тривожності на фоні нормалізації мікробного складу товстої кишки при тривалому прийомі B.infantis 35624 у хворих на НАЖХП та ЦД 2-го типу.
Необхідне подальше вивчення оцінки ефективності призначеної схеми терапії у хворих з поєднаною патологією, а також дослідження, спрямовані на визначення можливих зв’язків між певними мікробними асоціаціями та порушенням нейровегетативного статусу у хворих на НАЖХП, ЦД 2-го типу та ожиріння.
Висновки
1. У хворих на НАЖХП та ЦД 2-го типу встановлено дисбіоз кишечника переважно ІІ (у 53,3–53,8 % обстежених) та І ступенів (30,0–30,8 % обстежених).
2. У хворих на НАЖХП та ЦД 2-го типу визначаються тривожні розлади, помірно виражені прояви депресії за шкалою Спілбергера — Ханіна, BDI, шкалою Zung та Торонтською шкалою, а це вимагає корекції.
3. Курсовий прийом B.infantis 35624 хворими на НАЖХП та ЦД 2-го типу є ефективним засобом не тільки для корекції дисбіозу ТК, а також і зменшення проявів депресії та тривожних станів у таких пацієнтів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про внесок кожного автора: Сірчак Є.С. — концепція і дизайн дослідження, аналіз отриманих даних; Грига В.І. — анкетування хворих, збирання й обробка матеріалів, написання тексту; Петричко О.І. — проведення анкетування хворих; Пічкар Й.І. — підбір тематичних хворих.
Список литературы
1. Степанов Ю.М., Недзвецька Н.В., Ягмур В.Б., Кленіна І.А. Неалкогольна жирова хвороба печінки: особливості метаболічних змін на різних етапах розвитку хвороби. Гастроентерологія. 2018. Т. 52. № 1. С. 13-18.
2. Brandt А., Hernández-Arriaga А., Kehm R. et al. Metformin attenuates the onset of non-alcoholic fatty liver disease and affects intestinal microbiota and barrier in small intestine. Scientific Reports. 2019. № 9. Р. 6668. https://doi.org/10.1038/s41598-019-43228-0.
3. Boursieres J., Mueller O., Barret M. et al. The Severity of Nonalcoholic Fatty Liver Disease Is Associated With Gut Dysbiosis and Shift in the Metabolic Function of the Gut Microbiota. Hepatology. 2016. № 3(63). Р. 764-775.
4. Buzzetti E., Pinzani M., Tsochatzis E.A. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD). Metabolism. 2016. № 65. Р. 1038-1048.
5. Satapati S., Sunny N.E., Kucejova B. et al. Elevated TCA cycle function in the pathology of diet-induced hepatic insulin resistance and fatty liver. Journal of Lipid Research. 2012. Vol. 53(6). P. 1080-1092.
6. Morris G., Berk M., Carvalho A. et al. The Role of the Microbial Metabolites Including Tryptophan Catabolites and Short Chain Fatty Acids in the Pathophysiology of Immune-Inflammatory and Neuroimmune Disease. Mol. Neurobiol. 2017. № 54(6). Р. 4432-4451.
7. Rodrigues-Amorim D., Rivera-Baltanás T., Regueiro B. et al. The role of the gut microbiota in schizophrenia: Current and future perspectives. The World Journal of Biological Psychiatry. 2018. № 21. Р. 1-15.
8. Zhan G., Yang N., Li S. et al. Abnormal gut microbiota composition contributes to cognitive dysfunction in SAMP8 mice. AGING. 2018. Vol. 10. № 6. P. 1257-1267.
9. Lozupone M., Seripa D., Stella E. et al. Innovative biomarkers in psychiatric disorders: a major clinical challenge in psychiatry. Expert Review of Proteomics. 2017. Vol. 14. № 9. Р. 809-824.
10. WHO: Global Database on Body Mass Index. Available from: http://apps.who.int/bmi/index.jsp?introPage=intro_3.html.
11. European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD) and European Association for the Study of Obesity (EASO) EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. Journal of Hepatology. 2016. № 64. Р. 1388-1402. doi: 10.1016/j.jhep.2015.11.004.
12. Ахутина Т.В., Меликян З.А. Нейропсихологическое тестирование: обзор современных тенденций. К 110-летию со дня рождения А.Р. Лурия. Клиническая и специальная психология. 2012. № 2. С. 1-20. www.psyjournals.ru/psyclin.
13. Van Best N., Jansen P.L., Rensen S.S. The gut microbiota of nonalcoholic fatty liver disease: current methods and their interpretation. Hepatol. Int. 2015. № 9. Р. 406-415.
14. Panasevich M.R., Peppler W.T., Oerther D.B. et al. Microbiome and NAFLD: potential influence of aerobic fitness and lifestyle modification. Physiol. Genomics. 2017. № 49. Р. 385-399.
15. Caroline Р., Brietzke E., Rosenblat J.D. et al. Probiotics for the treatment of depressive symptoms: An anti-inflammatory mechanism? Brain, Behavior, and Immunity. 2018. Jul 18. S0889-1591(18)30304-0.
16. Desbonnet L., Garrett L., Clarke G. et al. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience. 2010. № 170(4). Р. 1179-1188.
17. O’Mahony L., McCarthy J., Kelly P. et al. Lactobacillus and bifidobacterium in irritable bowel syndrome: symptom responses and relationship to cytokine profiles. Gastroenterology. 2005. № 128(3). Р. 541-551.

/19.jpg)
/20.jpg)
/21.jpg)
/22.jpg)
/23.jpg)