Международный эндокринологический журнал Том 16, №2, 2020
Вернуться к номеру
Зв’язок вторинного гіперпаратиреозу та коморбідних станів у постраждалих внаслідок аварії на Чорнобильській АЕС
Авторы: Муравйова І.М., Чикалова І.Г., Афанасьєв Д.Є., Копилова О.В., Камінський О.В., Ульянченко І.В., Рожківська Л.В., Тепла Е.В., Самойлов О.О.
ДУ «Національний науковий центр радіаційної медицини НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
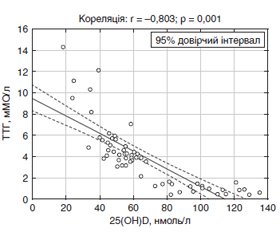
Актуальність. Вкрай актуальною проблемою радіаційної медицини є ендокринна коморбідність — ураження під променевим впливом декількох органів внутрішньої секреції. Мета дослідження: встановлення зв’язку між вторинним гіперпаратиреозом і захворюваннями щитоподібної та підшлункової залоз у постраждалих внаслідок аварії на Чорнобильській АЕС у віддалений період. Матеріали та методи. Методом сліпої вибірки відібрано 60 осіб, які перебували у відділенні радіаційної ендокринології протягом 2019 року. Серед них було 40 осіб, постраждалих внаслідок аварії на Чорнобильській АЕС (група 1), та 20 осіб, які не зазнали дії радіаційного чинника (група 2). Середній вік обстежених становив 60,2 ± 9,8 року. Підставою для госпіталізації була декомпенсація цукрового діабету 2-го типу (48,3 %) та гіпотиреозу (46,7 %). Методи дослідження: клінічні, інструментальні, лабораторні, статистичні. Результати. Частота підвищеного ризику дефіциту вітаміну D та гіперпаратиреозу за результатами клінічного опитування у постраждалих внаслідок аварії на Чорнобильській АЕС була дещо вищою, ніж у неопромінених осіб (81,08 та 78,12 %; χ2 = 0,257, р = 0,612; 31,12 та 28,08 %; χ2 = 0,462, р = 0,319 відповідно). За допомогою багатофакторного аналізу була отримана вірогідна модель, яка підтверджує залежність між підвищенням рівня паратгормону та ранніх субклінічних ознак пошкодження органів-мішеней (F = 4,294; p = 0,042), що доводить доцільність використання клінічних опитувальників. Встановлений вірогідний позитивний зв’язок між рівнем вітаміну D та вільного тироксину (r = 0,729; р = 0,001), негативний — з рівнем тиреотропного гормону (r = –0,803; р = 0,001). У постраждалих внаслідок аварії на Чорнобильській АЕС з цукровим діабетом 2-го типу зниження концентрації вітаміну D корелює зі збільшенням тривалості терапії метформіном (r = –0,421; р = 0,001), індексом маси тіла (r = –0,787; р = 0,001). Рівень паратгормону, навпаки, збільшується з тривалістю цукрового діабету 2-го типу та підвищенням кліренсу креатиніну (r = 0,724; р = 0,001 та r = 0,799; р = 0,001). Висновки. Недостатність вітаміну D негативно впливає на перебіг коморбідних станів (цукрового діабету 2-го типу та гіпотиреозу) та надлишкову продукцію паратгормону.
Актуальность. Крайне актуальной проблемой радиационной медицины является эндокринная коморбидность — поражение под лучевым воздействием нескольких органов внутренней секреции. Цель исследования: установление связи между вторичным гиперпаратиреозом и заболеваниями щитовидной и поджелудочной желез у пострадавших вследствие аварии на Чернобыльской АЭС в отдаленный период. Материалы и методы. Методом слепой выборки отобрано 60 лиц, которые находились в отделении радиационной эндокринологии на протяжении 2019 года. Среди них было 40 лиц, пострадавших вследствие аварии на Чернобыльской АЭС (группа 1), и 20 лиц, которые не подверглись воздействию радиационного фактора (группа 2). Средний возраст обследуемых составлял 60,2 ± 9,8 года. Основанием для госпитализации была декомпенсация сахарного диабета 2-го типа (48,3 %) и гипотиреоза (46,7 %). Методы исследования: клинические, инструментальные, лабораторные, статистические. Результаты. Частота повышенного риска дефицита витамина D и гиперпаратиреоза по результатам клинического опросника у пострадавших вследствие аварии на Чернобыльской АЭС была несколько выше, чем у необлученных лиц (81,08 и 78,12 %; χ2 = 0,257, р = 0,612; 31,12 и 28,08 %; χ2 = 0,462, р = 0,319 соответственно). При помощи многофакторного анализа была получена достоверная модель, подтверждающая зависимость между повышением уровня паратгормона и ранних субклинических признаков повреждения органов-мишеней (F = 4,294; p = 0,042), что доказывает целесообразность использования клинических опросников. Установлена достоверная положительная связь между уровнем витамина D и свободного тироксина (r = 0,729; р = 0,001), отрицательная — с уровнем тиреотропного гормона (r = –0,803; р = 0,001). У пострадавших вследствие аварии на Чернобыльской АЭС с сахарным диабетом 2-го типа снижение концентрации витамина D коррелирует с увеличением длительности терапии метформином (r = –0,421; р=0,001), индексом массы тела (r = –0,787; р = 0,001). Уровень паратгормона, наоборот, увеличивается с длительностью заболевания сахарным диабетом 2-го типа и повышением клиренса креатинина (r = 0,724; р = 0,001 и r = 0,799; р = 0,001). Выводы. Недостаточность витамина D негативно влияет на течение коморбидных состояний (сахарного диабета 2-го типа и гипотиреоза) и избыточную продукцию паратгормона.
Background. Endocrine comorbidity, a concomitant radiation injury of several endocrine glands, is a topical issue in radiation medicine. The purpose of the study was to establish a correlation of secondary hyperparathyroidism with thyroid and pancreatic disorders among the Chornobyl nuclear power plant (NPP) accident survivors. Materials and methods. A blind sample (n = 60) of subjects treated at the radiation endocrinology department in 2019 was selected for the study. Study sample included the Chornobyl NPP accident survivors (group 1, n = 40) and patients not exposed to radiation (group 2, n = 20). The average age of people was 60.2 ± 9.8 years. Decompensation of type 2 diabetes was the most common cause for hospital admission (48.3 %), decompensation of hypothyroidism was in second place (46.7 %). Research methods: clinical, instrumental, laboratory, statistical. Results. Incidence of the increased risk of vitamin D deficiency and excessive parathyroid hormone production in the Chornobyl NPP accident survivors was somewhat higher than in individuals not exposed to radiation (81.08 and 78.12 %; χ2 = 0.257, p = 0.612; 31.12 and 28.08 %; χ2 = 0.462, p = 0.319, respectively). Using a multivariate analysis, the reliable model was obtained confirming the relationship of increased parathyroid hormone level and early subclinical signs of the target organ damage (F = 4.294; p = 0.042), which proves the relevance of using clinical questionnaires. A reliable positive correlation was found between the vitamin D and free thyroxine levels (r = 0.729; p = 0.001), and negative one was found with the thyroid-stimulating hormone content (r = –0.803; p = 0.001). In the Chornobyl NPP accident survivors with type 2 diabetes, a decreased vitamin D concentration correlated with an increased duration of metformin therapy (r = –0.421; p = 0.001) and body mass index (r = –0.787; p = 0.001). It was found that the parathyroid hormone level increases along with the duration of type 2 diabetes and an increase in creatinine clearance (r = 0.724; p = 0.001, and r = 0.799; p = 0.001). Conclusions. Vitamin D deficiency has a negative effect on the course of comorbid disorders (type 2 diabetes and hypothyroidism) and excessive production of parathyroid hormone.
вторинний гіперпаратиреоз; гіпотиреоз; цукровий діабет 2-го типу; аварія на Чорнобильській АЕС
вторичный гиперпаратиреоз; гипотиреоз; сахарный диабет 2-го типа; авария на Чернобыльской АЭС
secondary hyperparathyroidism; hypothyroidism; type 2 diabetes; Chornobyl nuclear power plant accident
Вступ
Матеріали та методи
Результати
/13.jpg)
Обговорення
Висновки
- Hatch M., Cardis E. Somatic health effects of Chernobyl: 30 years on. Eur. J. Epidemiol. 2017. № 32(12). Р. 1047-1054. doi: 10.1007/s10654-017-0303-6.
- Kaminskyi O.V., Pankiv V.I., Pankiv I.V., Afanasyev D.E. Vitamin D content in population of radiologically contaminated areas in Chernivtsi region (pilot project). Probl. Radiac. Med. Radiobiol. 2018. № 23. Р. 442-451. doi: 10.33145/2304-8336-2018-23-442-451.
- Kaminskyi O.V., Kopylova O.V., Afanasyev D.E. et al. Hyperparathyroidism and parathyroid lesions in the ChNPP accident survivors. Problems of Radiation Medicine and Radiobiology. 2019. № 24. Р. 380-394. doi: 10.33145/2304-8336-2019-24-380-394.
- Boehm B.O., Rosinger S., Belyi D., Dietrich J.W. The parathyroid as a target for radiation damage. N. Engl. J. Med. 2011. № 365(7). Р. 676-678. doi: 10.1056/NEJMc1104982.
- Gomez D.L., Shulman D.I. Hyperparathyroidism two years after radioactive iodine therapy in an adolescent male. Case Reports in Pediatrics. 2014. № 2014. doi: 10.1155/2014/ 163848.
- Avinash S., Gupta R., Mohindroo N.K., Thakur J.S., Azad R. Effect of radiotherapy on thyroid and parathyroid gland functions. Sch. J. App. Med. Sci. 2017. № 5(4D). Р. 1499-1503. doi: 10.21276/sjams.
- Salive M.E. Multimorbidity in older adults. Epidemiol. Rev. 2013. № 35. Р. 75-83. doi: 10.1093/epirev/mxs009.
- Chiang J.I., Jani B.D., Mair F.S., Nicholl B.I., Furler J., O’Neal D. et al. Associations between multimorbidity, all-cause mortality and glycaemia in people with type 2 diabetes: A systematic review. PLoS One. 2018. № 13(12). e0209585. doi: 10.1371/journal.pone.0209585.
- Diederichs C., Berger K., Bartels D.B. The measurement of multiple chronic diseases — a systematic review on existing multimorbidity indices. The journals of gerontology, Series A, Biological sciences and medical sciences. 2011. № 66(3). Р 301-11. doi: 10.1093/gerona/glq208.7.
- Schafer I., Hansen H., Schon G. et al. The influence of age, gender and socio-economic status on multimorbidity patterns in primary care. First results from the Multicare Cohort Study. BMC Health Serv. Res. 2012. № 12. Р. 89. doi: 10.1186/1472-6963-12-89.
- Pankiv V.I., Yuzvenko T.Yu., Pankiv I.V. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problems of endocrine pathology. 2019. № 2. Р. 46-51. doi: 10.21856/j-PEP.2019.2.07.
- Pankiv V., Pankiv I. Association of vitamin D status with body mass index in adolescents in Ukraine. Rom. J. Diabetes. Nutr. Metab. Dis. 2018. № 25(4). Р. 377-381. doi: 10.2478/rjdnmd-2018-0045.
- Komisarenko Yu.I., Bobryk M.I. Vitamin D Deficiency and Immune Disorders in Combined Endocrine Pathology. Front. Endocrinol. 2018. doi: 10.3389/fendo.2018.00600.
- Al-Shoumer K., Al-Essa T.M. Is there a relationship between vitamin D with insulin resistance and diabetes mellitus? World J. Diabetes. 2015. № 6(8). Р. 1057-1064. doi: 10.4239/wjd.v6.i8.1057.
- Masliy K. Effect of metformin therapy on vitamin D level in patients with type 2 diabetes mellitus. Mìžnarodnij endokrinologìčnij žurnal. 2019. № 15(2). Р. 133-137. doi: 10.22141/2224-0721.15.2.2019.166105

/13_2.jpg)
/14.jpg)