Международный эндокринологический журнал Том 16, №2, 2020
Вернуться к номеру
Білі плями в питаннях селенодефіциту: про місце селеновмісних препаратів у лікуванні патології щитоподібної залози
Авторы: Булдигіна Ю.В., Терехова Г.М., Страфун Л.С., Шляхтич С.Л., Раков О.В.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Київський міський центр ендокринної хірургії на базі КМКЛ № 3, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
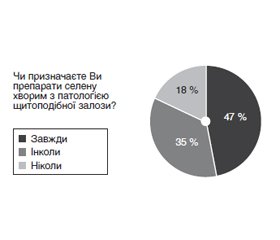
Актуальність. В останнє десятиліття точиться активна дискусія щодо ролі нестачі селену в патогенезі тиреопатій, а також доцільності й ефективності використання селеновмісних препаратів у їх лікуванні. На сьогодні в Україні надзвичайно мало даних про наявність/відсутність селенодефіциту в населення загалом і хворих із патологією щитоподібної залози (ЩЗ) зокрема. Тому питання доцільності використання селеновмісних препаратів надзвичайно цікавить як науковців, так і практикуючих лікарів. Мета дослідження: вивчити ставлення лікарів-ендокринологів України до застосування селеновмісних препаратів при лікуванні патології ЩЗ, а також дослідити вміст селену в сироватці крові хворих на дифузний токсичний зоб (ДТЗ) під час антитиреоїдної терапії в поєднанні з тривалим використанням селеновмісних препаратів. Матеріали та методи. Проведено онлайн-анкетування 100 лікарів-ендокринологів з різних областей України, у якому ставилось 6 питань: 1. Чи знаєте Ви про роль нестачі селену у розвитку патології ЩЗ? 2. Чи призначаєте Ви препарати селену хворим з патологією ЩЗ? 3. При якій патології ЩЗ Ви зазвичай призначаєте препарати селену? 4. Яким дозам препаратів селену Ви віддаєте перевагу? 5. Яку тривалість лікування селеновмісними препаратами Ви рекомендуєте? 6. Чи контролюєте Ви рівень селену до та після курсу терапії препаратами селену? Також у клініці ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» протягом 2018–2019 рр. тривало дослідження вмісту селену в крові у хворих із тиреопатіями до та після лікування препаратами селену для оцінки їх ефективності й визначення часу, необхідного для ліквідації селенодефіциту. Групу обстежених пацієнтів становили 35 пацієнтів: 34 жінки і 1 чоловік (середній вік 48,2 ± 5,2 року), які хворіли на ДТЗ. За даними анамнезу, тривалість захворювання становила від 6 місяців до 5 років (у середньому 2,8 ± 2,0 року). На момент початку обстеження всі хворі були в стані еутиреозу. Визначення селену проводилось флуориметричним методом на спектрофлуориметрі Hitachi MPF-4 з необхідною чутливістю (приблизно 0,0004 мкг/мл селену) і незначною похибкою вимірювань (2 %). Результати. Встановлено, що 98 % лікарів знають про роль дефіциту селену в розвитку патології ЩЗ, але 33 % з них зауважили, що хотіли б мати більше інформації. Інформованість лікарів не впливає на частоту призначень селеновмісних препаратів. Так, завжди при тиреопатіях призначають селеновмісні препарати 47 % опитаних, інколи призначають — 35 %, не призначають ніколи — 18 %. Переважно призначають препарати селену при автоімунному тиреоїдиті (АІТ) з еутиреозом чи субклінічним гіпотиреозом (77 %), при дифузному еутиреоїдному зобі — 10 %, при ДТЗ — 7 %, при тиреоїд-асоційованій офтальмопатії — 5 % і при багатовузловому нетоксичному зобі — 6 % лікарів. З’ясовано, що більшість лікарів (55 %) призначають селеновмісні препарати в дозі від 50 до 100 мкг на добу, 30 % опитаних зазвичай призначають від 100 до 200 мкг на добу і лише 15 % лікарів призначають 200 мкг і більше. Тривалість курсу лікування, якому лікарі віддають перевагу, становить 3 місяці (70 %), на один місяць призначають селеновмісні препарати 12 % опитаних, на 6 місяців — 18 %. Визначають вміст селену в крові хворих до/після курсу лікування завжди тільки 5 % опитаних, інколи — 6 % опитаних, не визначають — 89 %. При дослідженні вмісту селену в сироватці хворих на ДТЗ його рівень в досліджуваній групі становив 17,80 ± 2,59 мкг/л; медіана — 13 мкг/л (норма 80–100 мкг/л). Усім хворим призначались селеновмісні препарати в добовій дозі 200 мкг, після чого здійснювалось контрольне дослідження вмісту селену в крові через 3 і 6 місяців безперервного лікування. Через 3 місяці лікування рівень селену вірогідно збільшився до 63,88 ± 6,61 мкг/л (медіана — 58,5 мкг/л). При контролі цього показника через 6 місяців зафіксовано рівень 75,02 ± 9,78 мкг/л (медіана — 78 мкг/л), що вірогідно перевищувало початкові показники. Отже, тримісячний курс споживання селеновмісних препаратів (із добовою дозою 200 мкг) може бути недостатнім для відновлення нормального рівня селену у хворих із ДТЗ і селенодефіцитом, що потребує продовження лікування ще на наступні три місяці з індивідуальним контролем рівня селену чи призначення більших добових доз препарату. Висновки. Кількість лікарів-ендокринологів, які знають про роль нестачі селену в розвитку патології ЩЗ, становить 98 %, разом з цим 33 % опитаних бажають мати більше інформації стосовно доцільності призначення й ефективності селеновмісних препаратів. Призначають селеновмісні препарати при захворюваннях ЩЗ 47 % лікарів, з цієї кількості 77 % — тільки при автоімунному тиреоїдиті. При тиреоїд-асоційованій офтальмопатії призначають селеновмісні препарати лише 5 % лікарів. Перевага надається призначенню невеликих доз селеновмісних препаратів (55 %) із тривалістю лікування не більше від трьох місяців (70 % опитаних). Не визначають рівень селену до/після курсу терапії селеновмісними препаратами 89 % опитаних. У хворих із селенодефіцитом (17,80 ± 2,59 мкг/л; медіана — 13 мкг/л) після регулярного прийому селеновмісних препаратів (200 мкг селену на добу) протягом трьох місяців рівень селену в крові вірогідно підвищується до 63,88 ± 6,61 мкг/л, медіана — 58,5, але не досягає нижньої межі нормальних значень. Тільки через 6 місяців регулярного прийому селеновмісних препаратів (у добовій дозі 200 мкг) рівень селену в крові нормалізується й становить 75,02 ± 9,78 мкг/л, медіана — 78 мкг/л, наближаючись, отже, до нижньої межі норми.
Актуальность. В последнее десятилетие идет активная дискуссия относительно роли недостатка селена в патогенезе тиреопатий, а также о целесообразности и эффективности использования селеносодержащих препаратов в их лечении. Сегодня в Украине мало данных о наличии/отсутствии селенодефицита у населения в целом и у больных с патологией щитовидной железы (ЩЖ) в частности. Поэтому вопрос целесообразности использования селеносодержащих препаратов чрезвычайно интересует как ученых, так и практикующих врачей. Цель исследования: изучить отношение врачей-эндокринологов Украины к применению селеносодержащих препаратов при лечении патологии ЩЖ, а также исследовать содержание селена в сыворотке крови больных диффузным токсическим зобом (ДТЗ) во время проведения антитиреоидной терапии в сочетании с длительным использованием селеносодержащих препаратов. Материалы и методы. Проведено онлайн-анкетирование 100 врачей-эндокринологов из разных областей Украины, в котором ставилось 6 вопросов: 1. Знаете ли Вы о роли недостатка селена в развитии патологии ЩЖ? 2. Назначаете Вы препараты селена больным с патологией ЩЖ? 3. При какой патологии ЩЖ Вы, как правило, назначаете препараты селена? 4. Каким дозам препаратов селена Вы отдаете предпочтение? 5. Какую продолжительность лечения селеносодержащими препаратами Вы рекомендуете? 6. Контролируете ли Вы уровень селена до и после курса терапии препаратами селена? Также в клинике ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины» в течение 2018–2019 гг. проводилось исследование содержания селена в сыворотке крови больных с ДТЗ до и после лечения препаратами селена для оценки их эффективности и определения времени, необходимого для ликвидации селенодефицита. Группу обследованных пациентов составили 35 пациентов: 34 женщины и 1 мужчина (средний возраст 48,2 ± 5,2 года) с продолжительностью заболевания от шести месяцев до пяти лет (в среднем 2,8 ± 2,0 года). На момент начала обследования все больные находились в состоянии эутиреоза. Определение селена проводилось флуориметрическим методом на спектрофлуориметре Hitachi MPF-4 с необходимой чувствительностью (примерно 0,0004 мкг/мл селена) и незначительной погрешностью измерений (2 %). Результаты. Установлено, что 98 % врачей знают о роли дефицита селена в развитии патологии ЩЖ, но 33 % из них отметили, что хотели бы иметь больше информации. Информированность врачей не влияет на частоту назначения селеносодержащих препаратов. Всегда при тиреопатиях назначают селеносодержащие препараты 47 % опрошенных, иногда назначают — 35 %, не назначают никогда — 18 %. Преимущество отдается назначению препаратов селена при аутоиммунном тиреоидите с эутиреозом или субклиническим гипотиреозом (77 %), при диффузном эутиреоидном зобе назначают препараты селена 10 % опрошенных, при ДТЗ — 7 %, при тиреоид-ассоциированной офтальмопатии — 5 % и при многоузловом нетоксическом зобе — 6 % врачей. Выяснено, что большинство специалистов (55 %) назначают селеносодержащие препараты в дозе от 50 до 100 мкг в сутки, 30 % опрошенных обычно назначают от 100 до 200 мкг в сутки и только 15 % врачей назначают 200 мкг в сутки и более. Продолжительность курса лечения, которому врачи отдают предпочтение, составляет 3 месяца (70 %), на один месяц селеносодержащие препараты назначают 12 % опрошенных, на 6 месяцев — 18 %. Всегда определяют содержание селена в крови больных до/после курса лечения только 5 % опрошенных, иногда — 6 %, не определяют уровень селена — 89 %. При исследовании содержания селена в сыворотке больных ДТЗ его уровень в исследуемой группе составлял 17,80 ± 2,59 мкг/л; медиана — 13 мкг/л (норма — 80–100 мкг/л). Всем больным назначались селеносодержащие препараты в дозе 200 мкг, после чего осуществлялось контрольное исследование содержания селена в крови через 3 и 6 месяцев непрерывного лечения. Выяснено, что через 3 месяца лечения уровень селена достоверно возрастал до 63,88 ± 6,61 мкг/л (медиана — 58,5 мкг/л). При контроле этого показателя через 6 месяцев зафиксирован уровень 75,02 ± 9,78 мкг/л (медиана — 78 мкг/л), который достоверно превышал начальные показатели. Таким образом, трехмесячный курс приема селенсодержащих препаратов (в суточной дозе 200 мкг) может быть недостаточным для восстановления нормального уровня селена у больных с ДТЗ и селенодефицитом, что требует продолжения лечения на последующие три месяца с индивидуальным контролем уровня селена или назначения больших суточных доз препарата. Выводы. Большинство врачей-эндокринологов (98 %) знают о роли недостатка селена в развитии патологии щитовидной железы, из них 33 % опрошенных хотят иметь больше информации о целесообразности назначения и эффективности селеносодержащих препаратов. Назначают селеносодержащие препараты при заболеваниях щитовидной железы 47 % врачей, из этого количества 77 % — только при аутоиммунном тиреоидите. При тиреоид-ассоциированной офтальмопатии назначают селеносодержащие препараты лишь 5 % врачей. Предпочтение отдается назначению небольших доз селеносодержащих препаратов (55 % опрошенных) с длительностью лечения не более трех месяцев (70 % опрошенных). Не определяют уровень селена до/после курса терапии селеносодержащими препаратами 89 % опрошенных. У больных с диффузным токсическим зобом и селенодефицитом (исходный уровень селена 17,80 ± 2,59 мкг/л; медиана — 13 мкг/л) после регулярного приема селеносодержащих препаратов в дозе 200 мкг селена/сутки на протяжении трех месяцев содержание селена в сыворотке крови достоверно увеличивается до 63,88 ± 6,61 мкг/л, медиана — 58,5 мкг/л, но не достигает нижней границы нормальных значений. Только через 6 месяцев регулярного приема селеносодержащих препаратов (суточная доза 200 мкг) уровень селена в сыворотке нормализуется и составляет 75,02 ± 9,78 мкг/л, медиана — 78 мкг/л, таким образом, приближаясь к нижней границе нормальных значений.
Background. The role of selenium deficiency in the pathogenesis of thyropathies is actively discussed in the last decade, as well as the advisability and efficiency of using selenium-containing drugs in their treatment. There are extremely little data on the presence/absence of selenium deficiency in the general population of Ukraine and in patients with thyroid pathology in particular to date. Therefore, the question of expedient use of selenium-containing drugs is of great interest to both scientists and practitioners. The purpose was to study the attitude of Ukrainian endocrinologists towards the use of selenium-containing drugs in the treatment of thyroid pathology, and to investigate selenium content in the blood serum of patients with diffuse toxic goiter during antithyroid therapy in combination with prolonged use of these drugs. Materials and methods. The questionnaire was sent online to 100 endocrinologists from different regions of Ukraine, it included 6 questions: 1. Do you know about the role of selenium deficiency in the development of thyroid pathology? 2. Do you prescribe selenium drugs to patients with thyroid pathology? 3. In which thyroid pathology do you usually prescribe selenium drugs? 4. Which doses of selenium do you prefer? 5. What duration of treatment with selenium-containing drugs do you recommend? 6. Do you control the level of selenium before and after the course of therapy with selenium drugs? The study of selenium content in the blood of patients with thyropathies before and after treatment with selenium drugs was also continued in the clinic of the State Institution “V.P. Komisarenko Institute of Endocrinology and Metabolism of the National Academy of Medical Sciences of Ukraine” during 2018–2019 to evaluate their effectiveness and the time needed to eliminate selenium deficiency. The group of examined patients consisted of 35 persons: 34 women and 1 man (mean age of 48.2 ± 5.2 years) suffering from diffuse toxic goiter. According to the anamnesis, the disease duration ranged from 6 months to 5 years (2.8 ± 2.0 years on average). At the time of the examination, all the patients were in a state of euthyroidism. The determination of selenium was performed by a fluorometric method using the Hitachi MPF-4 spectrofluorimeter with the required sensitivity (approximately 0.0004 µg/ml of selenium) and an insignificant measurement error (2 %). Results. It was determined that 98 % of doctors were informed of the role of selenium deficiency in the development of thyroid pathology, but 33 % of them said that they would like to have more information. The awareness of doctors does not affect the frequency of selenium-containing drug prescriptions. Selenium-containing drugs are prescribed in thyropathies by 47 % of respondents, 35 % prescribe them sometimes, and 18 % do not prescribe at all. The doctors mainly prescribe selenium drugs in autoimmune thyroiditis with euthyroidism or subclinical hypothyroidism (77 %), in diffuse euthyroid goiter (10 %), in diffuse toxic goiter (7 %), in thyroid-associated ophthalmopathy (5 %), and in multinodular nontoxic goiter (6 %). It was found that most doctors (55 %) prescribe selenium-containing drugs at a dose of 50 to 100 µg per day, 30 % of respondents usually prescribe 100 to 200 µg per day, and only 15 % of doctors prescribe 200 µg or more. The duration of treatment course preferred by doctors is 3 months (70 %), 12 % of respondents prescribe selenium-containing drugs for 1 month, and 18 % — for 6 months. Selenium content in the blood of patients before/after the course of treatment is determined always only by 5 % of respondents, sometimes — by 6 % of respondents, and 89 % of them do not determine it at all. When studying selenium content in the blood serum of patients with diffuse toxic goiter, its level was 17.80 ± 2.59 µg/l in the study group; median — 13 µg/l (with a norm of 80–100 µg/l). All the patients were prescribed selenium-containing drugs at a daily dose of 200 μg, followed by a control study of selenium in the blood 3 and 6 months after continuous treatment. Selenium levels increased significantly to 63.88 ± 6.61 μg/l (median of 58.5 µg/l) 3 months after treatment. When controlling this indicator after 6 months, the level was 75.02 ± 9.78 µg/l (median of 78 µg/l) that was significantly higher than baseline values. Thus, a three-month course of using selenium-containing drugs (with a daily dose of 200 µg) may not be sufficient to restore the normal levels of selenium in patients with diffuse toxic goiter and selenium deficiency, requiring the continued treatment for another three months with individual control of selenium levels, or prescription of higher daily doses of the drug. Conclusions. The number of endocrinologists who know about the role of selenium deficiency in the development of thyroid pathology is 98 %, at the same time 33 % of respondents are wishing to have more information about the advisability of prescription and efficiency of selenium-containing drugs. Selenium-containing drugs are prescribed in thyroid diseases by 47 % of doctors, of these, by 77 % — only in autoimmune thyroiditis. Only 5 % of doctors prescribe selenium-containing drugs in thyroid-associated ophthalmopathy. Preference is given to the use of small doses of selenium-containing drugs (55 %) with the treatment duration no more than 3 months (70 % of respondents). The level of selenium before/after the course of selenium-containing therapy is not determined by 89 % of the respondents. In patients with selenium deficiency (17.80 ± 2.59 µg/l; median — 13 µg/l) after regular use of selenium-containing drugs (200 µg of selenium per day) for 3 months, the level of selenium in the blood increases significantly to 63.88 ± 6.61 µg/l; the median of 58.5 µg/l, but does not reach the lower limit of normal. Only 6 months after regular intake of selenium-containing drugs (daily dose of 200 µg), the level of selenium in the blood is normalized to 75.02 ± 9.78 µg/l; median of 78 µg/l, thus approaching the lower limit of normal.
щитоподібна залоза; селен; дифузний токсичний зоб
щитовидная железа; селен; диффузный токсический зоб
thyroid gland; selenium; diffuse toxic goiter
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Rayman M.P. Selenium and human health. Lancet. 2012. 379(9822). 1256-1268.
- Valea A., Georgescu C. Selenoproteins in human body: focus on thyroid pathophysiology. Hormones (Athens). 2018. 17(2). 183-196.
- Duntas L.H., Benvenga S. Selenium: an element for life. Endocrine. 2015. 48(3). 756-775.
- Waegeneers N., Thiry C., De Temmerman L., Ruttens A. Predicted dietary intake of selenium by the general adult population in Belgium. Food Addit. Contam. Part A. Chem. Anal. Control Expo Risk Assess. 2013. 30(2). 278-285.
- Santos L.R., Neves C., Melo M., Soares P. Selenium and selenoproteins in immune mediated thyroid disorders. Diagnostics (Basel). 2018. 8(4). 70.
- Hu X.F., Stranges S., Chan L.H.M. Circulating selenium concentration is inversely associated with the prevalence of stroke: results from the Canadian Health Measures Survey and the National Health and Nutrition Examination Survey. J. Amer. Heart Association. 2019. 8(10). e012290. doi: 10.1161/JAHA.119.012290.
- Hu S., Rayman M.P. Multiple nutritional factors and the risk of Hashimoto’s Thyroiditis. Thyroid. 2017. 27(5). 597-610.
- Ventura M., Melo M., Carrilho F. Selenium and thyroid Disease: From Pathophysiology to Treatment. Int. J. Endocrinol. 2017. 2017. 1297658.
- Köhrle J. Selenium and the thyroid. Curr. Opin. Endocrinol. Diabetes Obes. 2015. 22(5). 392-401.
- Köhrle J. Pathophysiological relevance of selenium. J. Endocrinol. Invest. 2013. 36(10). 1-7.
- Bhuyan A.K., Sarma D., Saikia U.K. Selenium and the thyroid: A close-knit connection. Indian J. Endocrinol. Metab. 2012. 16(2). 354-355.
- Rasmussen L.B., Schomburg L., Köhrle J. et al. Selenium status, thyroid volume, and multiple nodule formation in an area with mild iodine deficiency. Eur. J. Endocrinol. 2011. 164(4). 585-590.
- Гончарова O.A. Селен и щитовидная железа (обзор литературы и данные собственных исследований). Ендокринологія. 2014. 19(2). 149-155.
- Corvilain B., van Sande J., Laurent E., Dumont J.E. The H2O2-generating system modulates protein iodination and the activity of the pentose phosphate pathway in dog thyroid. Endocrinology. 1991. 128(2). 779-785.
- Triggiani V., Tafaro E., Giagulli V.A. et al. Role of iodine, selenium and other micronutrients in thyroid function and disorders. Endocr. Metab. Immune Disord. Drug Targets. 2009. 9(3). 277-294.
- Krysiak R., Okopien B. The effect of levothyroxine and selenomethionine on lymphocyte and monocyte cytokine release in women with Hashimoto’s thyroiditis. J. Clin. Endocrinol. Metab. 2011. 96(7). 2206-2215.
- Rayman M.P. Multiple nutritional factors and thyroid disease, with particular reference to autoimmune thyroid disease. Proc. Nutr. Soc. 2019. 78(1). 34-44.
- Kyrgios I., Giza S., Kotanidou E.P. et al. l-selenomethionine supplementation in children and adolescents with autoimmune thyroiditis: A randomized double-blind placebo-controlled clinical trial. J. Clin. Pharm. Ther. 2019. 44(1). 102-108.
- Dharmasena A. Selenium supplementation in thyroid associated ophthalmopathy: an update. Int. J. Ophthalmol. 2014. 7(2). 365-375.
- Bartalena L., Baldeschi L., Boboridis K. et al. The 2016 European Thyroid Association/European Group on Graves’ Orbitopathy Guidelines for the management of Graves’ orbitopathy. Eur. Thyroid J. 2016. 5(1). 9-26.
- Назаренко И.И., Кислова И.В., Гусуйнов Т.М. Флуориметрическое определение селена 2,3-диаминонафталином в биологических материалах. Журнал аналитической химии. 1975. 30(4). 733-737.
- Negro R., Attanasio R., Grimaldi F. et al. A 2016 Italian Survey about the clinical use of selenium in thyroid disease. Eur. Thyroid J. 2016. 5. 164-170.

/47.jpg)
/48.jpg)