Международный эндокринологический журнал Том 16, №2, 2020
Вернуться к номеру
Ожиріння в дітей: критерії прогнозування розвитку артеріальної гіпертензії
Авторы: Сорокман Т.В., Попелюк Н.О.
ВДНЗ «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Ожиріння в дитячому віці викликає широкий спектр серйозних ускладнень — підвищений ризик розвитку цукрового діабету, артеріальної гіпертензії (АГ), серцево-судинних та інших захворювань. Формування різних варіантів АГ у підлітків із надмірною масою тіла та ожирінням характеризується дисбалансом продукції біологічно активних речовин. Матеріали та методи. Обстежено 160 осіб: із надмірною масою тіла (НМТ, n = 35), з ожирінням (абдомінальний тип ожиріння, n = 35; рівномірний тип ожиріння, n = 35) та 55 здорових осіб. Досліджували ліпідний спектр крові (загальний холестерин (ЗХС), тригліцериди (ТГ), холестерин ліпопротеїдів високої щільності (ХС ЛПВЩ), холестерин ліпопротеїдів низької щільності (ХС ЛПНЩ)), ендотелін-1 (ЕТ-1), β2-мікроглобулін (β2МГ) у крові та сульфат оксимелатоніну (6СОМТ) у сечі. Результати. Встановлено вірогідне зростання середньодобових значень систолічного (САТ), діастолічного, середнього гемодинамічного та пульсового артеріального тиску. Діти з ожирінням мають схильність до надмірної реактивності у вигляді збільшення числа підйомів САТ у добовому тренді. У 57,1 % хворих на ожиріння виявляються патологічні відхилення показників ліпідного спектра крові: ЗХС, ХС ЛПНЩ, ТГ були вищими, а ХС ЛПВЩ — нижчим в обох групах пацієнтів. Виявлено істотне зростання вмісту ЕТ-1 та β2МГ у плазмі крові дітей з ожирінням та тенденцію до підвищення в дітей із НМТ, порушення циркадіанного ритму секреції 6СОМТ. Висновки. У дітей з ожирінням та НМТ встановлено метаболічні фактори ризику розвитку АГ: дисліпідемія (гіпертригліцеридемія, підвищення ХС ЛПНЩ, зниження ХС ЛПВЩ), підвищення рівня β2МГ та ЕТ-1, дисбаланс секреції мелатоніну. Хворі, які мають такі несприятливі фактори, повинні перебувати під ретельним наглядом лікаря. Особливу увагу необхідно звертати на дітей із НМТ як потенційних кандидатів на розвиток ожиріння та його ускладнень, зокрема АГ.
Актуальность. Ожирение в детском возрасте вызывает широкий спектр серьезных осложнений — повышенный риск развития сахарного диабета, артериальной гипертензии (АГ), сердечно-сосудистых и других заболеваний. Формирование различных вариантов АГ у подростков с избыточной массой тела и ожирением характеризуется дисбалансом продукции биологически активных веществ. Материалы и методы. Обследованы 160 человек: с избыточной массой тела (ИМТ, n = 35), с ожирением (абдоминальный тип ожирения, n = 35; равномерный тип ожирения, n = 35) и 55 здоровых лиц. Исследовали липидный спектр крови (общий холестерин (ОХС), триглицериды (ТГ), холестерин липопротеидов высокой плотности (ХС ЛПВП), холестерин липопротеидов низкой плотности (ХС ЛПНП)), эндотелин-1 (ЭТ-1), β2-микроглобулин (β2МГ) в крови и сульфат оксимелатонина (6СОМТ) в моче. Результаты. Установлен рост среднесуточных значений систолического (САД), диастолического, среднего гемодинамического и пульсового артериального давления. Дети с ожирением имеют склонность к чрезмерной реактивности в виде увеличения числа подъемов САД в суточном тренде. У 57,1 % больных ожирением обнаруживаются патологические отклонения показателей липидного спектра крови: ОХС, ХС ЛПНП, ТГ были выше, а ХС ЛПВП ниже в обеих группах пациентов. Выявлены существенное повышение содержания ЭТ-1 и β2МГ в плазме крови детей с ожирением и тенденция к повышению у детей с ИМТ, нарушение циркадианного ритма секреции 6СОМТ. Выводы. У детей с ожирением и ИМТ установлены метаболические факторы риска развития АГ: дислипидемия (гипертриглицеридемия, повышение ХС ЛПНП, снижение ХС ЛПВП), повышение уровня β2МГ и ЭТ-1, дисбаланс секреции мелатонина. Больные, имеющие такие неблагоприятные факторы, должны находиться под тщательным наблюдением врача. Особое внимание необходимо обращать на детей с ИМТ как потенциальных кандидатов на развитие ожирения и его осложнений, в частности АГ.
Background. Obesity in childhood causes a wide range of serious complications and increased risk of diabetes, hypertension, cardiovascular and other diseases. Formation of various types of hypertension in adolescents with overweight and obesity is characterized by imbalance in the production of biologically active substances. Materials and methods. One hundred and sixty people were examined: with overweight (n = 35), obesity (abdominal (n = 35), uniform (n = 35)), and 55 healthy people. Blood lipids (total cholesterol, triglycerides, high density lipoprotein (HDL) cholesterol, low density lipoprotein (LDL) cholesterol), endothelin-1, β2-microglobulin were studied, as well as 6-hydroxymelatonin sulfate in the urine. Results. A significant increase in the average daily values of systolic, diastolic, mean hemodynamic and pulse blood pressure was established. Obese children had a tendency to react excessively in the form of an increase in the daily rate of systolic blood pressure elevations. In 57.1 % of patients with obesity, pathological abnormalities of the blood lipids were found: levels of total cholesterol, LDL cholesterol, triglycerides were higher, and HDL cholesterol was lower in both groups of patients. A significant increase in the content of endothelin-1 and β2-microglobulin in the blood plasma of obese children and a tendency towards an increase in children with overweight, disturbances of the circadian rhythm of 6-hydroxymelatonin sulfate secretion were revealed. Conclusions. Metabolic risk factors for the development of hypertension have been identified in children with obesity and overweight: dyslipidemia (hypertriglyceridemia, increased LDL cholesterol, reduced HDL cholesterol), increased β2-microglobulin and endothelin-1 levels, and an imbalance of melatonin secretion. Patients with these adverse factors should be closely monitored by a physician. A special attention should be paid to children with overweight as potential candidates for the development of obesity and its complications, including arterial hypertension.
діти; ожиріння; надмірна маса тіла; артеріальна гіпертензія; прогностичні критерії
дети; ожирение; избыточная масса тела; артериальная гипертензия; прогностические критерии
children; obesity; overweight; hypertension; prognostic criteria
Вступ
Матеріали та методи
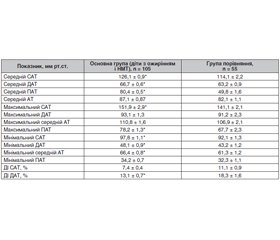
Результати
/69_2.jpg)
Обговорення
Висновки
- World Health Organization. Consideration of the evidence on childhood obesity for the Commission on Ending Childhood Obesity: report of the ad hoc working group on science and evidence for ending childhood obesity. Geneva, Switzerland. 2016. https://apps.who.int/iris/handle/10665/206549
- Gómez L.A., Abdeen Z.A., Hamid Z.A. Worldwide trends in body-mass index, underweight, overweight, and obesity from 1975 to 2016: a pooled analysis of 2416 population-based measurement studies in 128·9 million children, adolescents, and adult. Lancet. 2017. 390. 2627-42. doi: 10.1016/S0140-6736(17)32129-3.
- Roberto C.A., Swinburn B., Hawkes C. et al. Patchy progress on obesity prevention: emerging examples, entrenched barriers, and new thinking. Lancet. 2015. 385(9985). 2400-2409. doi: 10.1016/ S0140-6736(14)61744-X.
- Lobstein T., Jackson-Leach R., Moodie M.L. et al. Child and adolescent obesity: part of a bigger picture. Lancet. 2015. 385(9986). 2510-2520. doi: 10.1016/S0140-6736(14)61746-3.
- Cunningham S.A., Kramer M.R., Narayan K.M. Incidence of childhood obesity in the United States. N. Engl. J. Med. 2014. 370(17). 1660-1661. doi: 10.1056/NEJMc1402397.
- Dzhumagaziev A.A., Bezrukova Y.E.S., Bogdanyants M.V. et al. The problem of obesity in children in the modern world: realities and possible solutions. Voprosy sovremennoi pedyatryy. 2016. 15(3). 250-256. doi: 10.15690/vsp.v15i3.1561). (in Russian).
- Dhuper S., Abdullah R.A., Weichbrod L. et al. Association of obesity and hypertension with left ventricular geometry and function in children and adolescents. Obesity (Silver Spring). 2011. 19(1). 128-133. doi: 10.1038/oby.2010.134.
- Senatorova A.S., Chaychenko T.V., Boychenko A.D. Anthropometric predictors of myocardial remodeling in overweight and obese adolescents. Zdorovie rebenka. 2011. (8). 25-29. (in Russian).
- Posokhova N.V. Mechanisms of arterial hypertension formation in obese children. Byulleten meditsinskikh internet-konferentsiy. 2013. 3(2). 331. (in Russian).
- Netrebenko O.K. Obesity in children: the origins of problems and finding solutions. Pediatriia. 2011. 90(6). 104-113. (in Russian).
- Pavlovskaya E.V., Strokova T.V., Surkov A.G., et al. Metabolic disturbances in preschool children with obesity. Rossiiskii vestnik perinatologii i pediatrii. 2013. 58(6). 91-97. (in Russian).
- Kvashnina L.V., Ignatova T.B. Prevention of the failure of endothelial function in children during the transition from healthy to syndrome of vegetative dysfunction. Sovremennaia pedyatryia. 2016. 5. 16-24.
- Minakova V.A. Riven markers of endothelial dysfunction (endothelium — 1 and nitric oxide) in blood and albuminuria in children with energy. Ukrainskyi zhurnal nefrolohii ta dializu. 2017. 3. 49-54. (in Ukrainian).
- Shadrin S.A., Statova A.V. Prevalence and characteristics of lipid metabolism disorders in children from Krasnodar region of Russia. Obesity and metabolism. 2014. (1). 38-41. (in Russian).
- Real de Asúa D., Puchades R., Garcia-Polo I., Suarez C. A Study on the Relationship between Serum Beta 2-Microglobulin Levels, Underlying Chronic Kidney Disease, and Peripheral Arterial Disease in High-Vascular-Risk Patients. Int. Cardiovasc. Res. J. 2012. 6(4). 107-112. PMCID: PMC3987415.
- Dionne J.M., Harris K.C., Benoit G., Feber J., Poirier L., Cloutier L., Nakhla M., Rabi D.M., Daskalopoulou S.S., Fournier A.; for the Hypertension Canada Guideline Committee. Canadian Journal of Cardiology. 2017. 33. 577-585.
- Rapoport S.I., Molchanov A.Y., Golichenkov V.A. et al. Metabolic Syndrome and Melatonin. Klynycheskaia medytsyna. 2013. 11. 8-14. (in Russian).
- Reiter R., Manchester L., Fuentes-Broto L., Tan D. Cardiac hypertrophy and remodeling: pathophysiological consequences and protective effects of melatonin. J. Hypertens. 2010. 28(2). 7-12.
- Ryznychuk M.O., Pishak V.P. Obesity: The role of desynchronosis and genetic factors in mechanisms of its development. Regulatory Mechanisms in Biosystems. 2017. 8(1). 23-29. doi: 10.15421/021705.
- Kaladze M.M., Zyukova I.B. The role of the concept in chronobiological characteristics of arterial hypertension in children. Sovremennaia pedyatryia. 2014. 3(59). 94-97. doi: 10.15574/SP.2014.59.94. (in Russian).
- Imenshahidi M., Karimi G., Hosseinzadeh H. Effects of melatonin on cardiovascular risk factors and metabolic syndrome: a comprehensive review. Naunyn Schmiedebergs Arch. Pharmacol. 2020. doi: 10.1007/s00210-020-01822.
- Sun H., Gusdon A.M., Qu S. Effects of melatonin on cardiovascular diseases: progress in the past year. Curr. Opin. Lipidol. 2016. 27(4). 408-13. doi: 10.1097/MOL.0000000000000314.
- Zisapel N. New perspectives on the role of melatonin in human sleep, circadian rhythms and their regulation. Br. J. Pharmacol. 2018. 175(16). 3190-3199. doi: 10.1111/bph.14116.
- Tordjman S., Chokron S., Delorme R. et al. Melatonin: Pharmacology, Functions and Therapeutic Benefits. Curr. Neuropharmacol. 2017. 15(3). 434-443. doi: 10.2174/1570159X14666161228122115.
- Chaichenko T.V. Optimization of physical activity among children and adolescents in the campaign to end childhood obesity. Zdorovie rebenka. 2015. 4(64). 310-35. (in Russian).
- Maskova G.S., Chernaya N.L., Shubina E.V., Aleksandrova S.V. The age features of primary obesity in children. Prakticheskaya meditsina. 2014. 9(85). 126-0130. (in Russian).
- Pavlishin G.A., Furdela W.B., Samson O.A. Just go to the diagnosis of childhood obesity. Fundamentalni doslidzhennia. 2012. 2-3 (26-27). 47-51. (in Ukrainian).
- Zimmet P., Alberti K.G., Kaufman F.T. et al. IDF Consensus Group. IDF Consensus. The metabolic syndrome in children and adolescents — an IDF consensus report. Pediat. Diabetes. 2007. 8(5). 299-306. DOI: 10.1111/j.1399-5448.2007.00271.x.
- McCarthy H.D., Cole T.J., Fry T. et al. Body fat reference curves for children. Int. J. Obes (Lond.). 2006. 30(4). 598-602.
- Averiyanov A.P., Bolotova N.V., Zotova S.A. Obesity obesity in childhood. Lechashchii vrach. 2010. (2). 13-15. (in Russian).
- Strohyi V.V., Abrosymova N.N., Koren Y.A. et al. Features of the daily profile of blood pressure in children and adolescents with various forms of obesity. Belorusskyi med. zhurn. 2012. 1. 125-129.
- Hermida R.C., Smolensky M.H., Ayala D.E., Portaluppi F. 2013 Ambulatory blood pressure monitoring recommendations for the diagnosis of hypertension, assessment of cardiovascular and other hypertension-associated risk, and attainment of therapeutic goals. Chronobiol. Int. 2013. 30(3). 355-410.
- Liu Y., Shi L., Lin Y. et al. Relationship between blood pressure variability and target organ damage in children with essential hypertension. Zhonghua Er Ke Za Zhi. 2019. 57(2). 93-97. doi: 10.3760/cma.j.issn.0578-1310.2019.02.006.
- Cardinali D., Cano P., Jimenez-Ortega V., Esquifino A. Neuroendocrinol melatonin and the metabolic syndrome: physiopathologic and therapeutical implications. Neuroendocrinology. 2011. 93(3). 131-142.
- Cardinali D., Hardeland R. Inflammaging, metabolic syndrome and melatonin: a call for treatment studies. Neuroendocrinology. 2017. 104(4). 382-397.
- Liu L., Clough S.J., Hutchinson A.J. et al. MT1 and MT2 melatonin receptors: a therapeutic perspective. Annual review of pharmacology and toxicology. 2016. 56. 361-383.
- Sichov R.O. Changes in urinary excretion of beta-2-microglobulin in hypertension J. Clin. Exp. Med. Res. 2015. 3(1). 129-136.
- Tomlinson P.A., Dalton R.N., Turner C., Chantler C. Measurement of Beta 2-microglobulin, Retinol-Binding Protein, Alpha 1-microglobulin and Urine Protein 1 in Healthy Children Using Enzyme-Linked Immunosorbent Assay. Clin. Chim. Acta. 1990. 192(2). 99-106. doi: 10.1016/0009-8981(90)90073-2.
- Steubl D., Inker L.A. How Best to Estimate Glomerular Filtration Rate? Novel Filtration Markers and Their Application Curr. Opin. Nephrol. Hypertens. 2018. 27(6). 398-405. doi: 10.1097/MNH.0000000000000444.

/68.jpg)
/69.jpg)