Вступ
Гострий тонзилофарингіт (ГТФ) — одне з найпоширеніших інфекційних захворювань у дітей. Терміни «тонзиліт» і «фарингіт» використовують для визначення локалізації гострого запалення піднебінних мигдаликів або слизової оболонки глотки відповідно. З огляду на близьке анатомічне розташування й часте залучення до запального процесу обох структур одночасно, в літературі й практичній діяльності також застосовується термін «тонзилофарингіт». ГТФ належить до поширених інфекційних захворювань у педіатричній практиці й становить не менше від 15 % у структурі гострих респіраторних захворювань [1].
У переважній більшості випадків причиною гострого тонзилофарингіту є інфекційне ураження. Збудниками захворювання можуть бути віруси, бактеріальні патогени й гриби [2]. Близько 30 % гострих тонзилофарингітів у дітей виникають унаслідок бактеріальної інфекції [3]. Серед бактеріальних збудників у багатьох випадках етіологічна роль належить бета-гемолітичному стрептококу групи А (БГСА). Рідше захворювання викликають Pneumococcus, Staphylococcus aureus, Haemophilus influenzae, Moraxella catarrhalis, Fusobacterium necrophorum, Streptococcus (групи B, C, G), Chlamydia pneumoniae, Corynebacterium diphtheriae, гриби (Candida albicans, Rhinosporidium, Cryptococcus, Histoplasma) [4].
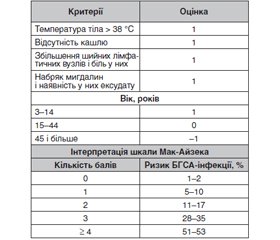
Для встановлення діагнозу гострого тонзилофарингіту достатньо збору анамнезу й фізикального обстеження. Під час встановлення діагнозу найбільш важливим аспектом стає оцінка ризику бактеріальної (зокрема, стрептококової) етіології захворювання. Для визначення ймовірності стрептококової етіології тонзилофарингіту під час клінічного обстеження широко використовують шкалу Мак-Айзека (McIsaac) (табл. 1) [5].
Серед додаткових обстежень, що можуть бути корисними для діагностики, можна відзначити тести на стрептококову інфекцію. Це можуть бути як стандартні бактеріологічні методи, так і тести на антигени стрептококу, включно зі швидкими експрес-тестами. Дане обстеження може допомогти у визначенні етіологічної ролі бета-гемолітичного стрептококу групи А й призначенні адекватної терапії. На даний час обстеження на БГСА рекомендується проводити всім пацієнтам із високим ризиком стрептококового фарингіту за даними клінічного обстеження [6].
На сьогодні у світі опубліковано декілька нових настанов щодо лікування гострого тонзилофарингіту. Зокрема, це рекомендації National Institute for Health and Care Excellence «Sorethroat (acute): antimicrobial prescribing» (2018), Centers for Disease Control and Prevention «Pharyngitis (strepthroat)» (2018), Institute for Clinical Systems Improvement «Diagnosis and treatment of respiratory illness in children and adults» (2017). У даних настановах найбільше обговорюється питання обґрунтованого призначення антибактеріальних засобів. Це обумовлено проблемою широкого й не завжди раціонального використання антибіотиків, зростанням антибіотикорезистентності й ризиком ускладнень, асоційованих із прийомом антибіотиків. Щодо вибору антибактеріального засобу на даний час немає жорстких рекомендацій. Оскільки за результатами досліджень представники всіх основних груп антибіотиків, таких як пеніциліни, макроліди й цефалоспорини, продемонстрували схожу ефективність при бактеріальному тонзиліті, визначення оптимального засобу може базуватись на характеристиках безпеки, зручності прийому, фармекономіки [7].
Поруч із застосуванням стандартних методів терапії постійно триває пошук альтернативних лікувальних засобів, що значною мірою обумовлюється поширенням антибіотикорезистентності. На даний час вивчаються можливості застосування препаратів на основі бактеріоцинів, пробіотичних бактерій і бактеріофагів як альтернатива антибіотикам [8]. Протимікробні пептиди бактеріального походження, до яких чутливі більшість грампозитивних і частково грамнегативні бактерії, отримали назву лантибіотиків. Більше ніж півстоліття лантибіотики успішно використовуються для збереження харчових продуктів. Нізин — приклад лантибіотика, до якого бактеріальна резистентність не розвивається до сьогодні [9]. Тому в клінічній практиці лантибіотики можуть посісти провідне місце в арсеналі антимікробних засобів уже в найближчому майбутньому.
Серед представників I класу лантибіотиків на даний час достатньо вивченим є Streptococcus salivarius K12 (SsK12; Bacteriocin-Like Inhibitory Substances К12 — BLIS K12) — пробіотичний штам, що продукує два бактеріоцини (саліварицин А2 і саліварицин В), які протидіють росту Streptococcus pyogenes, Streptococcus pneumoniae, які є одними з основних етіологічних чинників бактеріальних інфекцій респіраторного тракту в дітей [10]. Окрім того, дані штами пригнічують ріст таких збудників, як Haemophilus influenzae і Moraxella catarrhalis, що беруть участь в етіопатогенезі гострого середнього отиту [11]. Уперше штам K12 був виділений професором Джоном Таггом у Новій Зеландії з ротової порожнини абсолютно здорової дитини, яка не була інфікована Streptococcus pyogenes і тривалий час не хворіла на захворювання лор-органів [12].
Встановлено, що механізм дії Streptococcus salivarius K12 реалізується за рахунок колонізації ротової порожнини й носоглотки, тобто він є респіраторним пробіотиком. Streptococcus salivarius K12 конкурує з патогенною мікрофлорою за поживні середовища й сприяє її витісненню. Результати досліджень у дітей демонструють, що штам колонізує ротову порожнину приблизно в 30 % дітей уже на третій день від початку прийому K12 [13]. Цей ефект зберігається протягом місяця після прийому останньої дози препарату. Крім того, синтезовані саліварицини є природними антибактеріальними речовинами [14].
За даними останніх досліджень доведено перевагу Streptococcus salivarius K12 у профілактичному застосуванні. У дітей, які отримували SsK12 протягом двох курсів по 30 днів з інтервалом у 3 місяці, епізоди фаринготонзиліту, пов’язані з бета-гемолітичним стрептококом групи А чи не пов’язані з ним, виникали значно рідше після профілактичного застосування Бактоблісу (майже на 80 % в обох випадках). До того ж у пацієнтів із групи дослідження вірогідно зменшилася частота епізодів вірусних фарингітів, ринітів, трахеїтів, ларингітів, стоматитів і гострих середніх отитів після застосування лантибіотика [16]. Доведений виражений профілактичний ефект К12 у пацієнтів із рецидивуючими тонзилофарингітами — суттєве зменшення частоти стрептококових інфекцій на фоні тривалого його застосування [17–19].
З огляду на існуючий протимікробний потенціал та ефективність при профілактичному прийомі К12 можна очікувати також позитивного ефекту від застосування його під час гострих респіраторних інфекцій, зокрема тонзилофарингітів. Проте в доступній літературі ми не знайшли публікацій про результати лікування препаратами на основі К12 дітей із гострими тонзилофарингітами.
Мета роботи: вивчити ефективність і переносимість Streptococcus salivarius K12 при лікуванні гострого тонзилофарингіту в дітей.
Матеріали та методи
Відкрите рандомізоване контрольоване постреєстраційне дослідження проводилось у клініці дитячих інфекційних хвороб НМУ імені О.О. Богомольця, Київській міській дитячій інфекційній лікарні м. Києва. До дослідження залучались діти від 2 до 18 років, які проходили стаціонарне лікування з приводу гострого стрептококового тонзилофарингіту впродовж січня 2020 року. Методом випадкових чисел діти розподілені на основну й контрольну групи. Діти контрольної групи отримували лікування згідно з локальним протоколом діагностики й лікування, а діти основної групи отримували додатково до протокольного лікування препарат Streptococcus salivarius K12 (Бактобліс). Кожна таблетка Бактоблісу містить один мільярд одиниць, що утворюють колонії SsK12. Лантибіотик Бактобліс діти приймали згідно з інструкцією до застосування по 1 таблетці 1 раз на день безпосередньо перед сном, розсмоктуючи в порожнині рота, протягом 10 днів.
Результати
У дослідженні взяли участь 50 дітей віком від 2 до 17 років із діагнозом гострого стрептококового тонзилофарингіту. Основну групу становили 25 дітей, які отримували в комплексному лікуванні Streptococcus salivarius K12 (препарат Бактобліс), контрольну групу — 25 дітей із гострим тонзилофарингітом, які отримували стандартну терапію згідно з локальним протоколом діагностики й лікування. Етіологія стрептококового тонзилофарингіту (Streptococcus pyogenes) у всіх пацієнтів була підтверджена лабораторно за допомогою експрес-тесту на виявлення бета-гемолітичного стрептококу групи А та результатів бактеріологічного посіву мазку з носоглотки.
У табл. 2 подані основні демографічні показники груп дослідження.
За віковими характеристиками, статтю й тривалістю захворювання до моменту госпіталізації між основною та контрольною групами суттєвої різниці не відмічалось (р > 0,05) (табл. 2).
Основні клінічні показники на момент госпіталізації подані в табл. 3.
На момент надходження в усіх (100 %) хворих обох груп спостерігалась клінічна картина у вигляді лихоманки, лімфаденопатії, скарг на біль у горлі й наявності нашарувань на мигдаликах. Нашарування на мигдаликах були жовтувато-білого кольору, суцільні, рідше острівцеві, або фолікулярні, легко знімались шпателем, не залишаючи кровоточивості на поверхні. Ступінь тяжкості захворювання в обох групах розцінювався як середньотяжкий у 100 % випадків. За основними клінічними симптомами на момент госпіталізації основна й контрольна групи між собою суттєво не відрізнялись (р > 0,05).
Антибіотикотерапія проводилась у всіх (100 %) пацієнтів. У 60 % випадків застосовувався амоксицилін, у 25 % — цефалоспорини й у 15 % — азитроміцин. У всіх пацієнтів спостерігався сприятливий перебіг захворювання з повним клінічним одужанням на момент виписки.
На рис. 1 подана динаміка лихоманки в дітей обох груп. У перший день на момент госпіталізації підвищення температури тіла понад 37 °С спостерігалось у 92 % хворих (23 дитини) контрольної групи та 88 % хворих (22 дитини) основної групи (рівень значимості за критерієм хі-квадрат — р = 0,638). На другий день лихоманка спостерігалась у 76 % (19) пацієнтів контрольної та 68 % (17) хворих основної групи (р = 0,529). На третій день лихоманка зберігалась у 36 % (9) хворих контрольної та 20 % (5) пацієнтів основної групи (р = 0,208). На четвертий день спостереження підвищення температури тіла було зареєстровано в 16 % (4 дитини) і 8 % (2 дитини) у контрольній та основній групі відповідно (р = 0,385). На п’ятий день спостереження в усіх дітей відмічалась нормалізація температури тіла.
Середня тривалість лихоманки в основній групі становила 2,28 ± 0,72 дня, у контрольній — 2,68 ± 0,73 дня (p < 0,05 за критерієм Манна — Уїтні).
На основі щоденних оглядів пацієнтів та аналізу їх скарг подано детальну характеристику тривалості болю в горлі в дітей із тонзилофарингітом (рис. 2).
У перший день 100 % (по 25 дітей) хворих обох груп скаржились на біль у горлі (p > 0,05). На другий день біль у горлі спостерігався в 100 % хворих контрольної і 56 % хворих (14 дітей) основної групи (p < 0,001). На третій день — у 80 % (20) хворих контрольної і 16 % (4) хворих основної групи (p < 0,001). На четвертий день біль у горлі реєструвався в 76 % хворих (19 пацієнтів) контрольної групи й не відзначався в жодного пацієнта основної групи (p < 0,001). На п’ятий день спостереження в групі контролю біль у горлі відмічався в 44 % (11) хворих, в основній групі — 0 хворих (p < 0,001).
Середня тривалість болю в горлі у хворих контрольної групи становила 4,21 ± 1,13 дня, а в дітей основної групи — 1,91 ± 0,65 дня (p < 0,001).
Тривалість нашарувань на мигдаликах у хворих на тонзилофарингіт контрольної та основної груп наведена на рис. 3.
Нашарування на мигдаликах спостерігались у 100 % хворих обох груп у перший день госпіталізації (p > 0,05). На другий день нашарування були зареєстровані у 88 % хворих (22 дитини) контрольної і 72 % хворих (18 дітей) основної групи (p = 0,158). На третій день нашарування спостерігались у 48 % (12) хворих контрольної та 40 % (10) хворих основної групи (p = 0,569). В основній групі була виявлена більша позитивна динаміка. На четвертий день у 16 % (4 дитини) відмічались нашарування на мигдаликах, у той час як у контрольній групі — у 28 % (7) хворих (p = 0,306). Найдовша наявність нашарувань на мигдаликах була зареєстрована у 12 % (3) хворих контрольної групи (p = 0,075) і 4 % (1 пацієнт) — основної (p = 0,298).
У середньому тривалість нашарувань у контрольній групі становила 3,10 ± 0,85 дня, у хворих основної групи — 2,80 ± 0,89 дня (p > 0,05).
Динаміка тривалості лімфаденопатії у хворих на тонзилофарингіт в обох групах подана на рис. 4.
На перший день госпіталізації лімфаденопатія спостерігалась у 100 % хворих обох груп (p > 0,05). На другий день болючість і збільшення шийних лімфовузлів зареєстровано у 84 % хворих (21 дитина) контрольної і 76 % (19) хворих основної групи (p = 0,480). На третій день лімфаденопатія спостерігалась у 72 % (18) хворих контрольної групи й 60 % (15) дітей основної групи (p = 0,371). На четвертий день — у 52 % (13) хворих контрольної групи і 40 % (10) хворих основної (p = 0,364) і на п’ятий день — у 16 % хворих (4 дитини) контрольної групи й 12 % (3 дитини) — основної (р = 0,684).
Середня тривалість лімфаденопатії у хворих контрольної групи — 3,54 ± 0,75 дня, основної — 3,32 ± 0,61 дня (p > 0,05).
Слід зазначити, що впродовж усього періоду спостереження у хворих, які приймали препарат Бактобліс, не було зареєстровано жодних побічних реакцій під час його застосування, що підтверджує високий профіль безпеки препарату й свідчить про добру його переносимість.
Обговорення
Результати нашого пілотного спостереження свідчать про позитивний ефект препарату Бактобліс на перебіг гострого тонзилофарингіту в дітей. Він проявлявся скороченням термінів нормалізації основних клінічних симптомів, зокрема таких, як лихоманка, біль у горлі, нашарування на мигдаликах і прояви лімфаденопатії. Різниця між основною та контрольною групами за більшістю клінічних симптомів була невірогідною, що може бути обумовлено незначною кількістю осіб, які були залучені до дослідження. З іншого боку, препарат Streptococcus salivarius K12 призначався в складі комплексної терапії разом з антибактеріальним засобом, що також могло певним чином приховати ефект досліджуваного препарату. Адже відомо, що даний пробіотичний штам чутливий до дії практично всіх антибіотиків, які застосовуються для лікування гострих респіраторних інфекцій. Аналогічне за дизайном дослідження було проведене Gilbey в 2015 році [15]. У даній роботі досліджувалась ефективність препарату Streptococcus salivarius K12 у 60 дорослих пацієнтів, хворих на гострий тонзилофарингіт. Пацієнти основної групи отримували лантибіотик у комбінації з антибіотикотерапією і жарознижувальною терапією протягом 10 днів. Дослідники вивчили вплив препарату за такими показниками, як біль у горлі, швидкість осідання еритроцитів, рівень С-реактивного білка і рівень лейкоцитів у периферичній крові. За результатами дослідження автори не виявили суттєвого сприятливого впливу препарату, що вони також пов’язують із одночасним застосуванням пробіотичного штаму й антибактеріальних препаратів. У той же час результати іншого метааналізу, де вивчалась ефективність інших пробіотиків, менш чутливих до антибактеріальних препаратів, зокрема таких як Lactobacillus і Bifidobacterium, свідчать, що застосування пробіотичних штамів зменшує тривалість епізодів гострої респіраторної інфекції та тривалість пропусків школи через захворювання [20]. Це дає можливість припустити, що використання Streptococcus salivarius K12 у вигляді монотерапії може бути більш ефективним і має враховуватись при плануванні подальших досліджень.
Висновки
Зважаючи на отримані результати, можна очікувати, що препарати на основі Streptococcus salivarius K12 можуть бути ефективними в схемах лікування гострих тонзилофарингітів у дітей. Подальші дослідження в більших групах пацієнтів необхідні для визначення оптимальних режимів застосування даного препарату.
Конфлікт інтересів. Не заявлений.
/35.jpg)

/36.jpg)
/37.jpg)
/38.jpg)