Резюме
У статті наведено результати експериментального дослідження з вивчення структурних порушень колінного суглоба та морфометричної оцінки суглобового хряща за умов введення збагаченої тромбоцитами плазми і концентрату аспірату кісткового мозку. Кролям виконували стандартне моделювання остеоартриту шляхом формування хрящового дефекту, пересічення передньої хрестоподібної зв’язки та резекції медіального меніска. Через 28 днів внутрішньосуглобово вводили 0,9% NaCl, або збагачену тромбоцитами плазму, або концентрат аспірату кісткового мозку, через 14 днів дослідним групам внутрішньосуглобово вводили 0,9% NaCl або збагачену тромбоцитами плазму. Через 2 місяці проведено гістологічне та морфометричне дослідження епіфізарної поверхні стегнової та великогомілкової кісток. За результатами досліджень у всіх тварин, яких досліджували, установлено ідентичний за діаметром дефект епіфізарного хряща, редукцію хондроцитів (на 55,1 %), зменшення товщини перифокальної суглобової поверхні (на 53,2 %) та відносної щільності кісткової тканини епіфіза кістки (на 48,5 %). Моделювання суглобового дефекту не обмежувалось зоною пошкодження і викликало дистрофічні зміни суглобового хряща великогомілкової кістки. За результатами статистичного аналізу введення збагаченої тромбоцитами плазми не позначилось на запобіганні дегенеративним змінам суглобової поверхні. У групі, у якій використовували концентрат аспірату кісткового мозку, установлено більшу товщину гіалінового хряща великогомілкової кістки на 15,3 % (Р < 0,05) порівняно з групою, де застосовували 0,9% NaCl, та групою з подвійним використанням збагаченої тромбоцитами плазми. При цьому відносна щільність субепіфізарної кісткової тканини в групах порівняння з остеоартритом не мала відмінностей.
В статье приведены результаты экспериментального исследования по изучению структурных нарушений коленного сустава и морфометрической оценки суставного хряща в условиях введения обогащенной тромбоцитами плазмы и концентрата аспирата костного мозга. Кроликам выполняли стандартное моделирование остеоартрита путем формирования хрящевого дефекта, пересечения передней крестообразной связки и резекции медиального мениска. Спустя 28 дней внутрисуставно вводили 0,9% NaCl, или обогащенную тромбоцитами плазму, или концентрат аспирата костного мозга, через 14 дней внутрисуставно вводили 0,9% NaCl или обогащенную тромбоцитами плазму. Через 2 месяца проведено гистологическое и морфометрическое исследование эпифизарной поверхности бедренной и большеберцовой костей. По результатам исследований у всех животных, которых исследовали, установлены идентичный по диаметру дефект эпифизарного хряща, редукция хондроцитов (на 55,1 %), уменьшение толщины перифокальной суставной поверхности (на 53,2 %) и относительной плотности костной ткани эпифиза кости (на 48,5 %). Моделирование суставного дефекта не ограничивалось зоной повреждения и вызвало дистрофические изменения суставного хряща большеберцовой кости. По результатам статистического анализа введение обогащенной тромбоцитами плазмы не отразилось на предотвращении дегенеративных изменений суставной поверхности. В группе, в которой использовали концентрат аспирата костного мозга, установлена большая толщина гиалинового хряща большеберцовой кости на 15,3 % (Р < 0,05) по сравнению с группой, где применяли 0,9% NaCl, и группой с двойным использованием обогащенной тромбоцитами плазмы. При этом относительная плотность субэпифизарнои костной ткани в группах сравнения с остеоартритом не различалась.
Background. The article presents the results of an experimental study on the knee joint structural changes and morphometric evaluation of articular cartilage with the injections of platelet rich plasma and bone marrow aspirate concentrate. Materials and methods. Cartilage defect creation, anterior cruciate ligament intersection and medial meniscus resection were performed for the induction of osteoarthritis in rabbits. After 28 days, 0.9% NaCl, or platelet rich plasma, or bone marrow aspirate concentrate was administered intra-articularly; 0.9% NaCl or platelet rich plasma was injected intra-articularly in 14 days. After 2 months, histological and morphometric examination of the epiphyseal surface of the femur and tibia was performed. Results. Animal models showed identical diameter of epiphyseal cartilage defect, chondrocyte reduction (by 55.1 %), reduction of periphocal articular surface thickness (by 53.2 %) and relative bone density of epiphysis (by 48.5 %). Modeling of the joint defect was not limited to the area of damage and caused degenerative changes of the articular cartilage of the tibia. Statistical analysis showed that the introduction of platelet rich plasma had no preventive effect on the degenerative changes in the articular surface. In the bone marrow aspirate concentrate group, the thickness of the hyaline cartilage of the tibia was found to be 15.3 % (P < 0.05) greater compared with the 0.9% NaCl group and the double platelet rich plasma group. However, the relative density of subepiphyseal bone tissue in the experimental groups with osteoarthritis had no differences. Conclusions. The effect of platelet rich plasma and bone marrow aspirate concentrate on knee joint structural changes in rabbit osteoarthritis models was investigated. Statistically significant preservation of the tibial cartilage height in the group of animals using bone marrow aspirate concentrate/platelet rich plasma was demonstrated.
Вступ
Остеоартрит (ОА) є найбільш поширеною формою дегенеративних захворювань суглобів й однією з основних причин болю й інвалідності в пацієнтів середнього та похилого віку [1]. Незважаючи на деякі успіхи в дослідженні патогенезу захворювання та артропластики колінного суглоба, досі не існує ефективного специфічного лікування остеоартриту [2]. Існує гіпотеза, що локальне застосування автологічних клітинних матеріалів може сприяти відновленню травмованих структур або зменшити прогресуюче пошкодження в колінному суглобі. За останнє десятиліття швидко розширилося застосування збагаченої тромбоцитами плазми та концентрату аспірату кісткового мозку. Підготовка їх концентратів вище фізіологічних показників розглядається як умова для стимулювання відновних процесів в ушкодженій ділянці [3]. Однак ефективність цих підходів є неоднозначною, деякі автори повідомляють про відсутність відновного процесу в експериментальних умовах [4], а інші — про зменшення больового синдрому при легкому та помірному остеоартриті [5]. Більшість авторів сходяться на думці, що застосування автологічних клітинних похідних не тільки є безпечним для використання, але й має потенціал для поліпшення відновлення як самостійний спосіб лікування і в комбінованому лікуванні [6]. Так, Krych et al. (2016) при аналізі використання штучного хряща показали краще збереження хряща через 1 рік в разі додаткового введення збагаченої тромбоцитами плазми або концентрату аспірату кісткового мозку.
Експериментальні моделі остеоартриту часто використовуються в дослідженнях механізмів розвитку прогресуючої дегенерації суглобового хряща та при оцінці впливу різних лікарських засобів та клітинних технологій щодо запобігання їй. Спонтанний розвиток остеоартриту в дослідних тварин є тривалим і, як правило, пов’язаний із віковими змінами та іншими факторами. Оцінка потенційної дії лікарських засобів передбачає однотипний характер розвитку дегенеративних змін у всіх досліджуваних випадках, тому застосування моделі шляхом формування хрящового дефекту, пересічення передньої хрестоподібної зв’язки та резекції медіального меніска дозволяють спричинити швидке, топографічно та морфометрично типове прогресуюче пошкодження суглобового хряща. У цьому дослідженні ми припустили, що введення збагаченої тромбоцитами плазми та концентрату аспірату кісткового мозку може вплинути на перебіг розвитку дегенеративних змін суглобового хряща колінного суглоба при остеоартриті.
Мета: дослідити вплив збагаченої тромбоцитами плазми та концентрату аспірату кісткового мозку на структурні зміни колінного суглоба після моделювання остеоартриту в кролів.
Матеріали та методи
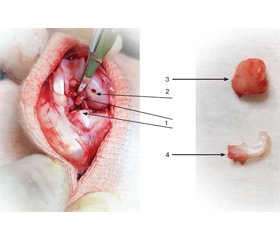
Експеримент проведений на 16 кролях-самцях лінії шиншила вагою 2,47 (2,25–2,70) кг. Вік тварин до початку експерименту був 11–12 місяців. Тварини утримувались у віварії НМАПО ім. П.Л. Шупика за умов вільного доступу до їжі та води. Спочатку випадковим чином тварин розподілено на чотири групи по 4 тварини: 1-ша — контрольна (інтактна); 2-га — модель остеоартриту + двократне внутрішньосуглобове введення фізіологічного розчину через 4 та 6 тижнів; 3-тя — модель остеоартриту + двократне внутрішньосуглобове введення збагаченої тромбоцитами плазми через 4 та 6 тижнів; 4-та — модель остеоартриту + внутрішньосуглобове введення концентрату червоного кісткового мозку через 4 тижні та збагаченої тромбоцитами плазми через 6 тижнів. Експериментальні умови на обох колінних суглобах у кожної тварини були ідентичні.
Модель остеоартриту: в умовах операційної віварію тварин наркотизували кетаміном 35 мг/кг в/м + ксилазином 5 мг/кг в/м. Колінні суглоби обстригали й обробляли антисептиками. Виконувався медіальний парапателярний доступ із вивихом наколінка. Модель остеоартриту полягала в механічному формуванні стандартного хрящового дефекту медіального виростка стегна, пересіченні передньої хрестоподібної зв’язки та резекції медіального меніска та жирового тіла.
Рани промивались водними розчинами антисептиків та вшивались наглухо нитками 3/0 (Vicryl, Ethicon Inc.) та в подальшому кожного дня оброблялись повідон-йодом (бетадин, Egis) до заживлення. Також проводилась антибіотикопрофілактика цефтріаксоном 40 мг/кг 1 раз/ добу 3 дні в/м (Basalt, Україна). Інфекційних чи інших післяопераційних ускладнень не виявлено.
Через 4 тижні: 1-ша група — контроль, інтактна; 2-га — під седацією виконано внутрішньосуглобове введення 0,5 мл 0,9% NaCl; 3-тя — під седацією забір із вушної вени вакутейнером 4,5 мл крові + 3,8% цитрату натрія. Центрифугування на 0,6 G 8 хв центрифугою Elmi CM-6M (Латвія). Розділення крові на шари, ручний забір 0,5 мл тромболейкоцитарного шару та внутрішньосуглобове введення; 4-та — під седацією забір із крила таза кістково-мозковою голкою 11G типу Jamshidi (Biomedical, Італія) у вакутейнер 4,5 мл червоного кісткового мозку + 3,8% цитрату натрія. Центрифугування на 0,6 G 8 хв центрифугою Elmi CM-6M (Латвія). Розділення червоного кісткового мозку на шари, ручний забір 0,5 мл багатого шару та внутрішньосуглобове введення.
Далі через 2 тижні: 1-ша група — інтактна, 2-га — повтор 0,5 мл 0,9% NaCl, 3-тя та 4-та групи — внутрішньосуглобове введення збагаченої тромбоцитами плазми.
Через 2 місяці після моделювання остеоартиту тварин виводили з експерименту шляхом введення летальної дози наркозу.
Робота з тваринами здійснювалася відповідно до правил Європейської конвенції про гуманне ставлення до лабораторних тварин, яких використовують для експериментальних та інших наукових цілей, а також відповідно до Законодавства України. Наукове дослідження схвалене та наданий дозвіл на його проведення комісією з питань етики НМАПО ім. П.Л. Шупика (протокол засідання № 11 від 19.11.2018 р.).
Епіфізи стегнової та великогомілкових кісток тварин виділяли для гістологічного та морфометричного досліджень. Демінералізацію зразків проводили в розчині OsteoFast 2 (BioGnost Ltd., Хорватія). Після відмивання усі зразки заливали в парафін (Leica Surgipath Paraplast Regular) за стандартною методикою. Одержували сагітальні парафінові зрізи, забарвлювали гематоксиліном з еозином, альціановим синім із пікрофуксином і досліджували на мікроскопі Olympus BX 51.
Морфометрично оцінювали діаметр дефекту (мкм), товщину перифокального суглобового хряща (мкм), відносну щільність субхондральної кісткової тканини [8]. Морфометрію проведено з використанням програми Carl Zeiss (AxioVision SE64 Rel.4.9.1), статистичну оцінку — за допомогою програми Origin Lab version 8.0. Міжгрупові відмінності оцінювали за непараметричним критерієм Крускала — Уолліса. Результати наведено у вигляді медіани з меншим та більшим квартилем (Mе [Q1–Q3]). Різницю вважали статистично вірогідною при P < 0,05.
Результати
Дефект суглобової поверхні був у всіх дослідних тварин 2–4-ї груп. Середній діаметр дефекту наведено в табл. 1. Статистично значущої різниці між групами порівняння не виявлено, що дозволило об’єктивно оцінити інші показники в досліджених зразках.
Хрящовий дефект характеризувався втратою гіалінового хряща, порушенням перифокального хряща і субхондральної кісткової тканини (рис. 3: 1, 3, 5). У деяких зразках ділянка дефекту була заповнена сполучною тканиною, що містить фібробласти, в деяких випадках реєстрували появу вогнищ ретикулярної тканини. Новоутворену фіброретикулярну тканину також реєстрували за межами контуру суглобового хряща, вона також покривала тонким шаром поверхню хряща. Останнє пояснюється міграцією клітин із субхондральної ділянки через наскрізний дефект. У деяких зразках зменшилась щільність червоного кісткового мозку, відбулось заміщення сполучною тканиною. Навколо дефекту реєстрували крововиливи і новоутворені стазовані судини. На рівні дефекту відбулась тотальна редукція хряща, тому оцінено лише середній діаметр цих зон. При цьому в перифокальному епіфізарному хрящі відмічено часткове збереження хондромукоїду й ізогенних груп хондроцитів, хоча структура хряща була різко змінена. Основними змінами були зменшення товщини, редукція клітинного складу, що пов’язано з дегенеративними змінами. Морфологічно це виявлено як порожні лакуни, позбавлені хондроцитів, або клітини з пікнозом. При забарвленні альціановим синім, що реагує з кислими сульфатованими глікозамінгліканами, виявлено зменшення інтенсивності реакції перицелюлярної ділянки хондромукоїду. Дегенеративні зміни хряща радіально прогресували від зони механічного пошкодження, і більшою мірою зазнавали пошкодження поверхневі шари гіалінового хряща (рис. 3: 2, 4, 6). У глибоких шарах хряща реєстрували деструктивні зміни з ремоделюванням хондромукоїду і кісткової тканини з формуванням лакун. При цьому метафізарний хрящ залишався відносно збереженим, тобто дегенеративні зміни на застосованій моделі остеоартриту обмежувались епіфізом кістки.
/35.jpg)
Дистрофічні зміни хондроцитів у перифокальній зоні були меншими, ніж у ділянці дефекту. Характерним проявом прогресуючих дегенеративних змін були швидша редукція хондроцитів над деструктивними змінами хондромукоїду. Це добре ілюстровано на рис. 4: 2. Аналіз щільності хондроцитів у тест-зонах хрящової поверхні довжиною 1000 мкм показав міжгрупову різницю між групою 2 і групами 3 і 4 на 45,8 і 38,3 % відповідно, P < 0,05, тоді як із контролем — на 53,3 і 61,2 % (P < 0,05) (табл. 3).
За результатами морфометрії товщина перифокального хряща через 2 місяці після моделювання дефекту зменшилась на 53,2 % порівняно з контрольною групою (Р < 0,05). У групі 3 і 4 не виявлено статистичної різниці щодо групи 2 (табл. 2). При цьому аналіз епіфіза великогомілкової кістки показав статистично значимо більшу товщину в групі 4 щодо групи 2 — на 15,3 % (Р < 0,05), що вказує на часткове запобігання прогресуючим дегенеративним змінам суглобового хряща (табл. 1).
Проявом відновного процесу можу бути збільшення щільності кісткового мозку й активація ангіогенезу (зразок 7, правий суглоб). Зміни суглобового хряща великогомілкової кістки були подібними до описаних порушень, відмінність тільки в тому, що дегенеративні зміни хряща більшою мірою були зосереджені в поверхневих шарах, але локальні пошкодження хряща також реєстрували, що позначилось на субхондральній кістці.
Гістологічний та морфометричний аналіз субхондральної кісткової тканин показав її часткову деструкцію, що пов’язано як із механічним пошкодженням, так і з частковою резорбцією трабекулярної кістки. Усереднена групова різниця відносної щільності становила 16,8 % на рівні стегнової кістки і 22,5 % на рівні великогомілкової кістки. Статистично значущої різниці між дослідними групами порівняння не виявлено (табл. 2).
Обговорення
В експериментах ми досліджували структурні зміни суглобової поверхні хряща після моделювання локального дефекту за допомогою гістологічних та морфометричних методів. Як було описано, на морфологічному рівні зона дефекту не обмежувалась лише суглобовим хрящем і порушення зачепили субхондральну частину епіфіза кістки. Порушення гіалінового хряща полягали в загибелі хондроцитів, редукції їх кількості в хрящі, у результаті чого реєстрували порожні (безклітинні) лакули, деструктивні зміни хондромукоїду також позначились на пошкодженні та товщині суглобової поверхні. Ми вважаємо, що першочергово це відбувалось у поверхневих шарах хряща, а далі, із переходом пошкодження в субхондральну кісткову тканину, відбувалась резорбція кістки і глибоких шарів хряща. Так, виявлено зміну контуру «хрящ/кісткова тканина» у бік суглобової поверхні, порожні лакуни в хрящі з макрофагами.
/38_2.jpg)
Подібні зміни зазначали Z. Liu та ін. (2016), ними виявлено нерегулярність поверхні з 2-го тижня, а критичну дегенерацію хряща — з 4-го тижня після моделювання остеоартриту (тріщини, втрата матриксу хряща, редукція товщини). Зрозуміло, що втрата хондроцитів різко зменшує потенціал до відновлення хряща, тому підтримка хрящової тканини може потенційно вплинути на перебіг дегенеративних процесів. На жаль, у власних експериментах ми не виявили статистично значущої різниці в групі зі збагаченою тромбоцитами плазмою, дистрофічні зміни продовжувались, як у групі з остеоартритом, хоча тенденція збереження хряща була відмічена (нерегулярна деформація поєднувалась із ділянками відносно збереженого хондромукоїду). Було встановлено часткове збереження кількості хондроцитів, реєструються ізогенні групи в гіаліновому хрящі, але це не позначилось на збереженні всієї товщини суглобового хряща. Дегенеративні зміни прогресували, і в перифокальних ділянках і навіть у поверхневих шарах хряща великогомілкової кістки виявлено редукцію хондроцитів і деструктивні зміни хондромукоїду. У групі з концентратом аспірату кісткового мозку товщина хрящової поверхні виявились вірогідно більшою тільки на епіфізі великогомілкової кістки, але морфологічні зміни в субхондральній кістці, очевидно, мали аналогічний перебіг, як у групі без введення досліджуваних засобів. Редукція щільності кісткової тканини поєднувалась із втратою кісткового мозку, хоча у 2 зразках із PRP/PRP і BMAC/PRP відмічено відносне збереження ретикулярної тканини кісткового мозку та появу новоутворених судин, що є свідченням трофічного впливу.
Висновки
Досліджено вплив збагаченої тромбоцитами плазми та концентрату аспірату кісткового мозку на структурні зміни колінного суглоба після моделювання остеоартриту в кролів.
Продемонстровано статистично значиме збереження висоти хряща великогомілкової кістки в групі тварин із внутрішньосуглобовим введенням BMAC/PRP через 2 місяці з початку експерименту. Введення збагаченої тромбоцитами плазми та концентрату червоного кісткового мозку позитивно впливає на стан структур колінного суглоба при моделюванні остеоартриту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Gregory M.H., Capito N., Kuroki K., Stoker A.M., Cook J.L., Sherman S.L. A review of translational animal models for knee osteoarthritis. Arthritis. 2012. 2012. 764621. doi: 10.1155/2012/764621.
2. Helito C.P., Bonadio M.B., Sobrado M.F. et al. Comparison of Floseal® and Tranexamic Acid for Bleeding Control after Total Knee Arthroplasty: a Prospective Randomized Study. Clinics (Sao Paulo). 2019. 74. e1186. Published 2019 Nov 25. doi: 10.6061/clinics/2019/e1186.
3. Rughetti A., Giusti I., D’Ascenzo S., Leocata P., Carta G., Pavan A., Dell’Orso L., Dolo V. Platelet gel-released supernatant modulates the angiogenic capability of human endothelial cells. Blood Transfus. 2008. 6(1). Р. 12-17.
4. Fleming B.C., Proffen B.L., Vavken P., Shalvoy M.R., Machan J.T., Murray M.M. Increased platelet concentration does not improve functional graft healing in bio-enhanced ACL reconstruction. Knee Surg Sports Traumatol Arthrosc. 2015. 23(4). Р. 1161-70.
5. Campbell K.A., Saltzman B.M., Mascarenhas R., Khair M.M., Verma N.N., Bach B.R. Jr, Cole B.J. Does intra-articular platelet-rich plasma injection provide clinically superior outcomes compared with other therapies in the treatment of knee osteoarthritis? A systematic review of overlapping meta-analyses. Arthroscopy. 2015. 31(10). Р. 2036-45.
6. Moatshe G., Morris E.R., Cinque M.E. et al. Biological treatment of the knee with platelet-rich plasma or bone marrow aspirate concentrates. Acta Orthop. 2017. 88(6). Р. 670-674. doi: 10.1080/17453674.2017.1368899.
7. Krych A.J., Nawabi D.H., Farshad-Amacker N.A., Jones K.J., Maak T.G., Potter H.G., Williams R.J. 3rd. Bone marrow concentrate improves early cartilage phase maturation of a scaffold plug in the knee: A comparative magnetic resonance imaging analysis to platelet-rich plasma and control. Am. J. Sports Med. 2016. 44(1). Р. 91-8.
8. Ткачук П.В., Страфун С.С., Кучменко О.Б. и др. Оценка влияния тромбоцитарной плазмы на биохимические показатели крови в экспериментальной модели остеоартроза коленного сустава. Травма. 2019. 20(4). C. 39-45.
9. Liu Z., Hu X., Man Z., Zhang J., Jiang Y., Ao Y. A novel rabbit model of early osteoarthritis exhibits gradual cartilage degeneration after medial collateral ligament transection outside the joint capsule. Sci. Rep. 2016. 6. 34423. Published 2016 Oct 19. doi: 10.1038/srep34423.
/38_2.jpg)

/33.jpg)
/34.jpg)
/35.jpg)
/36.jpg)
/37.jpg)
/38.jpg)