Резюме
Актуальність. Проблема розвитку та прогресування хронічних дифузних захворювань печінки є однією з найважливіших у сучасній гастроентерології, має загальномедичне та соціальне значення. Мета: визначити особливості показників функціонального стану печінки, імунної ланки, цитокінової регуляції та вуглеводного обміну у хворих на хронічні дифузні захворювання печінки алкогольного та медикаментозного генезу. Матеріали та методи. Під спостереженням було 50 хворих на хронічні дифузні захворювання печінки: 27 пацієнтів з алкогольною хворобою печінки (АХП), серед яких 16 (59,3 %) чоловіків та 11 (40,7 %) жінок, середній вік становив (37,6 ± 2,4) року; 23 обстежені із токсичним медикаментозним гепатитом (ТМГ) — 6 чоловіків (26,1 %) та 17 (73,9 %) жінок віком (49,2 ± 3,1) року. Усім хворим проведено біохімічне та імунологічне дослідження крові. Також визначали рівень інтерлейкіну-6 (ІЛ-6), інтерлейкіну-10 (ІЛ-10), тумор-некротизуючого фактора росту α (TNF-α), індекс HOMA-IR. Результати. Для більшості хворих на АХП та ТМГ характерна наявність цитолітичного та холестатичного синдромів, переважно мінімального ступеня активності. Ознаки гіперкоагуляції були встановлені у 2 рази частіше серед пацієнтів з АХП, ніж серед хворих із ТМГ (χ2 = 4,43; р < 0,05). При медикаментозному ураженні печінки у 6,5 раза частіше спостерігалось підвищення рівня протромбінового індексу (χ2 = 10,87; р < 0,01). У пацієнтів з медикаментозним ураженням печінки встановлено вірогідне зниження кількості Т-кілерів в 1,8 раза (р < 0,05) відносно групи контролю, тоді як у хворих на АХП визначено активацію гуморальної ланки імунітету. При алкогольному ураженні печінки мало місце вірогідне збільшення ІЛ-6, TNF-α, співвідношення прозапальних і протизапальних цитокінів, розвиток інсулінорезистентності, в той час як для хворих із ТМГ характерним було суттєве зниження ІЛ-10. Висновки. Проведений аналіз особливостей функціонального стану печінки, імунної ланки, цитокінової регуляції та вуглеводного обміну в обстежених хворих дозволив виявити показники, які можна розглядати як лабораторні маркери розвитку та прогресування токсичних уражень печінки.
Актуальность. Проблема развития и прогрессирования хронических диффузных заболеваний печени в настоящее время является одной из наиболее важных в современной гастроэнтерологии, имеет общемедицинское и социальное значение. Цель: определить особенности показателей функционального состояния печени, иммунного звена, цитокиновой регуляции и углеводного обмена у больных хроническими диффузными заболеваниями печени алкогольного и медикаментозного генеза. Материалы и методы. Под наблюдением было 50 больных хроническими диффузными заболеваниями печени: 27 пациентов с алкогольной болезнью печени (АБП), среди которых 16 (59,3 %) мужчин и 11 (40,7 %) женщин, средний возраст составил (37,6 ± 2,4) года; 23 обследованных с токсическим медикаментозным гепатитом (ТМГ) — 6 мужчин (26,1 %) и 17 (73,9 %) женщин в возрасте (49,2 ± 3,1) года. Всем больным проведено биохимическое и иммунологическое исследование крови. Также определяли уровень интерлейкина-6 (ИЛ-6), интерлейкина-10 (ИЛ-10), тумор-некротизирующего фактора роста α (TNF-α), индекс HOMA-IR. Результаты. Для большинства больных АБП и ТМГ характерно наличие цитолитического и холестатического синдромов, преимущественно минимальной степени активности. Признаки гиперкоагуляции были установлены в 2 раза чаще среди пациентов с АБП, чем среди больных с ТМГ (χ2 = 4,43; р < 0,05). При медикаментозном поражении печени в 6,5 раза чаще наблюдалось повышение уровня протромбинового индекса (χ2 = 10,87; р < 0,01). У пациентов с медикаментозным поражением печени установлено достоверное снижение количества Т-киллеров в 1,8 раза (р < 0,05) относительно группы контроля, тогда как у больных АХП определена активация гуморального звена иммунитета. При алкогольном поражении печени имело место достоверное увеличение ИЛ-6, TNF-α, соотношение провоспалительных и противовоспалительных цитокинов, развитие инсулинорезистентности, в то время как для больных с ТМГ характерно существенное снижение ИЛ-10. Выводы. Проведенный анализ особенностей функционального состояния печени, иммунного звена, цитокиновой регуляции и углеводного обмена у обследованных больных позволил выявить показатели, которые можно рассматривать в качестве лабораторных маркеров развития и прогрессирования токсических поражений печени.
Background. The problem of the development and progression of chronic diffuse liver diseases is currently one of the most important in modern gastroenterology, it has general medical and social significance. The purpose was to determine the features of indicators of the functional state of the liver, immune link, cytokine regulation and carbohydrate metabolism in patients with alcohol-related and drug-induced chronic diffuse liver diseases. Materials and methods. There were 50 patients with chronic diffuse liver diseases under the supervision: 27 patients with alcoholic liver disease — 16 (59.3 %) men and 11 (40.7 %) women with the average age of (37.6 ± 2.4) years; and 23 individuals with toxic drug-induced hepatitis — 6 (26.1 %) men and 17 (73.9 %) women aged (49.2 ± 3.1) years. All patients underwent biochemical and immunological blood tests. The levels of interleukin 6 (IL-6), IL-10, tumor necrosis factor α (TNF-α), and the HOMA-IR were also determined. Results. Most patients with alcoholic liver disease and toxic drug-induced hepatitis are characterized by the presence of cytolytic and cholestatic syndromes, mainly of a minimal degree of activity. Signs of hypercoagulation were found 2 times more often among patients with alcoholic liver disease than among those with toxic drug-induced hepatitis (χ2 = 4.43; p < 0.05). In drug-induced liver injury, an increase in the level of prothrombin index was observed 6.5 times more often (χ2 = 10.87; p < 0.01). A significant 1.8-fold decrease in the number of T-killers (p < 0.05) was found in patients with drug-induced liver injury compared to the control group, while in patients with alcoholic liver disease, the activation of the humoral immunity was determined. There was a significant increase in IL-6, TNF-α, the ratio of pro-inflammatory and anti-inflammatory cytokines, the development of insulin resistance in persons with alcohol-related liver damage, while a significant decrease in IL-10 was typical for patients with toxic drug-induced hepatitis. Conclusions. The analysis of the features of the functional state of the liver, immune link, cytokine regulation and carbohydrate metabolism in the examined patients revealed indicators that can be considered laboratory markers for the development and progression of toxic liver lesions.
Вступ
Проблема розвитку та прогресування хронічних дифузних захворювань печінки (ХДЗП) є однією з найважливіших у сучасній гастроентерології, має загальномедичне та соціальне значення [1]. Актуальність проблеми обумовлена збільшенням кількості хворих зі вказаною патологією, особливо серед осіб працездатного віку, а також посиленням впливу різноманітних факторів ризику (алкоголізм, безконтрольне вживання гепатотоксичних лікарських засобів, складні соціально-економічні умови та екологічне неблагополуччя) [2].
Алкогольне ураження печінки та його ускладнення залишаються однією з найчастіших причин смерті в Європі та США, а розуміння епідеміології алкогольної хвороби печінки (АХП) як світової проблеми ще далеке від вирішення. Відомо, що алкогольне ураження печінки — це результат складної взаємодії між продуктами метаболізму алкоголю, запальними та імунними реакціями, оксидантним стресом, процесами фіброгенезу, порушеннями регенерації гепатоцитів [3]. Україна належить до країн середньовисокого рівня вживання алкоголю (12 л на людину за рік), посідаючи п’яте місце у світі. Спектр алкоголь-асоційованого ураження печінки являє собою послідовність від неускладненого стеатозу (90–95 %) та алкогольного стеатогепатиту до хронічного гепатиту (20–40 %) та цирозу печінки (8–20 %) з ускладненнями, такими як асцит, кровотечі, пов’язані з портальною гіпертензією, та печінкова енцефалопатія. Згідно з даними ВООЗ, 3,3 мільйона смертей у світі, тобто 6 % усіх глобальних смертей, пов’язані із вживанням алкоголю [4, 5].
Оскільки АХП є діагнозом виключення, для діагностування споживання алкоголю можуть бути корисними біомаркери алкоголю. Серед біохімічних тестів — середній корпускулярний об’єм еритроцитів, амінотрансферази і γ-глутамілтрансфераза є чутливими тестами, але недостатньо специфічними у пацієнтів із цирозом печінки [6]. Вуглеводневий трансферин у комбінації з γ-глутамілтрансферазою має чутливість близько 75–90 %. Проте рівень вуглеводневого трансферину може бути асоційований зі зростанням тяжкості захворювання та активним курінням [7]. Новіші біомаркери, що використовують метаболіти алкоголю, такі як етилглюкуронід, можуть підтвердити вживання алкоголю через 3–4 дні після останнього вживання алкоголю [8].
Останніми роками спостерігається чітка тенденція до збільшення числа токсичного медикаментозного гепатиту (ТМГ) внаслідок зростаючої експансії фармацевтичного ринку. Причиною розвитку лікарських уражень печінки можуть бути понад 1200 лікарських засобів, близько 200 з яких — потенційно гепатотоксичні препарати. За даними фармакоепідеміологічних досліджень, ТМГ найчастіше розвиваються на тлі лікування онкологічних хворих, застосування нестероїдних протизапальних засобів, антимікробних препаратів і ліків, які впливають на центральну нервову систему, що обумовлено не тільки їх потенційною гепатотоксичністю, а й широким застосуванням. 40 % усіх випадків ТМГ спостерігається у пацієнтів віком понад 40 років. Водночас ТМГ ускладнюють проведену фармакотерапію в 1–28 % випадків і в 12–25 % випадків сприяють розвитку цирозу печінки і печінкової недостатності [9].
Крім того, проблема медикаментозного ураження печінки набуває актуальності у зв’язку з широким самостійним використанням біологічно активних добавок, побічні ефекти яких становлять 10 % побічних реакцій організму [10]. ТМГ часто не має особливостей і має перебіг за типом метаболічної або імунологічної ідіосинкразії, тобто пов’язаний з індивідуальною чутливістю конкретного організму, яку неможливо прогнозувати.
За активністю аланінамінотрансферази та лужної фосфатази визначають три типи медикаментозного ураження: гепатоцелюлярний, холестатичний та змішаний. Однак різноманітність механізмів медикаментозного впливу обумовлює багатогранність їх клінічних варіантів (гепатопатії): лікарський стеатоз і стеатогепатит, гострий і хронічний лікарський гепатит, мітохондріальні цитопатії, лікарсько-індукований фіброз печінки, лікарсько-індукований холестаз, лікарсько-індукований склерозуючий холангіт, фосфоліпідоз, ураження судин печінки, ураження печінки за типом реакцій гіперчутливості, некроз гепатоцитів, фульмінантний гепатит [11].
Відомо, що чим вища активність гепатиту, тим швидше розвивається фіброз та цироз, які супроводжуються різноманітними ускладненнями [12]. Але механізми, що лежать в основі розвитку хвороби та її прогресування, очікують на уточнення. Наукові дослідження останніх років виявили тісний зв’язок порушень в імунній системі та формуванні патології гепатобіліарної системи [13], а саме імунодефіцит сприяє хронізації патологічного процесу та обумовлює появу супутньої патології [14]. Крім того, важливу роль у регуляції захисних реакцій організму відіграють цитокіни, що зумовлюють широкий спектр біологічних ефектів, регулюють розвиток місцевих запальних процесів у тканинах з участю різних типів клітин крові, ендотелію, сполучної тканини й епітелію, у межах імунної системи здійснюють зв’язок між неспецифічними захисними реакціями і специфічним імунітетом. На рівні організму цитокіни забезпечують міжклітинну взаємодію в імунній системі, здійснюють зв’язок між імунною, ендокринною, нервовою та іншими системами, забезпечують їх залучення в організацію і регуляцію захисних реакцій [15]. Тому визначення їх концентрації в крові дає інформацію про функціональну активність різних типів імунокомпетентних клітин, про тяжкість запального процесу, його переходу на системний рівень і про прогноз захворювання [16].
Ефективність проведеного лікування хворих на ХДЗП залежить від усунення етіологічного чинника хвороби, що обумовлює доцільність ранньої диференціальної діагностики та персоніфікованого підходу до вибору лікувальної тактики у хворих на ХДЗП токсичного генезу.
Мета: визначити особливості показників функціонального стану печінки, імунної ланки, цитокінової регуляції та вуглеводного обміну у хворих на хронічні дифузні захворювання печінки алкогольного та медикаментозного генезу.
Матеріали та методи
Під спостереженням було 50 хворих на ХДЗП віком від 19 до 66 років: серед них 28 жінок (56,0 %) та 22 чоловіки (44,0 %), які перебували на лікуванні у відділенні захворювань печінки та підшлункової залози ДУ «Інститут гастроентерології НАМН України». Подані для публікації матеріали не заперечують положенням біоетики.
Першу (І) групу становили 27 пацієнтів з АХП, серед яких 16 (59,3 %) чоловіків та 11 (40,7 %) жінок, середній вік яких дорівнював (37,6 ± 2,4) року. До другої (ІІ) групи ввійшли 23 обстежені із ТМГ — 6 чоловіків (26,1 %) та 17 (73,9 %) жінок віком (49,2 ± 3,1) року. Контролю групу становили 20 практично здорових людей.
Усім хворим проведено біохімічне дослідження крові з визначенням аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), вмісту загального білірубіну, лужної фосфатази (ЛФ), γ-глутамілтрансферази (ГГТ), загального білка, протромбінового індексу (ПТІ), міжнародного нормалізованого відношення (МНВ) та фібриногену. Крім того визначали субпопуляційний склад лімфоцитів за допомогою моноклональних антитіл до молекул СD3, СD22, СD4, СD8, СD16; циркулюючі імунні комплекси (ЦІК); рівень інтерлейкіну-6 (ІЛ-6), інтерлейкіну-10 (ІЛ-10), тумор-некротизуючого фактора росту α (TNF-α), інсуліну в сироватці крові та показник інсулінорезистентності за допомогою індексу HOMA-IR.
Статистичний аналіз отриманих даних проводили за допомогою пакета прикладних програм Statistica 6.1. Порівняння кількісних показників, що представлені середнім значенням (M) та його помилкою (m), здійснювали за допомогою t-критерію Стьюдента; даних, які описані медіаною (Ме) та квартилями (Q1; Q2) — за допомогою U-критерію Манна — Уїтні. Для порівняння якісних даних використовували критерій хі-квадрат із поправкою Єйтса (χ2). Статистичну значимість різниці оцінювали на рівні, не нижчому, ніж 95,0 % (вірогідність помилки — р < 0,05). Для з’ясування характеру зв’язку між досліджуваними показниками використовували ранговий коефіцієнт кореляції Спірмена (r).
Результати
У І групі цитолітичний синдром встановлений майже у 3/4 хворих: більше ніж у половини пацієнтів через мінімальний ступінь запалення з підвищенням активності АЛТ у 2,8 раза (р < 0,001) та у поодиноких хворих — помірної та вираженої активності запального процесу зі зростанням АЛТ у 4,4 та 8,3 раза відповідно (р < 0,001) (рис. 1).
Зростання активності АСТ в 4,4 раза (р < 0,001) визначалось дещо менше ніж у половини хворих, але вказувало на більш глибоке ураження гепатоцитів із руйнуванням мітохондріальних структур (табл. 1).
Збільшення рівня ГГТ як ознаки печінкового холестазу в 6,3 раза (р < 0,01) спостерігалось у переважної більшості хворих на АХП. Підвищення вмісту ЛФ в 1,6 раза діагностовано у 3 (11,1 %) хворих групи. Підвищення рівня загального білірубіну визначалось майже у третини хворих. Ознаки гепатоцелюлярної недостатності та порушень синтетичної функції печінки за результатами визначення ПТІ, МНВ у хворих І групи спостерігались в поодиноких випадках, тоді як схильність до гіперкоагуляції внаслідок підвищення вмісту фібриногену визначена у більше ніж половини хворих. Рівень загального білка в усіх пацієнтів був у нормі. Незначна гіперглікемія встановлена в трьох випадках.
/24.jpg)
У хворих на ТМГ з боку показників цитолізу та холестазу спостерігались зміни, подібні до змін у І групі. Так, підвищення активності АЛТ у переважній більшості обстежених цієї групи в 2,2 раза порівняно з контролем (р < 0,01) свідчило про запалення гепатоцитів та їх руйнування. При цьому мінімальна активність запального процесу зі зростанням АЛТ у 1,5 раза (р < 0,01) встановлена майже у 2/3 хворих, а помірна активність (до 4 норм, р < 0,01) — майже у п’ятої частини пацієнтів. Активність АСТ у ІІ групі майже у половини хворих перевищувала контроль в 2,3 раза (р < 0,01). Наявність печінкового холестазу майже у 2/3 групи підтверджувалась зростанням рівня ГГТ у 3,1 раза порівняно з контролем (р < 0,01), однак його вираженість була в 2,1 раза нижчою за показник І групи (р < 0,05). Активність ЛФ підвищувалась в 1,9 раза (р < 0,01) у кожного п’ятого з обстежених. Гіпербілірубінемія спостерігалась лише в двох випадках. Недостатність синтетичної функції печінки зі зниженням ПТІ та підвищенням МНВ встановлена лише у п’ятої частини хворих. При цьому схильність до гіперкоагуляції зі зростанням ПТІ в 1,2 раза (р < 0,05) спостерігалась у половини хворих групи. Підвищення рівня глюкози крові визначалось у кожного п’ятого.
Оцінка імунологічних показників показала, що найбільша кількість лейкоцитів підвищена у 5 (18,5 %) хворих І групи та 5 (21,7 %) осіб ІІ групи. Водночас у 19 (70,4 %) пацієнтів І групи та у 20 (87,0 %) хворих ІІ групи встановлено вірогідно знижений відносний уміст Т-загальних лімфоцитів. У хворих із ТМГ медіана відносного рівня Т-лімфоцитів була вірогідно нижче, ніж у пацієнтів І групи (табл. 2).
Зважаючи на те, що клітинний імунітет забезпечується сенсибілізованими Т-лімфоцитами, а в обстежених групах хворих Т-клітини знижені, можна вважати, що у них імунна відповідь має депресивний характер. Імунна система може бути пригнічена внаслідок інтоксикації організму, а саме алкоголь (r = –0,330; р < 0,05) та токсичне ураження (r = –0,339; р < 0,05) сприяють зниженню рівня Т-лімфоцитів у обстежених хворих на ХДЗП.
У 17 (63,0 %) хворих І групи та у 19 (82,6 %) пацієнтів ІІ групи спостерігали значне зниження Т-хелперної субпопуляції. Поряд із цим мало місце вірогідне зниження медіани відносних показників СD4+-лімфоцитів у І групі в 1,4 раза (р < 0,05), у ІІ групі — в 1,3 раза (р < 0,05) порівняно з контрольною групою.
Слід відзначити, що у хворих на ТГМ встановлено вірогідне зниження кількості СD16+-лімфоцитів в 1,8 раза (р < 0,05) відносно групи контролю, тоді як у хворих на АХП визначена тенденція до зниження його рівня.
До того ж збільшення відносного та абсолютного вмісту СD22+-клітин у 1,5 раза в пацієнтів з АХП вказує на активацію гуморальної ланки імунітету, водночас у хворих ІІ групи це збільшення було невірогідне. Надлишок антитіл сприяє посиленню цитотоксичних реакцій і призводить до імунокомплексного ураження печінки. Ліпопротеїнові мембрани гепатоцитів можуть набути властивості чужорідного антигена, що індукує атаку Т-кілерів, що закінчується лізисом клітин-мішеней, тобто паренхіми печінки.
Важливе прогностичне значення в перебігу процесу має співвідношення лімфоцитів СD4/СD8 — імунорегуляторний індекс. Порушення індексу імунорегуляції у вигляді його зниження встановлено у 15 (55,6 %) хворих на АХП та в 11 (47,8 %) пацієнтів із ТМГ. Поряд з цим в 4 (17,4 %) випадках у ІІ групі спостерігалось підвищення індексу імунорегуляції.
Слід відзначити, що у 16 (59,3 %) хворих І групи та у 14 (60,9 %) пацієнтів ІІ групи рівень ЦІК був вірогідно підвищений в 1,8 (р < 0,05) та 1,5 раза (р < 0,05) відносно групи контролю. Отже, при надмірному накопиченні ЦІК можливий перехід у бік патології, що обумовлений підвищенням біологічної активності імунних комплексів і, за особливих умов, вони можуть відігравати важливу роль в патогенезі ХДЗП, на що вказує кореляційний зв’язок між рівнем ЦІК та рівнем цитолітичних ферментів — АЛТ (r = 0,48, р < 0,05).
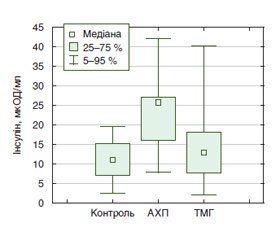
Аналіз показників вуглеводного обміну показав вірогідне збільшення в 2,3 раза (р < 0,05) рівня інсуліну у хворих І групи відносно показників групи контролю та в 2 рази (р < 0,05) відносно хворих ІІ групи (рис. 2): медіанні значення для пацієнтів з АХП становили 25,7 мкОД/мл (16,3; 26,8), з ТМГ — 12,7 мкОД/мл (9,3; 18,0) та для хворих групи контролю — 11,0 мкОД/мл (6,3; 15,0). За результатами кореляційного аналізу, вміст інсуліну корелював із рівнем АЛТ (r = 0,52; р < 0,01) та АСТ (r = 0,49; р < 0,05).
Значення індексу HOMA-IR у хворих І групи в 22 (81,5 %) випадках були вище 3,0, що у 2 рази частіше порівняно з ІІ групою пацієнтів — 9 (39,1 %) випадків (χ2 = 9,46; р < 0,01). Тому медіанні значення в групі з АХП в 2,3 раза (р < 0,05) були вищими порівняно з контролем: 4,9 (3,8; 7,1) проти 2,1 (1,8; 2,2) (рис. 3). До того ж у групі пацієнтів з АХП встановлено прямий кореляційний зв’язок між HOMA-IR та рівнем АЛТ (r = 0,47; р < 0,01).
/25_2.jpg)
За оцінкою стану прозапальних цитокінів при патології гепатобіліарної системи токсичного генезу виявлено деякі особливості. Так, рівень ІЛ-6 був підвищений у 12 (44,4 %) хворих І групи, що майже в 5 разів частіше, ніж у ІІ групі — 2 (8,7 %) (χ2 = 7,87; р < 0,01). Через це медіана цього показника у пацієнтів з АХП була вище в 1,7 раза (р < 0,05) порівняно з контрольною групою (табл. 3), що вказує на прогресування запальних процесів у даної категорії хворих. Крім того, в І групі концентрація TNF-α була в 2,2 раза (р < 0,05) вищою порівняно з контрольною групою та в 5 разів (р < 0,05) — порівняно з ІІ групою. Водночас рівень ІЛ-10 у хворих І групи статистично не відрізнявся від значень норми, а у хворих ІІ групи був вірогідно знижений в 2,8 раза (р < 0,05).
/26.jpg)
Унаслідок визначення співвідношення рівня прозапальних та протизапальних цитокінів (TNF-α/ІЛ-10) були встановлені зміни їх балансу в бік прозапальних цитокінів у хворих на АХП, а саме збільшення в 3,1 раза (р < 0,05) порівняно з групою контролю та в 3,7 раза (р < 0,05) порівняно з пацієнтами з ТМГ. За результатами кореляційного аналізу було встановлено, що у хворих на АХП порушення співвідношення TNF-α/ІЛ-10 пов’язане з метаболічними порушеннями — підвищенням індексу HOMA-IR (r = 0,41, р < 0,01).
Обговорення
Печінка є основним органом, в якому відбувається метаболізм більшості токсичних речовин, які надходять в організм різними шляхами, переважно через шлунково-кишковий тракт. Тому токсичні ураження печінки залишаються однією з важливих проблем сучасної гепатології. В нашому дослідженні для близько 80 % хворих на ХДЗП токсичного генезу був характерний цитолітичний синдром переважно мінімального ступеня активності. Ознаки холестазу з підвищенням вмісту ГГТ визначались у 81,5 % хворих на АХП та 60,9 % пацієнтів із ТМГ. Ознаки гіперкоагуляції були встановлені у 2 рази частіше серед пацієнтів з АХП, ніж серед хворих із ТМГ (χ2 = 4,43; р < 0,05). Водночас характерним для медикаментозного ураження печінки було підвищення рівня ПТІ (χ2 = 10,87; р < 0,01). Відомо, що для токсичного ураження печінки характерна гіпербілірубінемія, проте, за нашими даними, вона мала місце лише у третини хворих на АХП та у двох пацієнтів із ТМГ.
В окремих працях показано, що недостатність клітинного імунітету сприяє формуванню структурних змін печінки. За результатами проведеного дослідження у хворих на ХДЗП токсичного генезу виявлено дисбаланс Т-клітинного імунітету з гіпосупресією CD3, CD4, CD16, підвищенням рівня цитотоксичних CD8-лімфоцитів, зниженням імунорегуляторного індексу. У пацієнтів з АХП був вірогідно підвищений ЦІК — фізіологічний продукт реакції антиген-антитіло, який є інтегральним показником розвитку гуморальної імунної відповіді. До того ж порушення вуглеводного обміну у вигляді інсулінорезистентності також були більш виражені у хворих на АХП.
Відомо, що розвиток запальної реакції відбувається при порушенні цитокінового статусу. В нашій роботі ми спостерігали вірогідне збільшення ІЛ-6, TNF-α та співвідношення прозапальних і протизапальних цитокінів у пацієнтів з АХП, в той час як для хворих із ТМГ характерним було суттєве зниження ІЛ-10.
Отже, проведений аналіз особливостей функціонального стану печінки, імунної ланки, цитокінової регуляції та вуглеводного обміну у хворих на ХДЗП дозволив виявити показники, які можна розглядати як лабораторні маркери розвитку та прогресування токсичних уражень печінки.
Висновки
1. Для більшості хворих на АХП і ТМГ характерна наявність цитолітичного та холестатичного синдромів, переважно мінімального ступеня активності. Ознаки гіперкоагуляції були встановлені у 2 рази частіше серед пацієнтів з АХП, ніж серед хворих із ТМГ (χ2 = 4,43; р < 0,05). При медикаментозному ураженні печінки у 6,5 раза частіше спостерігалось підвищення рівня ПТІ (χ2 = 10,87; р < 0,01).
2. У пацієнтів з медикаментозним ураженням печінки встановлено вірогідне зниження кількості Т-кілерів в 1,8 раза (р < 0,05) відносно групи контролю, тоді як у хворих на АХП визначено збільшення відносного та абсолютного вмісту СD22+-клітин, що вказує на активацію гуморальної ланки імунітету.
3. При алкогольному ураженні печінки мало місце вірогідне збільшення ІЛ-6, TNF-α, співвідношення прозапальних і протизапальних цитокінів, розвиток інсулінорезистентності, в той час як для хворих із ТМГ характерним було суттєве зниження ІЛ-10.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/23.jpg)
/24.jpg)
/25.jpg)
/25_2.jpg)
/26.jpg)